
Repetitor_po_Khimii
.pdf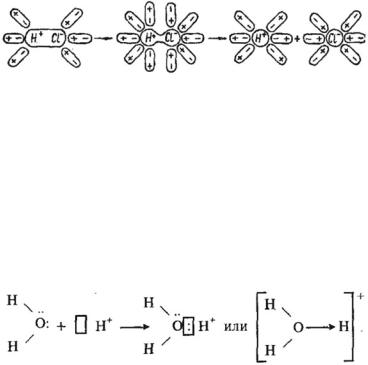
Рис. 22. Схема диссоциации электролита с полярной связью в водном растворе
Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности свя-
зей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электро-
литов все ионы находятся в гидратированном состоянии.
Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3О+ по донорно-акцептор-
ному механизму:
Н2О + Н+ Н3O+
Для простоты в химических уравнениях ионы изображают без молекул воды: Н+, Ag+, Mg2+, F–, SO32–, NO3– и т. д.
СВОЙСТВА ИОНОВ. Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na+ и хлорид-ионы Сl– не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na0 энергично взаимодействуют с водой. Вещество хлор Cl20 в свободном состоянии — газ желто-зе- леного цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и перехо-
210
дят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Ионы имеют различную окраску. Гидратированные и негидратированные ионы s- и p-элементов обычно бесцветны. Так, бесцветны ионы Н+, Na+, K+, Ва2+, Аl3+ и др. Ионы некоторых d-элементов имеют окраску. Окраска гидратированных и негидратированных ионов одного и того же d-элемен- та может быть различной. Например, негидратированные ионы Cu2+ — бесцветные, а гидратированные ионы меди Cu2+ · 4Н2О — синего цвета.
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
• Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
n
α = ——· 100 %, N
где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36 %. Это означает, что из 10 000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
CH3COOH CH3COO– + Н+.
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, α муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
211
При уменьшении концентраций электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами
врастворе и уменьшается возможность соединения их
вмолекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты де-
лятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электро-
литам относятся: 1) соли; 2) сильные кислоты (НСlО4, НСlО3, HNO3, H2SO4, HCl, HBr, HI и др.); 3) щелочи (LiOH, NaOH, КОН, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2).
Процесс диссоциации сильных электролитов является
необратимым, например:
NaNO3 Na+ + NO3–
HCl H+ + Cl–
KOH K+ + OH–
Сильные электролиты в водных растворах находятся только в виде ионов.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым
электролитам относятся: 1) слабые кислоты (НСlO2, HClO,
HNO2, Н2SО4, Н2СО3, H2SiO3, Н3РО4, Н3РО3, Н3ВО3, CH3COOH, H2S, HCN, HF и др.); 2) слабые нерастворимые
в воде основания (Fe(OH)2, Pb(OH)2, Cu(OH)7 и др.); 3) гидро-
ксид аммония (NH4OH); 4) вода (Н2О).
Диссоциация слабых электролитов — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, диссоциация) и соединение ионов в молекулы (ассоциация). Поэтому в уравнениях диссоциации слабых электролитов используется знак обратимости; например:
HNO2 H+ + NO2–
NH4OH NH4+ + OH–
212
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Кд). Вследствие того что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид
АnВm nAm+ + mBn–.
Применяя закон действующих масс, запишем выражение константы равновесия:
[Am+]n • [Bn–]m
Kp = —————————,
[АnВm]
где [Am+], [Bn–] — равновесные концентрации ионов Am+ и Bn–, [АnВm] — равновесная концентрация недиссоциирован-
ных молекул АnВm.
Константу равновесия в этом случае называют константой диссоциации (Кд) или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:
[CH3COO–] · [H+] –5 Kд(СН3СОOH) = ———————————= 1,8 · 10
[CH3COOH]
[H+] · [CN–]
Kд(НСN) = ————————= 8 · 10–10
[HCN]
Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN (Kд(СН3СОOH) > Kд(НСN)).
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в табл. 22.
213
Таблица 22
Константы диссоциации некоторых слабых электролитов в водных растворах (25 °С)
Химическая |
Название электролита |
|
Константа |
||||||||||
формула |
|
диссоциации |
|||||||||||
НIO |
3 |
|
|
Йодноватая кислота |
|
|
|
1,7 · 10–1 |
|||||
H |
|
|
SO |
2 |
|
Сернистая кислота |
К |
1 |
= 1,6 · 10–2 |
||||
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
К |
2 |
= 6,3 · 10–8 |
|
Н |
|
РO |
4 |
|
Фосфорная кислота |
К |
1 |
= 7,5 · 10–3 |
|||||
3 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
К |
2 |
= 6,2 · 10–8 |
|
|
|
|
|
|
|
|
|
|
|
К |
3 |
= 5,0 · 10–13 |
|
HF |
|
|
|
|
Фтороводородная кислота |
|
|
|
7,0 · 10–4 |
||||
HNO |
2 |
|
Азотистая кислота |
|
|
|
4,0 · 10–4 |
||||||
НСООН |
Муравьиная кислота |
|
|
|
1,8 · 10–4 |
||||||||
CH |
COOH |
Уксусная кислота |
|
|
|
1,8 · 10–5 |
|||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
СO |
3 |
|
Угольная кислота |
К |
1 |
= 4,5 · 10–7 |
|||||
2 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
K |
2 |
= 4,7 · 10–11 |
|
H |
S |
|
|
|
Сероводородная кислота |
K |
1 |
= 6,0 · 10–8 |
|||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
2 |
= 1,0 · 10–14 |
|
HClO |
|
Хлорноватистая кислота |
|
|
|
3,0 · 10–8 |
|||||||
HCN |
|
|
Циановодородная кислота |
|
|
8,0 · 10–10 |
|||||||
Н |
|
ВO |
3 |
|
Борная кислота |
|
|
5,7 · 10–10 |
|||||
3 |
|
|
|
|
|
|
|
|
|
|
|||
H |
|
SiO |
3 |
Кремниевая кислота |
К |
1 |
= 2,2 · 10–10 |
||||||
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
К |
=1,6 · 10–12 |
||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
НIO |
|
|
|
Йодноватистая кислота |
|
|
2,3 · 10–11 |
||||||
Pb(OH) |
2 |
Гидроксид свинца (II) |
K |
1 |
= 9,6 · 10–4 |
||||||||
|
|
|
|
|
|
|
|
|
|
К |
2 |
= 3,0 · 10–8 |
|
NH OH |
Гидроксид аммония |
|
|
|
1,8 · 10–5 |
||||||||
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
Н |
О |
|
|
|
Вода |
|
|
1,8 · 10–16 |
|||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Значение электролитов для живых организмов
Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Ионы натрия Na+, калия К+, кальция Са2+, магния Mg2+, водорода Н+, анионы ОН–, Сl–, SO42–, HCO3– имеют большое значение для физиологических и биохимических процессов. Концентрации различных ионов в организме человека различны. Концентрации ионов водорода Н+ и гидроксид-ионов ОН– очень малы, но они играют большую роль в жизненных процессах. Ионы водорода Н+ способствуют нормальному функционированию ферментов, обмену
214
веществ, перевариванию пищи и т. д. Концентрации ионов натрия Na+ и хлорид-ионов Сl– в организме человека весьма значительны. Эти ионы человек получает ежедневно, используя в пищу поваренную соль NaCl. В медицине применяется 0,85 %-й раствор хлорида натрия в качестве физиологического раствора при большой потере жидкости организмом.
Вопросы для контроля
1.Какие вещества называются электролитами, а какие — неэлектролитами?
2.Какие вещества относятся к электролитам и неэлектролитам? Приведите примеры.
3.Что называется электролитической диссоциацией, или ионизацией?
4.Кто и когда предложил теорию электролитической диссоциации?
5.Сформулируйте основные положения теории электролитической диссоциации.
6.Что такое ионы? Какие ионы называются катионами, а какие — анионами? Приведите примеры катионов и анионов.
7.Какая химическая связь существует в молекулах электролитов?
8.Как происходит диссоциация электролитов с ионной связью? Покажите схематически на примере.
9.Как происходит диссоциация электролитов с полярной связью? Покажите схематически на примере.
10.Какова главная причина электролитической диссоциации в водных растворах?
11.Чем объясняется различие в свойствах ионов и атомов одного и того же элемента?
12.Что называется степенью диссоциации? От чего она зависит?
13.Какие электролиты называются сильными, а какие — слабыми? Приведите примеры сильных и слабых электролитов.
14.Что характеризует константа диссоциации?
15.Каково значение электролитов для физиологических и биохимических процессов в живых организмах?
Задачи и упражнения для самостоятельней работы
1.Почему водный раствор серной кислоты проводит электрический ток, а безводная серная кислота не проводит? Ответ объясните.
2.Какие из следующих жидкостей проводят электрический ток: этиловый спирт, водный раствор глюкозы, водный раствор гидроксида натрия, раствор азота в воде, водный раствор сульфата натрия, расплав гидроксида калия? Ответ объясните.
215
3. В чем сходство и различие следующих частиц: а) К0 и К+, б) Br0 и Вr–, в) S0 и S2–, г) SO3 и SO32–, д) NО2 и NO2–? Как называются эти частицы?
4.Какие из следующих ионов являются катионами и какие анионами: Аl3+, Sr2+, F–, NO3–, Mn2+, Pb2+, SO42–, РО43–, Rb+?
5.Раствор фосфорной кислоты разбавили в 3 раза. Уменьшится или увеличится степень диссоциации кислоты?
6.Изобразите схему образования гидратированных ионов фторида калия при его растворении в воде.
7.Изобразите схему образования гидратированных ионов в водном растворе бромоводорода.
8.Напишите формулы электролитов, в водном растворе которых содер-
жатся ионы: a) Fe3+ и SO42–, б) Mn2+ и Сl–, в) Na+ и MnO4–, г) К+ и CrО42–, д) Fe2+ и NO3–, e) Ва2+ и ОН–, ж) Na+ и СО32–, з) Са2+ и NO3–.
§5.4. Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
•Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н+.
Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNO3 и б) двухосновной серной кислоты H2SO4:
а) HNO3 H+ + NO3–;
б) H2SO4 2Н+ + SO42–.
Слабые многоосновные кислоты (H2SO3, H2CO3, H2S, Н3РО4 и др.) диссоциируют ступенчато.
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример. Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н+):
Н2СO3 H+ + HCO3– Константа диссоциации по первой ступени
[H+] · [HCO–]
3 –7
K’д = —————————= 4,5 · 10 [H2CO3]
216
Вторая ступень диссоциации (отщепление иона водорода Н+ от сложного иона НСО3–):
НСO3– H+ + CO32–
K’д’ |
[H+] · [CO32–] |
= —————————= 4,7 · 10–11; |
|
|
[HCO3–] |
K’д > K’д’
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объяс-
няются присутствием в их растворах гидратированных ионов водорода Н+ (Н3О+).
• Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН–.
Составим уравнение электролитической диссоциации однокислотного основания — гидроксида калия КОН:
КОН К+ + ОН– Сильное двухкислотное основание Са(ОН)2 диссоции-
рует так:
Са(ОН)2 Са2+ + 2ОН–
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Me(OH)y, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гид- роксид-ион ОН–):
Fe(OH)2 FeOH+ + OH–;
[FeOH+] · [OH–] K’д = ———————————
[Fe(OH)2]
Вторая ступень диссоциации (отщепляется гидрок- сид-ион ОН– от сложного катиона FeOH+):
FeOH+ Fe2+ + ОH–;
[Fe2+] · [OH–] K’д’ = —————————
[FeOH+]
217
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксидионов ОН–.
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: К1, К2, К3 (см. табл. 22), причем К1 > К2 > К3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н+ или ОН– от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно
заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидро-
ксидов.
• Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН–, т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Аl(ОН)3, Cr(ОН)3 и др.
В амфотерных гидроксидах имеются связи между атомами металла и кислорода и между атомами кислорода и водорода (Me—О—Н). Связи Me—O и O—H сравнимы по своей прочности. Поэтому может происходить как разрыв связей Me—O с образованием гидроксид-ионов ОН– (диссоциация по типу основания), так и разрыв связей O—H с образованием ионов Н+ (диссоциация по типу кислоты).
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
2Н+ + ZnO2– |
H |
ZnO |
2 |
Zn(OH) |
2 |
Zn2+ + 2OH– |
2 |
2 |
|
|
|
||
По типу |
|
(в растворе) |
|
По типу |
||
кислоты |
|
|
|
|
|
основания |
|
|
Zn(OH)2 |
|
|
||
|
|
(осадок) |
|
|
||
• Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
218
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия К2СО3, б) сульфата алюминия Аl2(SО4)3:
а) К2СО3 2К+ + СО32–; б) Al2(SO4)3 2Al3+ + 3SO42–
• Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCO3:
NaHCO3 Na+ + HCO3– (α = 1)
Сложный анион НСО3– (гидрокарбонат-ион) частично диссоциирует по уравнению:
HCO3– H+ + CO32– (α 1)
• Основные соли — электролиты, которые при ассоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН–.
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Fe(OH)2Cl Fe(OH)2+ + Cl– (α = 1)
Сложный катион Fe(OH)2+ частично диссоциирует по уравнениям:
Fe(OH)2+ FeOH2+ + OH–;
FeOH2+ Fe3+ + OH–
Для обеих ступеней диссоциации Fe(OH)2+ α 1.
Вопросы для контроля
1.Что такое кислоты с точки зрения теории электролитической диссоциации?
2.Почему кислоты имеют общие свойства?
3.Что такое основания с точки зрения теории электролитической диссоциации?
4.Почему основания имеют общие свойства?
5.Что такое амфотерные гидроксиды с точки зрения теории электролитической диссоциации?
219
