
Repetitor_po_Khimii
.pdf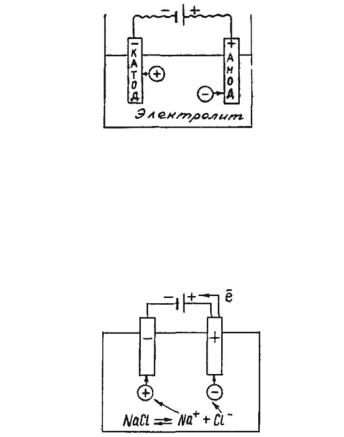




рядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от нее элементы побочных подгрупп являются металлами, а элементы главных подгрупп — неметаллами. Элементы, расположенные вблизи диагонали (например, Al, Ti, Ga, Ge, Sb, Те, As, Nb), обладают двойственными свойствами; в некоторых своих соединениях ведут себя как металлы; в некоторых — проявляют свойства неметаллов.
Все s-элементы (кроме Н и Не), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление элементов на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов элементов 3-го периода:
|
Положение элементов-металлов и неметаллов |
Таблица 30 |
|||||||
|
|
|
|||||||
|
|
в периодической системе |
|
|
|
||||
Группы |
II |
III |
IV |
V |
VI |
VII |
VIII |
||
Периоды |
I |
||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
Элементы главных |
|||
2 |
Все |
|
B |
Бор |
|
подгрупп являются |
|||
3 |
элементы |
Al |
|
|
|
неметаллами |
|
||
4 |
являются |
|
Ti |
|
As Элементы побочных |
||||
Ga |
Ge |
||||||||
5 |
металлами |
|
|
|
Nb |
|
подгрупп |
||
|
|
|
Sb |
Te |
|||||
|
|
|
|
|
|
|
|
||
6 |
|
|
|
|
|
|
At |
являются |
|
7 |
|
|
|
|
|
|
Астат |
металлами |
|
|
|
|
|
298 |
|
|
|
|
|

