
Marri_i_dr_-_Biokhimia_cheloveka_tom_1
.pdf180 |
/:'юн(/ /7 |
Для жвачных животных особое значение имеет превращение пропионата (главного глюкогенного продукта процесса брожения, происходящего в руб це) в сукцинил-СоА по пути, идущему через образо
вание метилмалонил-СоА (см. рис. 20.2).
Синтез жирных кислот (рис. 17.8)
Ацетил-СоА, образующийся из пирувата при
действии пируватдегидрогеназы, служит главным
строительным блоком при синтезе длинноцепочеч
ных жирных кислот У млекопитающих (исключе
нием являются жвачные животные, у которых аце
тил-СоА образуется непосредственно из ацетата). Поскольку пируватдегидрогеназа является мито
хондриальным ферментом, а ферменты синтеза жир
ных кислот локализованы вне митохондрий, клетки
должны осуществлять транспорт ацетил-СоА через
непроницаемую для него митохондриальную мем
брану. «Транспорт» осуществляется следующим
образом: ацетил-СоА вступает в цикл лимонной ки
слоты, где участвует в образовании цитрата; послед
ний транспортируется из митохондрии и В цитозоле
снова превращается в ацетил-СоА в результате реак-
ции, катализируемой ферментом АТР-цитрат
лиазой.
Цитрат + АТР + СоА -+ Ацетил-Соа + Оксалоацетат + АОР + Р,.
Регуляция цикла лимонной кислоты
Этот вопрос будет обсуждаться в гл. 22.
ЛИТЕРАТУРА
Воуег Р. D. (ed.) ТЬе Enzymes. 3rd ed., Academic Press, 1971. Good»'in Т. W. (ed.) ТЬе Metabolic Roles of Citrate, Academic
Press, 1968.
Greville С. D. Yol. ], р. 297. 'п: Carbohydrate Metabolism and Its Disorders, Dickens F., Randle Р. J .• Whelan W. J. (eds), Academic Press. 1968.
LO»'enstein J. М. Уо1. 1, р. 146. In: Metabo1ic Pathways, 3rd ed., Grenberg О. М.. (ed.). Academic Press, 1967.
Lo»'enstein J. М. (ed.) Citric Acid Сус1е: Contro1 and Compartmentation, Dekker. 1969.
Lowenstein J. М. (ed.) Citric Acid Сус1е, Yol. 13. In: Mcthods in Enzymology. Academic Press. 1969.
Srere Р. А. ТЬе enzymo1ogy ofthe formation and breakdown of citratc, Adv. Enzymol.. 1975. 43, 57.

Глава 18
гликолиз И окисление пирувата
Литер Мейес
ВВЕДЕНИЕ
Минимальные потребности в глюкозе имеют все
ткани. но у некоторых из них (например, тканей моз га, эритроцитов) эти потребности весьма значитель ны. ГЛИКО.'1Из--это главный путь утидизации глю
козы; он прогекает во всех клетках. Это уникальный
путь. поскольку он может использовать кислород.
ной кислоты повышается также при недостаточной
активности пируватдегидрогеназы.
гЛИКОЛИТИЧЕСКИЙ ПУТЬ
Анаэробный гликолиз
если последний доступен (аэробные условия), но мо
жет протекать 11 в отсутствие кислорода (анаэробные
условия).
БИО~IЕДИЦИНСКОЕ ЗНАЧЕНИЕ
Гликолиз-это не TO.11.KO главный путь метабо
лизма глюкозы, ведущи.Й к образованию ацетил
СоА и его ОКИСlеllИЮ в цикле лимонной кислоты, но
также и главный путь метаБОЛИ"Jма фруктозы и га
л~ктозы, поступ~ющих с пищей. Особенно важна
8 БИОМСДИIIИНСКОМ отношении способность гликоли
за к образованию Атр 8 отсутствие кислорода: это
позволяет поддеrживi.1Т1. Иlfтенсивную работу ске л~тной мышцы В условиях недостаточной эффектив
ности аэробного окисления; ткани с повышенной r ЛИКОЛИТl1ческой активностью способны сохраня гь
аКПfВНОСТl> в периоды кислородного голодания. В то же время в сердечной мышпс. адаптированной к ра боте D азробных условиях. возможности осуществле
ния гЛИКОЛИ"Jа ограниченны. она гяжсло переносит на
рушение кровоснабжения (ишеми.ю). Известно не сколько бодезней, обусловленных недосгаточной ак
тивностью ферментов гликолиза (например, пиру
ваткиназы); при "НИХ состояниях наблюдается гемо ЛИПlчсская анемия. В быстро растущих раковых
клетках гликолиз идет со скоростью. значительно
превышающей возможнасти цикла лимонной кисло ты. В резудьтате образование пирувата превосходит
его потребление. 'Это в свою очередь приводит
к образованию избытка лактата и к локальному по вышению кислотности в опухолевой ткани: эта осо
бенность метаболизма иногда используется в тера пии HCKoropbJx форм опухолей. Содержание молоч-
Уже на ранних этапах изучения метаболизма
углеводов было установлено, что процесс брожения
вдрожжах во многом сходен с распадом гликогена
вмышце. Исследования гликолитического пути про
водили именно на этих двух системах.
При изучении биохимических изменений в ходе мышечного сокращения было установлено, что при функционировании мышцы в анаэробной (бескисло
родной) среде происходит исчезновение гликогена
и появление пирувата и лактата в качестве главных
конечных продуктов. Если затем обеспечить посту пление кислорода, наблюдается «аэробное восста новление»: образуется гликоген, и исчезают пируват и лактат. При работе мышцы в аэробных условиях
накопления лактата не происходит, а пируват оки
сляется далее. преврашаясь в СО2 и Н2О. В результа
те этих наблюдений утвердилось разделение метабо лизма углеводов на анаэробную и аэробную фазы. Однако это разделение носит условный характер,
так как реакции гликолиза в присутствии кислорода
и в его отсутствие одни и те же,- различия касаются
лишь их скорости и конечных продуктов. При недо статке кислорода реокисление NADH, образовавше
гося из N АО в ходе гликолиза, осуществляется пу
тем сопряжения с восстановлением пирувата в лак
тат; образовавшийся при этом NAD обеспечи
вает дальнейшее протекание реакций гликолиза
(рис. 18.1). Таким образом, гликолиз может идти
в анаэробных условиях, но за это приходится рас
плачиваться, получая меньшее количество энергии
на моль утилизированной глюкозы. Следовательно,
ДЛЯ производства данного количества энергии путем
гликолиза при анаэробных УСЛОВИЯХ требуются БОль
шие количества глюкозы, чем при аэробных.
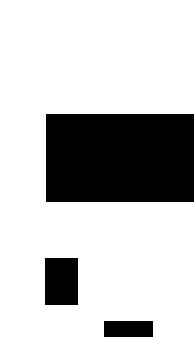
182
Глюкоза Гликоген
Гексозофосфат
Сб
ТРИОЗофосфат |
|
|
|
ТРИОЗОфоСфат |
|
|
• |
||||
Сз |
|
|
|
Сз |
|
|
|
|
|
||
----- NAD+ |
|
||||
|
NADH |
|
|
|
|
|
+н+ |
|
|
|
|
|
|
|
|||
Пирvват ~.• _,;::"",....:;;..._ |
Лактат |
||||
Сз |
|
|
|
|
Сз |
Гшва 18
битором гексокиназы:
M g1+
а-D-Глюкоза + АТР -+ а-D-Глюкозо-б-фосфат + АОР.
Гексокиназа, присутствующая во всех тканях, за
исключением паренхимы печени, имеет высокое
сродство (низкое КМ) к своему субстрату" глюкозе; ее функция состоит в том, чт~бы обеспечить захват
тканью глюкозы даже при низких концентрациях по
сл~дней в крови. Фосфорилируя практически всю по
ступающую в клетку глюкозу, гексокиназа поддер
живает значительный градиент концентрации глю
козы между кровью и внутриклеточной средой. Фер
мент действует как на 0-, так и на В-аномеры глюко
зы; он фосфорилирует также и другие гексозы, но со
значительно меньшей скоростью.
Функция глюкокиназы состоит в «захватыванию)
глюкозы из кровотока после приема пищи (когда
концентрация глюкозы в крови повышается). В от
личие от гексокиназы она имеет высокое значение КМ
дЛЯ глюкозы И эффективно функционирует при кон
центрации глюкозы в крови выше 100 Mf/lOO мл (см. рис. 22.7). Глюкокиназа специфична к глюкозе.
Глюкозо-6-фосфат занимает важное положение
Рис. 18.1. Общая схема гликолиза.
ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
Суммарное уравнение гликолиза, завершающе гося образованием лактата, следующее:
Глюкоза + 2АОР + 2Р; -+ 2L-Лактат + 2АТР + 2Н2О.
Все ферменты гликолитического пути (рис. 18.2)
находятся во внемитохондриальной растворимой
клеточной фракции (цитозоле). Они катализируют
реакции превращения глюкозы в пируват и лактат,
которые протекают в следующей последовательно
сти.
Гликолитический путь превращения глюкозы на
чинается с ее фосфорилирования в глюкозо- 6-фосфат. Эта реакция катализируется ферментом
гексокиназой; в паренхиматозных клетках печени эту
функцию выполняет индуцируемый фермент глюко
киназа, активность которого зависит от характера
питания. Донором фосфата служит АТР в виде ком
плекса Mg-ATP. что характерно и для многих дру
гих реакций фосфорилирования. При этом расходуе тся одна высокоэнергетическая фосфатная связь АТР и образуется АОР. Реакция сопровождается значительными потерями свободной энергии в фор ме теплоты. Поэтому при физиологических условиях эта реакция является необратимоЙ. Продукт реакции глюкозо-6-фосфат являегся аллостерическим инги-
в области стыковки ряда метаболических путей (гли
колиз, глюконеогенез, пентозофосфатный путь, гли
когенез и гликогенолиз) (рис. 18.2). В ходе гликолиза
он превращается во фруктозо-6-фосфат при участии
фосфогексозонзомеразы, при этом происходит аль
до-кето-изомеризация. Фермент действует только на а-аномер глюкозо-6-фосфата:
а-о-Глюкозо-6-фосфат ~ а-D-Фруктозо-6-фосфат.
Далее следует еще одно фосфорилирование. осу ществляемое АТР; оно катализируется фосфофрук токиназой (фосфофруктокиназа-I) с образованием фруктозо-I,6-бисфосфата. Фосфофруктокиназа так же является индуцируемым ферментом: считается,
что она играет главную роль в регуляции скорости
гликолиза. Реакция, катализируемая фосфофрукто киназой, также является необратимой при физиоло
гических условиях:
D-Фруктозо-6-фосфат + АТР -+ D-Фруктозо
-1.6-бисфосфат + АОР.
Фруктозо-I,6-бисфосфат расщепляется альдо лазой (фруктозо-I,6-бисфосфат-альдолазой) на два триозофосфата: глицеральдегид-З-фосфат и ди гидроксиацетонфосфат:
D-Фруктозо-l ,6-бисфосфат ~ 0-Глицеральдегид-
З-фосфат + Дигидроксиацетонфосфат.
Описано несколько различных альдолаз, и все они
состоят из четырех субъединиц. В большинстве тка ней находится альдолаза А, в печени и почках име
ется TaK~e альдолаза В. В клетке фруктозофосфаты

|
|
Глuколuз u окuслеlluе nируваmа |
183 |
|||
|
|
|
Гпикоген |
|
||
|
|
|
ГПЮКОЗ0-1-фосфат |
|
||
СНОН |
I ГЕКСОКИНАЗА |
|
~ |
® |
-® |
|
H~H2~н:i::г:~:ю:ко:~:;:::~:з:д:~~.~н~Н |
|
;;rн~:~==Фи=Оз=С~=~=~=;=:=~д=О=З=О~-~~:20Н |
||||
Н ОН |
ДТР |
ДОР |
Н |
|
ОН |
ОН Н |
а-О- Гпюко38 |
|
а-О-Гпюкозо-б-фосфат |
|
|||
~Фруктозо-1,б-бисфосф8т
дор
З~~гnицерат |
|
1,3- БИСфосфогпицерат |
|
|
Гпицерап~егид-3~осфаТ |
|||
11 |
ФОСФОГПИЦЕРАТМУТАЗА |
|
|
|
%02 |
|||
|
|
Митохондриапьная |
||||||
|
|
|
|
|
|
|
||
соо- |
|
|
|
|
|
|
ЗАТР |
|
Н-t-o~ |
2~осфогпицерат |
|
|
|
||||
|
|
: |
|
|||||
I |
|
|
|
|
|
I |
, |
|
СН |
2ОН |
|
|
|
Анвзробн",е условиR |
|
||
М<}+~:':--I |
ЕНОПАЗА |
|
|
i! |
|
|||
Gr1"" |
--1 |
|
|
|
|
1 |
I |
|
СОО- |
|
|
|
|
I |
I |
|
|
I |
|
|
Фосфоеноппируват |
|
|
1 |
|
|
с-о-® |
|
Окисление |
,1 |
, |
|
|||
11 |
|
|
|
, |
I |
|
||
СН |
|
|
|
в цикле |
|
|
|
|
у: |
|
|
лимонной |
|
1 |
I |
|
|
Mg2+ r-::: |
|
T~NAoJH+ |
JAO+ |
|
||||
соо- |
Самоnроизволl>НО |
соо- |
|
') |
соо |
|||
. I |
|
I |
|
\.. |
|
но-Ь-н |
||
с-он |
|
• |
С= О ~..t;::::::==-===~-=:;::::==:::-. |
|||||
11 |
|
|
|
I |
|
|
|
1 |
СН2 |
|
|
СНз |
|
|
|
СНз |
|
(Еноп) |
|
|
(Кето, |
|
|
|
l(+)-Лактат |
|
Пируват |
|
|
Пируват |
|
|
|
||
|
|
|
|
|
|
|||
Рис. 18.2. Последовательность реакций гликолиза_ Обозначения: ®--(- PO~-); Pi-HOPO~--; е-ииrибироваиие_
Атомы углерода 1-3 в молекуле фруктозобисфосфата участвуют в образовании дигидроксиацетонфосфата. а атомы
углерода 4--6-в образовании глицеральдегид-3-фосфата_
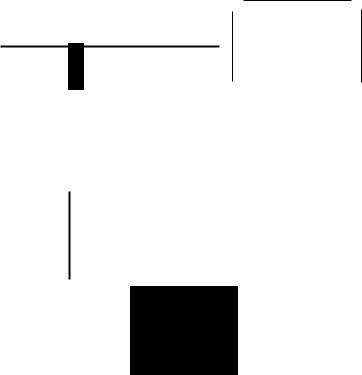
184 |
Глава /8 |
находятся преимущественно в фуранозной форме, но фосфогексозоизомераза, фосфофруктокиназа
и альдолаза действуют на молекулы, имеющие «от·
крытую» линейную конфигурацию.
Глицеральдегид·3-фосфат и дигидроксиацетон· фосфат превращаются друг в друга при участии фер мента фосфотриозоизомеразы:
D-Глицеральдегид-3-фосфат ~ Дигидроксиаце тонфосфат.
Следующей стадией гликолиза является окисле ние глицеральдегид-3-фосфата с образованием 1,3- бисфосфоглицерата; дигидроксиацетонфосфат при участии фосфотриозоизомеразы также окисляется
в l,3-бисфосфоглицерат, проходя через стадию обра
зования глицеральдегид-3-фосфата:
D-Глицеральдегид-3-фосфат + NAD+ + Pj~ 1,З
Бисфосфоглицерат + NAOH + Н+.
Фермент, катализирующий эту реакцию,
NАD-зависимая r лицеральдегид-3-фосфатдеrидро-:
геназа. В структурном плане она состоит из четырех идентичных полипептидов, образующих тетрамер.
Каждый полипептид содержит по четыре- SH-груп пы, принадлежащие остаткам цистеина. Од на из них находится в активном центре фермента.
Полагают, что она принимает участие в окислении
глицеральдегид-3-фосфата. Сначала субстрат соеди
няется с остатком цистеина дегидрогеназы, образуя
Н-С=О
I
Н-С-ОН
тиополуацеталь, который окисляется в тиоловый эфир; атомы водорода, отщепленные при этом оки
слении, переносятся на связанный с ферментом NAD. Образующийся NAOH связан с ферментом менее прочно, чем NAO. и поэтому легко замещае тся другой молекулой NAD. Реакция завершается фосфоролизом тиоэфирной связи С присоединением неорганического фосфата Pj ; при этом образуются 1,3-бисфосфоглицерат и свободный фермент с
-SН-группой (рис. 18.3). Потенциальная энергия
процесса окисления резервируется сначала в высо
коэнергетической тиоэфирной связи, а после фосфо ролиза- в высокоэнергетической фосфатной свя зи 1,3-бисфосфоглицерата, находящейся в положе нии 1. Высокоэнергетический фосфат переходит да лее в состав АТР при участии фермента фосфоглице раткиназы, при этом образуется 3-фосфоглицерат:
1.3-Бисфосфоглицерат + АОР ~ 3- Фосфоглицерат + АТР.
Поскольку на каждую молекулу глюкозы, уча
ствующую в гликолизе, образуются две м~)Лекулы
триозы. то на рассмотренной стадии образуются две молекулы АТР на молекулу глюкозы. Здесь мы имеем пример фосфорилирования «на субстратном
уровне»_
В присутствии арсената, который конкурирует
I |
|
|
|
|
|
|
|
|
|
|||
СН2"О-® |
|
|
|
|
|
|
|
|
|
|||
глицеральдегид-3-фосфат |
|
|
|
|
|
|
|
|
|
|||
..---_........._--- |
|
|
|
|
|
|
||||||
Фермент-сvбстратный комллекс |
||||||||||||
|
|
нs-Ф |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||||
|
СВАзаННЬ8IЙ кофермент |
|
|
Окисление |
||||||||
|
|
|
||||||||||
?-® |
|
|
|
|
|
|
|
|
сvбстрата |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
с=о |
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|||
н-с-он |
|
--- Pi |
|
|
|
|
|
|
||||
I |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
CHi""O-® |
|
|
|
|
|
|
|
|
|
|||
1,3- Бисфосфоглицерат.__----IL---_. |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||||
|
|
s-ф |
|
|
|
|
s- ф |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
~=OI |
|
NAD+ |
|
I~ |
|
|||||
|
|
|
|
8 |
|
|
С==О |
NADH |
|
|||
|
Н- у-он |
|
|
н-уI -он .+Н+ |
|
|||||||
|
|
СН2"О-® |
|
СН2-О-® |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
PIIC. 18.3. Окисление глицеральдегид-З-фосфата. Ф-глицеральдеrид-З-фосфатдегвдрогенаэа. Фермент инrиБИРУСТСJl ре_
агентом на - SН-rpуппы lIO_цетатом, который, следовательно, способен подаВЛJlТЬ ГЛИ.ЮЛиз.
Гликолиз и окисление пирувата |
185 |
с неорганическим фосфатом (Pj ). образуется 1- арсено-3-фосфоглицерат, самопроизвольно гидро лизующийся до 3-фосфоглицерата с выделением теп лоты. но без образования АТР. Это важный пример
способности арсената разобщать процессы окисле
ния и фосфорилирования.
Образовавшийся на предыдущей стадии 3- фосфоглицерат превращается в 2-фосфоглицерат при участии фермента фосфоглицератмутазы. Пола гают, что на промежуточной стадии реакции обра зуется 2.3-бисфосфоглицерат (DPG):
3-Фосфоглицерат +-+ 2-Фосфоглицерат.
На следующей стадии, катализируемой енолазой,
происходит отщепление молекулы воды и перерас
пределение энергии внутри молекулы, при этом фо сфат в положении 2 переходит в высокоэнергетиче
ское состояние; продуктом реакции является фо..
сфоенолпируват. Енолаза ингибируется ионами фто рида; этим пользуются в тех случаях, когда необхо
димо остановить гликолиз, например перед опреде
лением содержания глюкозы в крови. Енолаза ну ждается в ионах Mg2+ или Мn2 +:
2-Фосфоглицерат +-+ Фосфоенолпируват + Н2О.
Выс6коэнергетический фосфат фосфоенолпиру
вата переносится на АОР ферментом пируваткина зой; на этой стадии образуются еще две молекулы АТР на молекулу глюкозы. Образующийся в ходе
реакции енолпируват самопроизвольно переходит
в кетоформу, т. е. пируват. Это-еще одна неравно
весная реакция, сопровождающаяся значительной
потерей свободной энергии в форме теплоты; она является физиологически необратимой:
Фосфоенолпируват + АОР -+ Пируват + АТР.
щийся лактат может быть обнаружен в тканях, кро ви и моче. ГЛllКолиз в эритроцитах даже в аэробных
условиях всегда завершается образованием лактата.
поскольку в этих клетках отсутствуют митохондрии,
содержащие фермент,,:ые системы аэробного окисле
ния пирувата. Эритроциты млекопитающих уника
льны в том отношении, что около 900/0 их потребно
стей в энергии обеспечивается гликолизом. Помимо скелетной мышцы и эритроцитов ряд других тканей (мозг, желудочно-кишечный тракт, мозговой слой почек, сетчатка и кожа) в норме частично исполь
зуют энергию гликолиза и образуют молочную ки
слоту. Печень, почки и сердце обычно утилизируют лактат. но в условиях гипоксии образуют его.
Хотя большая часть гликолитических реакций
обратима, три из них носят ярко выраженный экзер гонический характер и поэтому могут рассматрива
ться как физиологически необратимые. Это реакции,
катализируемые гексокиназой (и глюкокиназой), фо
сфофруктокиназой и пируваткиназой; они служат
главными участками, на которых происходит регу
ляция гликолиза. Клетки, способные направить дви
жение метаболитов гликолитического пути в направ лении синтеза (глюконеогенез), используют различ
ные ферментные системы, обеспечивающие протека
ние процесса в обход упомянутых выше необрати
мых стадий. Об этом будет подробнее сказано ниже, когда будут обсуждаться процессы глюконеогенеза.
2,3-Бисфосфоглицератный цикл
В эритроцитах многих млекопитающих имеется
фермент, позволяющий направить процесс в обход
стадии, катализируемой фосфоглицераткиназой; при
Взависимости от окислительно-восстано этом свободная энергия. обусловленная присут
вительного сост~яния ткани дальнейший процесс
может идти по одному из двух путей. В анаэробных условиях реокисление NADH путем переноса восста
новительных эквивалентов на дыхательную цепь
и далее на кислород происходить не может. Поэтому NADH восстанавливает пируват в лактат. эта реак ция катализируется лактатдегидрогеназоЙ. Описано несколько изозимов этого фермента, определение их
имеет клиническое значение.
Пируват + NADH + Н+ +-+ L-Лактаl' + NAD+.
ствием высокоэнергетического фосфата в молекуле 1,3-бисфосфоглицерата, рассеивается в форме тепло ты (рис. 18.4). Дополнительный фермент бисфосфо глицератмутаза катализирует превращение 1,3- бисфосфоглицерата в 2,3-бисфосфоглицерат, послед ний далее превращается в 3-фосфоглицерат при уча стии 2,3-бисфосфоглицератфосфатазы (принято счи тать, что этой активностью обладает фосфоглице
ратмутаза). Потеря на этой стадии высокоэнергети
ческого фосфата означает, что процесс гликолиза бо лее не сопровождается производством АТР. В этом
Реокисление NADH путем образования лактата обе
спечивает возможность протекания гликолиза в от
сутствие кислорода, поскольку поставляется NAD+,
необходимый для глицеральдегид-3-фосфатдегид
рогеназной реакции. Таким образом, в тканях, функ ционирующих в условиях гипоксии, наблюдается
образование лактата (рис. 18.2). Это в особенности
справедливо в отношении скелетной мышцы, интен сивность работы которой в определенных пределах
не зависит от поступления кислорода. Образую-
может заключаться определенное преимущество, по
скольку даже в тех случаях, когда потребности
в АТР минимальны, гликолиз может продолжаться. Обра.зующиЙся 2,3-бисфосфоглиuерат связывается с гемоглобином, понижая сродство последнего к ки
слороду, т. е. сдвигает кривую диссоциации оксиге
моглобина вправо. Таким образом. присутствие 2,3-
дифосфоглицерата в эритроцитах способствует диссо
циации кислорода из оксиrемor:лобина и переходу его
в ткани (см. гл. 6).
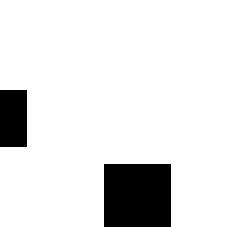
186 |
Глава 18 |
|
н-с-о ~--- ГЛЮКОЗ8 |
поилдегидрогеиазы. Восстановленный флавопротеин |
|
I |
окисляется NAD, который в свою очередь передает |
|
н-с-он |
||
I |
восстановительные эквиваленты на дыхательную |
|
сн2-о-@ |
цепь: |
|
Глицерал..дегид-3-фосфат |
||
|
Pi~NAD.
Iглицерал..дerид-3-фосфатдегидрогеН8за I
NADH +Н·
~
с-о-р
н-е-он |
|
мутаза |
||||
I |
|
|
|
|||
|
|
|
||||
снго-@ |
|
|
|
|||
1 3·Бисфосфоглицер8Т |
|
|
|
|||
АОР |
|
|
уоо |
|||
Фосфоглицерат |
||||||
|
н-с-о-® |
|||||
|
мутаза |
|
I |
|||
|
|
|
сн2-о-@ |
|||
|
|
|
||||
АТР |
2.3- Бисфосфоглицерат |
|||||
~OO |
|
|
|
н-с-он |
|
|
|
I |
|
|
|
|
2.3·БИСфосфоглицера'F |
||
СН:гО-@ |
|
||
|
фосфатаза |
||
3-Фосфоглицерат |
|
||
|
|
|
|
L __ ..... |
Пируват |
||
|
|||
Рис. 18.4. 2.З-БисфосфоглицератныЙ цикл в эритроцитах.
ОКИСЛЕНИЕ ПИРУВАТА В АЦЕТИЛ-СоА
Прежде чем пируват вступает в цикл лимонной
кислоты, он должен быть транспортирован в мито
хондрию; специальный переносчик обеспечивает
перенос молекул пирувата через внутреннюю мито
хондриальную мембрану по механизму симпорта
с протоном (см. рис. 13.15). Внутри митох()ндрии происходит окислительное декарбоксилирование пи
рувата и образование ацетил-СоА. Эта реакция ката
лизируется несколькими различными ферментами,
работаюuцими в определенной последовательности
и объединенными в мультиферментный пируватде гидрогеиазиый комплекс. аналогичный u-кетоглу
таратдегидрогеназному комплексу, участвующему
в цикле лимонной кислоты (см. с. 174). Пируват декарбоксилируется в присутствии тиаминдифосфа
та, при этом происходит перенос гидроксиэтиль
ной группы на тиазольное кольцо связанного с фер
ментом тиаминдифосфата; далее это ГИДРОКСJi,эти
лы1еe производное вступает в реакцию с окислен
ным липоамидом с образованием ацетиллипоамида
(рис. 18.5). В присутствии ДИГИДролипоилтрансфера
зы ацетиллипоамид реагирует с коферментом А,
образуя ацетил-СоА и восстановленный липоамид. Завершается цикл реокислением липоаМИДi\ в реак ции с флавопротеином в присутствии дигидроли-
Пируват + NAD+ + СоА --+ Ацетил-СоА +
NADH + Н+ + С02•
В пируватдегидрогеназный комплекс входит при
мерно 29 молекул пируватдегидрогеназы, около
8 молекул флавопротеина (дигидролипоилдегидро геназы) и 1 молекула трансацетилазы. Перемещение индивидуальиых ферментов в комплексе, по
видимому, ограничено, а интермедиаты не диссо
цИируют, оставаясь связанными с ферментами.
Следует отметить, что пируватдегидрогеназная
система характеризуется большим отрицательным
окислительно-восстановительным потенциалом, ко
торый обеспечивает наряду с восстановлением ко фермента (NADH) образование высокоэнергетиче
ской тиоэфирной связи В ацетил-СоА.
Клинические аспекты метаболизма пирувата
Арсенат, а также ионы ртути образуют комплек
сы с -SH-группами липоевой кислоты и ингиби
руют пируватдегидрогеназу; при недостаточном со
держании тиамина в диете активность пируватдегид
роrеназы снижается и пируват может накапливаться.
Недостаток тиамина возникает у алкоголиков с на
рушенным режимом питания; при введении им глю
козы может происходить быстрое накопление пиру
вата и лактата, приводящее клактатацидозу, неред
ко с летальным исходом. У больных с наследствен
ной недостаточностью пируватдегидрогеназы также
может развиваться лактатацидоз, особенно после
глюкозной нагрузки. Зарегистриj:юваны мутации
практически всех ферментов углеводного метабо
лизма, и в каждом случае их следствием является за
болевание человека.
Энергетика окисления углеводов
При сжигании в калориметре 1 моль глюкозы
с образованием С02 и Н2О выделяется приблизите
льно 2780 кДж теплоты. Когда окисление глюкозы происходит в тканях, часть высвобождаемой эне ргии не теряется в форме теплоты, а «улавливается» В виде высокоэнергетических фосфатных связей. На
молекулу глюкозы, окисляющуюся до С02 И Н2О.
образуется примерно 38 высокоэнергетических фо сфатных связей. Если принять, что энергия высо коэнергетической связи равна 30.5 кДж. то суммар ная энергия, запасаемая в форме АТР, составит 1159
кДж на 1 моль глюкозы (приблизительно 41,7% от энергии сгорания). Большая часть АТР образуется
в процессе окислительного фосфорилирования при
окислении восстановленных коферментов дыхатель-
Рис. 18.5. А - окислительное декарбок
силирование пируuата пируватдегидро
геЯаЗJIЫМ комплексом. Б- липоевая
кислота. Она присоединяется амидной
связью к остаткам лизина трансацети-
лазного компонента комплекса.
|
|
|
NH |
|
|
|
н |
|
|
|
|
|
|
|
|
|
Б |
|
|
|
2 |
|
|
1 |
|
|
|
|
|
|
|
|
|||
|
1 |
|
|
C-S |
|
|
|
|
|
|
|
|
|||||
|
|
~C'C-CH |
_ +~ |
|
I ТиаминдифосфаТ |
|
|
|
|||||||||
|
1 |
11 2 |
, |
с=с-сн |
|
|
-сн |
® |
|
|
|
|
|||||
н с-с |
сн |
|
2 |
-о- р -® |
|
|
|
||||||||||
з |
|
|
~N/ |
|
|
|
I |
СНз |
2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
ПИРУВАТ- '~СНз-С-GOO7" |
|
|
|
|||||||||||
|
|
ДЕГИДРОГЕНА3А r |
|
|
~ |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
соо- |
|
Пирvват |
н |
|
||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НзС-9-0Н |
|
|
|
НЗС-С -он |
|
|||||||
|
|
|
|
|
|
|
С- s |
|
|
|
|
|
t-s Гидроксиэтил |
||||
|
|
|
|
|
- |
+~ |
|
It;::=~===~-+r( I |
тиамин |
||||||||
|
|
|
|
|
|
дифосфат |
|||||||||||
|
|
|
|
|
|
|
С=С- |
|
|
|
|
|
С=С- |
|
|||
|
|
|
|
|
|
|
ЬНЗ |
|
|
|
|
|
tНз |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
ДИГИДРОЛИПОИЛ |
|
s] Окисленный |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
ТРДНСАЦЕТИЛАЗД |
|
||||
А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[(1's |
ЛИПО8МИД |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
|
ДИГИДРОЛИПОИЛ- |
CoA-SН [. |
О |
Ацетил- |
||
|
|
|
|
|
|
~ |
........... S-С-СНз |
||||
|
|
|
|
|
ТРАНСАЦЕТИЛА3АIJ |
|
11 |
|
|
||
|
|
|
|
сод-s-с-снз • ? |
|
L |
|
|
|
||
|
|
|
|
|
|
r{SH1 |
|
|
|
|
липоамид |
|
|
|
|
Ацетил-СоА |
|
|
""-SH |
] |
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
L'SHJ |
|
|
|
|
|
|
|
|
|
|
|
Восстановленнь.Й --:=:========::::;---Т-: |
|||||
|
|
|
|
|
|
липоамид |
ДИГИДРОЛИПОИЛ |
FADH 2 |
|||
|
|
|
|
|
|
|
ДЕГИДРОГЕНА3А |
F'~ |
|||
|
|
|
|
|
|
|
|
|
|
|
~ NAD+ |
|
|
|
|
|
|
|
|
|
|
|
NADH + н+ |
Таблица 18.1. Образование 8ысоко:энергетических фосфатных связей в ходе катаболизма глюкозы |
|
||||||||||
|
|
|
|
|
|
|
|
|
|||
Метаболический |
Фермент |
|
Место образования - |
0 |
|
|
Число связей |
||||
|
путь |
|
|
и сопряженный процесс |
|
|
'"0, обра |
||||
|
|
|
|
|
|
|
|
|
|
|
зовавшихся |
|
|
|
|
|
|
|
|
|
|
|
на 1 моль |
|
|
|
|
|
|
|
|
|
|
|
глюкозы |
|
|
|
|
|
|
|
|||||
Гликолиз |
|
|
Глицеральдегид-3-фосфатдегидрогеназа |
Окисление 2 NADH в дыхательной цепи |
|
||||||
|
|
|
|
Фосфоглицераткиназа |
Окисление на субстратном уровне |
|
|||||
|
|
|
|
Пируваткиназа |
Окисление на субстратном уровне |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
с учетом расходования Атр в реакциях, катализируемых гексокиназой и фосфофруктокиназой |
|
|
-2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Итого 8 |
|
|
|
|
|
|
|
|||||
Цикл |
лимонной |
Пируватдегидрогеназа |
Окисление 2 NADH в дыхательной цепи |
6 |
|||||||
кислоты |
. Изоцитратдегидрогеназа |
Окисление 2 NADH в дыхательной цепи |
6 |
||||||||
|
|
|
|
а-Кетоглутаратдегидрогеназа |
Окисление 2 NADH в дыхательной цепи |
6 |
|||||
|
|
|
|
Сукцинаттиокиназа |
Окисление на субстратном уровне |
2 |
|||||
|
|
|
|
Сукцинатдегидрогеназа |
Окисление 2 FADH~ в дыхательной цепи |
4 |
|||||
|
|
|
|
~алатдегидрогеназа |
Окисление 2 NADH в дыхательной цепи |
6 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Итого 30 |
|
|
|
|
|
|
|
|
|
|
||
Всего на |
моль глюкозы в аэробных условиях |
|
|
|
|
|
|
38 |
|||
Всего на |
моль клюкозы в анаэробных условиях |
|
|
|
|
|
|
2 |
|||
|
|
|
|||||||||
1) |
В предположении, что NADH, обраЗОВ<tВШИЙСЯ в ходе гликолиза, поступает в митохондрию С помощью~л<tТНОГО челночиого ме |
||||||||||
ханизма (см. рис. 13.15)_ Если используется глицерофосфатный челночный механизм, образуется только 2 - |
\.V на |
1 моль NADH, |
|||||||||
и количество образовавшихся фосфатных связей будет уже не 38, а 36. Расчеты проведены без учета небольших потерь Атр при сопряженном переносе в митохондрию н... И пирувата и при аналогичном переносе Н + • свойственном малатному
челночному механизму. на что уходит примерно 1 моль Атр.
188 |
Глава 18 |
ной цепью. Другая часть АТР образуется в результа те фосфорилирования, происходящего «на субстрат
ном уровне» (см. гл. 13). В табл. 18.1 даны реакции,
в которых происходит образование высокоэнергети
ческих фосфатов при катаболизме глюкозы, с указа нием эффективности процесса в аэробных и анаэроб
ных условиях.
ЛИТЕРАТУРА
Вlass J. Р. Disorders ofpyruvate metabolism, Neuro1ogy, 1978,
29, 280.
Воуег Р. D. (ed.) ТЬе Enzymes, 3rd ed., Vols. 5-9, Academic Press, 1972.
Dickens F.. Randle Р. J.. Whelan W. J. (eds) Carbohydrate Ме tabolism and lts Disorders, 2 vols., Academic Press, 1968.
Greenherg D.M. (ed.) Metabo1ic Pathways. 3rd ed.• Уо1. 1. Academic Press, 1967.
Randle Р. J.. Steiner D. F.. Jf,'helan W. J. (eds) Carbohydrate Metabolism and Its Disorders. Vol. 3, Academic Press. 1981.
Veneziale С. М. (ed.) The Regulation ofCarbohydrate Formation and Uti1ization in Mammals. University Park Press. 1981.

Глава 19
~етаболизм гликогена
Литер Мейес
ВВЕДЕНИЕ
Гликоген- главная .форма запасания углеводов
у животных; в растениях эту роль играет крахмал.
Гликоген запасается главным образом в печени (до
6% от массы печени) и в мышцах, где его содержание редко превышает 1% (табл. 19.1). Как и крахмал,
гликоген является разветвленным полимером а
глюкозы (см. рис. 14.15).
БИОМЕДИЦИНСКОЕ ЗНАЧЕНИЕ
Функция мышечного гликогена состоит в том,
что он является легкодоступным источником гексо
зных единиц, используемых в ходе гликолиза в самой мышце. Гликоген печени иопользуется главным
образом для поддержания физиологических концен
траций глюкозы В крови, прежде всего в промежутках
между приемами пищи. Через 12-18 ч после приема
пищи запас гликогена в печени ПОЧ"IИ полностью
истощается. Содержание мышечного гликогена за метно снижается только после продолжительной
и напряженной физической работы. Повышенное со
держание гликогена в мышцах может наблюдаться
при диете с высоким содержанием углеводов, если
перед этим запасы гликогена были снижены в резу
льтате высокой мышечной нагрузки. Под названием «болезни накопления гликогена» объединяют ряд
наследственных болезней, при которых наблюдается нарушение мобилизации гликогена или отложение
его в нефизиологических формах.
Таблица 19.1. Запасы углеводов в организме нормального взрослого человека (массой 70 кг) после приема пищи-
Гликоген печени |
4,0% |
= 72 r ll |
Мышечный гликоген |
0,7% |
= 245 г 2) |
Внеклеточная глюкоза |
0,1% |
= 10 г)) |
|
|
|
|
Итого |
327 r |
1. Масса печени 1800 r.
71 Масса МЫШЦ 35 Kr.
ГЛИКОГЕНЕЗ
Биосинтез гликогена (рис. 19.1)
Глюкоза фосфорилируется до глюкозо-6- фосфата, это та же реакция, которая является пер
вой стадией гликолиза. Реакция катализируется в мышцах гексокиназой, а в печени - глюкокиназоЙ.
Глюкозо-6-фосфат превращается в глюкоз0- l-фосфа: в результате реакции, катализируемой фо сфоглюкомутазой. Этот фермент (Ф) находится в фос форилированной форме, его фосфогруппа (Р) участ
вует в обратимой реакции, интермедиатом которой
является глюкозо-l,6-бисфосфат:
Ф-Р + Глюкозо-6-фосфат+-+Ф + Глюкоз0- 1,6-бисфосфат +-+ Ф- Р + Глюкозо-l-фосфат.
Далее глюкозо-l-фосфат реагирует с уридинтрифо сфатом (UTP); в результате образуется активный ну клеотид уридинд~фосфатглюкоза (UDPGlc) 1 (рис.
19.2).
Реакция между глюкозо-l-фосфатом и уридин трифосфатом катализируется ферментом UDPGlc- пирофосфорилазой:
UTP + Глюк.озо-l-фосфат+-+ UDPG1c + PPj •
Последующий гидролиз неорганического пирофо сфата, катализируемый неорганической пирофосфа
тазой, сдвигает равновесие реакции вправо.
При действии фермента гликогеисиитазы (или глюкозилтрансферазы) образуется гликозидная связь между атомом С, активированной глюкозы, находящейся в составе UDPGlc, и атомом С4 концевого остат.ка глюкозы в гликогене с освобо ждением уридиндифосфата (UDP). ДЛЯ инициирова-
1 Известны и другие нуклеозиддифосфатсахара, на пример UDPGal. Кроме того, один и тот же сахар может быть связан с различными нуклеотидами. Например. глю
коза может быть связана с уридиновым (как в приведенном
выше примере), гуанозиновым, тимидиновым, аденозино
)) Общий объем внеклеточной жидкости 10 л. |
вым и ЦИТИДИIЮВЫМ нуклеотидами. |
|
