Marri_i_dr_-_Biokhimia_cheloveka_tom_1
.pdf
170 |
|
|
|
Глава 16 |
|
|
|
|
|
|
Глмкоrен |
|
|
|
~~, |
Белок |
|
||||
Н |
|
|
ДК |
|
||||||
|
Цитоэоп" |
|
'.~. |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Г-1T~~·'· |
|
|
Жирн.... KMCnOT'" |
|
||||||
Трмоэофосфат.. |
• Глмц.ролфосфат Трмацмnrлмц.рол |
|
||||||||
|
|
|
|
ГП~РОЛ |
)" |
|
/ |
|
|
|
|
|
|
|
|
|
|
|
|||
1 |
|
|
~---_/ ....._---/ |
|
|
|
|
|||
|
ЛакТ8Т |
|
|
|
|
|
|
|
||
Фосфоеноппируват ~ f |
|
|
|
|
|
|
|
|||
|
|
|
п:~......__.:: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
~. ,.. |
П1UТ"Z .....::.. ·:·i··········~ |
|||||||
|
|
I~:-·.... ... |
|
|
|
|
|
|
|
|
|
|
" |
!окcanоацатат,АЦетип_СоД~~)у |
|||||||
|
|
:.. |
|
t |
|
|
|
"М . |
||
|
|
|
|
|
|
|
КетоНоВ.... |
.' |
||
|
АК |
|
~ф \ар8Т |
цикп:и:онной |
Цf"Т~Т |
|
.~:.:.:. |
|
||
|
|
. |
|
киcnот", |
СО2 |
|
|
дк |
|
|
дк
Cyiнмn~r\T~../
.. ~~~~.>
Митохондрмя " . : '. ~ДК
ДК
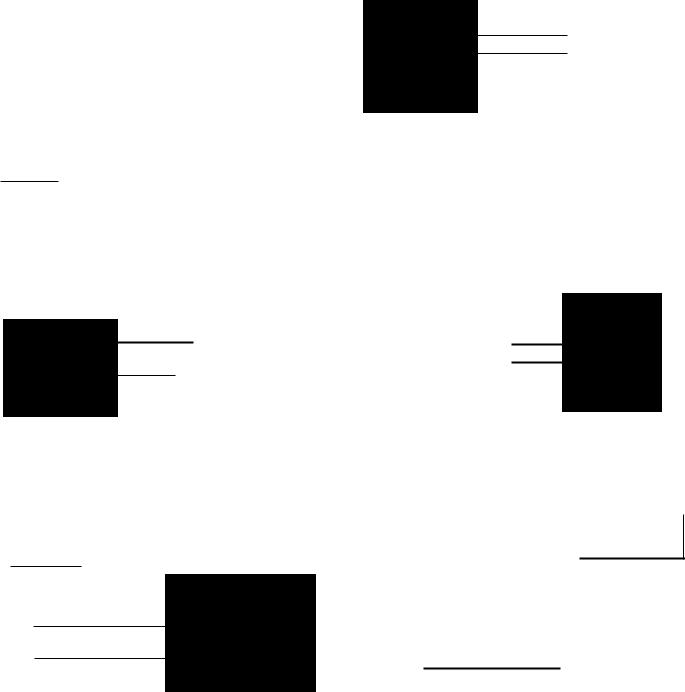
Рис. 16.7. Внутриклеточная локализация и интеl-рация главных метаболических путей в паренхиматозной клетке печени.
АК -+ метаболизм одной или нескольких незаменимых аминокис:ют; АК+-+ метаболизм одной или нескольких замени
мых аминокислот.
моноацилглицеролы и жирные кислоты. В клетках |
и используются как топливо. Другим важным источ |
кишечника они ассоциируются с белками и секрети |
ником длинноцепочечных жирных кислот является |
руются сначала в лимфатическую систему, а затем |
их синтез (липогеиез) из углеводов. идущий главным |
в систему кровообращения, в которой циркулируют |
образом в жировой ткани и в печени. |
в виде липопротеина, известного под названием хило |
Триацилглицерол жировой ткани служит глав |
микрон. Все гидрофобные липидрастворимые про |
ным топливным резервом организма. После его гид |
дукты пищеварения (в частности, холестерол) вклю |
ролиза (липолиза) жирные кислоты освобождаются |
чаются в состав липопротеинов. что облегчает их |
и поступают в систему кровообращения. Свободные |
транс~ортировку от ОДНОЙ'ткани к другой в водной |
жирные кислоты далее поглощаются большинством |
среде-плазме. В отличие от глюкозы и аминоки |
тканей (за исключением мозга и эритроцитов). где |
слот триацилглицеролы в составе хиломикрона не |
они либо эстерифицируются, образуя ацилглицеро |
захватываются печенью, они гидролизуются во вне |
лы, либо окисляются дО СО2, выполняя роль топлива. |
печеночных тканях ферментом липопротеннлипазой; |
В печени имеются еще два важных метаболических |
освобож.дающиеся жирные кислоты либо включаю |
пути: 1. Избыток триацилглицеролов. образую |
тся в состав тканевых липидов, либо окисляются |
щихся либо из жирных кислот, либо путем липогене- |


Цикл ЛllМОIIНОU Кflслоты: каmа60!l1l1.'И ац('mfl_1-СоА |
173 |
|||||||
|
|
|
|
|
|
|
Липидь. |
|
|
УrЛ8ВОДЬ' |
I I Белки |
1 |
_1 |
||||
~l/
Н2О Цитрат
r --___----,(Cв)~Н2О
Цикл лимонной
I(Иелот",
Малат
А(С4)
2Н
Н2О"'" \
Фумар8Т
(С4)
~- AbIXATEl\bH~5I цепь
ФП - СРлаВОПРОТ8ИН
Ц"Т - Цитохром
-0-6Ь\tОf(ознерrеТ"Чi!tКИЙ
q:>осфэ.т
Рис. 17.2. Цикл лимонной кислоты-главный катаболический путь ацстил-СоА у аэробных организмов. Ацетил
СоА-- продукт катаболизма углеводов, белков и липидов вступает в цикл вместе с Н2О и окисляется до СО2, поставляя
восстановительные эквиваленты (2Н). Последующее окисление 2Н в дыхательной цепи происходит в условиях сопряжения
с фосфорилированием АОР. За один оборот цикла 11 СВRзей - ® образуется путем окислительного фосфорилировании
и одна связь -® образуется на субстратном уровне при превращении сукцинил-СоА в сукцинат. Q--дыхательная цепь,
ФП-флавопротеин, Цит--цитохром, -®-высокоэнергетический фосфат.