
ФИЗИЧЕСКАЯ ХИМИЯ Учебное пособие для студентов заочной формы обучения инженерных специальностей
.pdf
P c P d |
K P , |
|
C |
D |
|
P a P b |
|
|
A |
B |
|
то G < 0 и прямая реакция (1.II.64) идет самопроизвольно.
Если все реагенты взяты в их равновесном соотношении, то G =0. При
PCc PDd |
P i , j |
K |
|
PAa PBb |
i, j i, j |
|
P |
из уравнения изотермы (1.II.66.3) следует G > 0 (самопроизвольно идет обратная реакция). Наконец, если в исходной смеси присутствуют только вещества C и D, то G = + и бесконечно велика тенденция к протеканию обратной реакции.
Таким образом, при изменении соотношения реагентов величина G изменяется от – до + , и при произвольном исходном составе реакционной смеси невозможно сравнивать химическое сродство различных реакций.
С целью сравнения GТ реакций и для последующих расчетов констант равновесия введена величина – стандартное химическое сродство
(обычно T=298,15K).
Величина GT соответствует условию, что один пробег ( =1) реакция совершает в достаточно большой системе, в которой исходные вещества и
продукты находятся в стандартных состояниях ( i ).
В качестве стандартных наиболее целесообразно выбирать такие состояния, в которых фучитивности fi в газах или активности ai в растворах для всех компонентов равны единице.
Тогда из уравнений изотермы (1.II.66.1) и (1.II.66.2) следуют соотношения
GT |
RT ln K f ,T |
(1.II.67.1) |
и |
|
|
GT |
RT ln Ka,T |
(1.II.67.2). |
Для газовых смесей при невысоких давлениях (идеализированный газ) в качестве стандартного принимается состояние, в котором парциальные давления каждого компонента равны 1 атм. (101325Па), а общее давление газовой смеси в атм. Равно числу газообразных компонентов.
61

Тогда изотерма (1.II.66.3) принимает вид
GT |
RT ln K p,T |
(1.II.67.3) |
Для компонентов в растворах неэлектролитов и для растворителя электролитов в качестве стандартного состояния выбирают состояние чистых веществ (a = 1, x = 1) обычно при стандартных условиях, а для растворенного вещества – электролита принимают состояние предельного разбавления ( =1, ac) или при молярности 1 моль/1кг растворителя [5].
Стандартное химическое сродство G298 зависит от природы реагентов и
является функцией состояния системы. Независимыми переменными состояния являются температура, давление и числа молей всех реагентов (метод ГиббсаГельмгольца) или химическая переменная (метод де Донде-Пригожина).
Значения G°298 |
вычисляются для реакции |
|
|
нi Ai нi' Ai' , |
|
по формуле |
|
|
G298 |
нi' G f ,298,Ai' нi G f ,298,Ai |
, (1.II.71) |
где G°f,298 - стандартная энергия Гиббса при образовании 1 моль вещества из простых веществ, наиболее устойчивых в стандартных условиях (для них
G°f,298 = 0, как и |
H°f,298 = 0). |
|
Значения |
G°f,298 для многих веществ |
табулированы [10-14], что с |
использованием уравнений (1.II.71), |
|
|
|
G°T = H°T – T∙ S°T |
(1.II.72) |
и стехиометрического уравнения позволяет находить стандартные изменения
энергии Гиббса G°f,298 и |
G°T при химических реакциях. Такое единообразие с |
введением стандартных |
состояний и сродства G°T, отражающего только |
специфику реагентов, весьма полезно, но приводит к некоторым усложнениям,
связанным с различием физического смысла величин GT и G°T , неравенств
GT < 0 и G°T < 0, равенств G = 0 и G°T = 0.
Смысл величин G°T и GТ = (∂G /∂ξ)P,T можно уяснить с помощью схемы, представленной на рис.II.1 и иллюстрирующей в общей форме
зависимость величины G от степени полноты газовой реакции при изотермическом переходе от чистых веществ (G1) при pi = 1атм к чистым продуктам реакции (G2) при p’i = 1атм. В каждой точке кривой G– наклон касательной определяет (∂G/∂ξ)P,T = GТ для реакционной смеси данного состава.
62
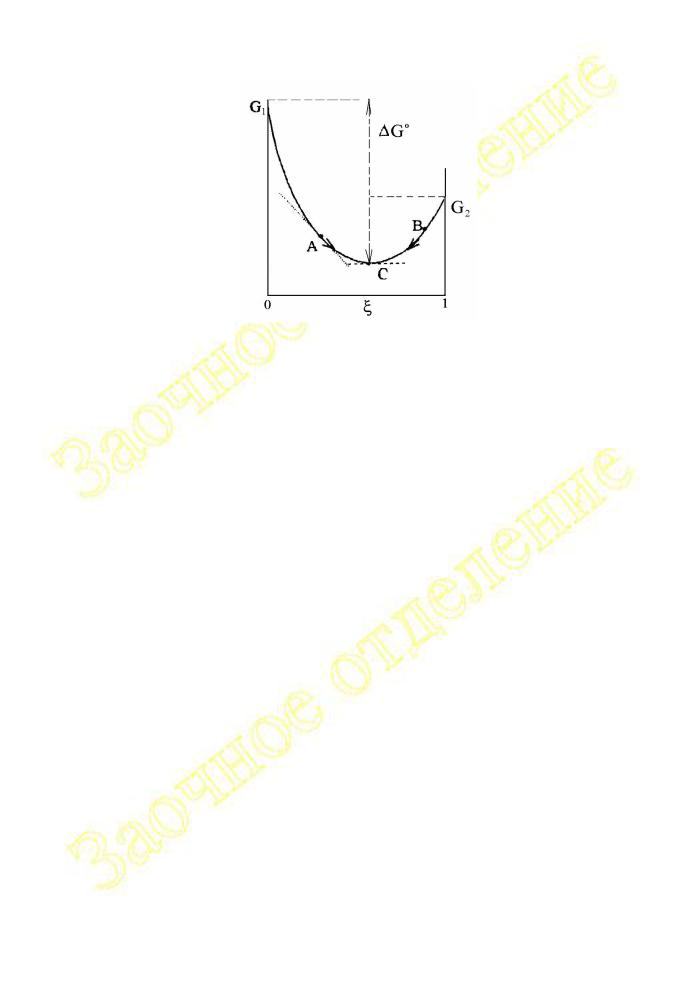
Величина GТ изменяется от – ( pi = 0) через нуль (химическое равновесие) до + (pi = 0).
Рис.II.1
Из рис. II.1 видно, что реакция в любой смеси (например, в смеси A или B), отличающейся по составу от равновесной (С), сопровождается убылью энергии Гиббса. Стандартное изменение G°T = G°2 – G°1 определяет меру термодинамической удаленности исходных веществ в стандартном состоянии от продуктов реакции также в стандартном состоянии.
Наличие в уравнениях изотермы реакции слагаемого, содержащего логарифм константы равновесия, связано только со способом вычисления G°T и совсем не означает, что GT определяет изменение энергии Гиббса при изотермическом переходе от неравновесной к равновесной смеси. В
действительности GT характеризует непосредственно нереализуемый процесс перехода от набора чистых исходных веществ, имеющих заданные неравновесные давления pi (фугитивности fi, активности ai) к набору чистых
продуктов реакции с заданными неравновесными pi' ( fi' , ai' )[2]. Это следует из
общей постановки задачи, но указанная ошибка при толковании смысла изотермы реакции встречается нередко.
Имея значения G°T вместо GT, строго говоря, нельзя пользоваться критериями (1.II.38) и (1.II.39) для суждения о направлении химических процессов в заданных нестандартных состояниях и условиях. Неравенство G°T < 0 согласно (1.II.67.1-II.67.3) означает, что константа равновесия при данной температуре больше единицы. Конечно, если все реагенты находятся в
стандартном |
состоянии |
(ai ai' |
1) |
прямая |
реакция |
является |
самопроизвольной. При G°T < 0 реакцию можно направить и в обратную сторону, если изменить соответствующим образом исходные активные массы реагентов. Действительно, в соответствии с уравнением изотермы
63

реакции (1.II.66.2) при достаточно низких неравновесных исходных веществ ai получим неравенства
Па'i i' |
Па i |
K |
a |
, |
GT 0 |
|
i |
|
|
|
|
при G°T < 0. Для обеспечения неравенства |
G°T < 0 в нестандартном |
||||
состоянии должно иметь место G°T 0 (Ka >>1, в равновесной системе преобладают продукты реакции). Напротив, при G°T >> 0 и Ka << 1 в равновесной системе преобладают исходные вещества (равновесие смещено влево).
Равенство G°T = 0 (Ka = 1) не является в отличие от GT = 0 критерием химического равновесия в заданных условиях. Однако температура
T*, при которой G°T = 0 (изменяет знак), является характерным параметром данной реакции. При T = T* и для стандартного состояния всех компонентов реакции (ai = ai’=1) разность энергий Гиббса продуктов и исходных веществ равна нулю, т.е. G°2 - G°1 = 0 (см. рис. II.1).
Температуру T* можно оценить, используя приближенное соотношение
|
|
|
|
|
(1.II.72.1) |
|
GT |
298 |
T S298 , |
||||
получаемое из (1.II.72) при допущении постоянства |
H и |
S в интервале |
||||
температур 298…Т. Принимая |
G°T = 0 |
в (1.II.72.1), находим |
|
|||
T |
|
|
, |
II.72.2) |
||
|
298 |
|
|
|
||
|
|
S298 |
|
|
|
|
где H298 – стандартное изменение энтальпии (Дж), |
S298 |
- стандартное |
||||
изменение энтропии (Дж/К) для одного пробега реакции. Если сопоставить выражение
K p Piн, равнi
(например, II.68.6) с уравнением (1.II.67.3), представленным в виде
|
|
G |
|
|
|
|
, |
||
K p,T |
exp |
RT |
|
|
|
|
|
||
может возникнуть следующий вопрос. Практическая константа Kp, определяемая по закону действия масс соотношением равновесных парциальных давлений газовых компонентов, является размерной величиной*, когда в результате реакции изменяется число молекул газа ( газ 0 ), а
* Если не использовать безразмерные давления (см. II.54).
64

GT  RT – величина безразмерная. Противоречия здесь нет, так как уравнение изотермы реакции (1.II.66.3) можно представить в виде
RT – величина безразмерная. Противоречия здесь нет, так как уравнение изотермы реакции (1.II.66.3) можно представить в виде
K |
p |
|
|
G |
|
|
|
|
|
|
|
||
|
i |
exp |
RT |
|
||
Пpi |
|
|
|
|||
сбезразмерными обеими частями.
Сучетом соотношений (1.II.72) и (1.II.67.3) после преобразований получим уравнение
|
|
|
|
|
S |
. |
|
|
|
|
|
|
|
||
K p exp |
RT |
|
exp |
R |
|
||
|
|
|
|
|
|||
отражающее противоположное влияние на константу равновесия энтальпийного и энтропийного эффектов.
Первый показатель степеней в отличие от второго сильно зависит от температуры, и соответственно при низких температурах решающее значение имеет H°, при высоких – S°. Из последнего уравнения следует, что константа химического равновесия зависит от природы реагентов (ΔH° и S°) и весьма чувствительна к изменению температуры (при H° ≠ 0). От давления величина Кр приближенно не зависит при Р < 30 атм. [5].
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
ПРИНЦИП ЛЕ ШАТАЛЬЕ
В отличие от заторможенных (ложных) равновесий устойчивые
(истинные) равновесия имеют следующие обязательные признаки:
1)Состояние системы неизменно во времени при отсутствии внешних воздействий;
2)Система следует за изменением внешнего воздействия, сколь угодно малым (количественная связь);
3)Состояние системы не зависит от направления прихода к равновесию.
Термодинамически равновесие определяется как наиболее вероятное (предельное) в данных условиях состояние закрытой системы (Gp,T=Gmin или AV,T=Amin): в изолированной системе при равновесии S=Smax.
Кинетически равновесие определяется как состояние, в котором скорости прямой и обратной реакций равны.
Равновесное состояние характеризуется постоянством состава системы и подвижностью равновесия при внешнем воздействии. Влияние параметров
65

состояния на химическое равновесие в качественной форме описывается принципом Ле Шателье* (1884):
Если на систему, находящуюся в истинном равновесии, оказывается внешнее воздействие (изменение температуры, давления, концентрации веществ и.т.п.), то равновесие смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
Противодействуя изменению условий, система переходит из одного состояния равновесия в другое, отвечающее новым условиям. Это связано с тем, что внешнее воздействие в разной степени изменяет скорости двух противоположных процессов.
Принцип Ле Шателье применим к химическим и фазовым равновесиям, кроме кажущихся (ложных) равновесий.
Рассмотрим качественно влияние основных факторов на химическое равновесие, используя в качестве примера обратимую газовую реакцию
1,5 H2 + 0,5 N2 NH3 , ΔH < 0
Влияние давления
Сжатие смещает равновесия в направлении процесса, сопровождающегося уменьшением объема системы (синтеза аммиака, так как Δνгаз < 0); понижение давления вызывает сдвиг равновесия в направлении процесса с увеличением объема системы (разложения аммиака, Vгаз > 0). Соответственно изменяется константа химического равновесия Kx (1.II.69) и равновесные молярные доли xi компонентов газовой смеси. Чем меньше абсолютное значение V, темменьше влияние давления на равновесие.
При Δνгаз = 0 (например, в газофазной системе H2 + I2 2HI) давление5 не влияет на положение равновесия.
Влияние концентрации.
Введение в равновесную систему дополнительного количества реагента вызывает смещение равновесия в том направлении, в котором его концентрация уменьшается. Добавление исходных веществ H2 (N2) усиливает прямую реакцию (синтез аммиака), добавление продукта реакции NH3 смещает равновесие в обратном направлении (разложение аммиака). Новое состояние химического равновесия устанавливается при других значениях равновесных концентраций, но соотношение между ними, определяющее константу равновесия, остается неизменным при постоянной температуре для данной реакции.
* ЛЕ ШАТЕЛЬЕ Анри Луи (1850-1936) – французский физикохимик. 5 при невысоких значениях
66

Степень смещения равновесия при добавлении реагента зависит от величины его стехиометрического коэффициента в уравнении реакции.
Смещение равновесия вправо можно осуществить также удалением продуктов из реакционной зоны, связывая их в малодиссоциирующие, труднорастворимые или нелетучие вещества.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ХИМИЧЕСКОЕ РАВНОВЕСИЕ
В соответствии с принципом Ле Шателье нагревание вызывает смещение равновесия в направлении эндотермической H > 0 реакции (разложение аммиака).
Охлаждение смещает равновесие в направлении экзотермического процесса H < 0, сопровождающегося выделением теплоты (синтез аммиака). Соответственно изменяется константа равновесия (см. ниже). Степень смещения равновесия зависит от величины | H|.
УРАВНЕНИЯ ИЗОБАРЫ И ИЗОХОРЫ ХИМИЧЕСКОЙ РЕАКЦИИ
Количественно состояние химического равновесия характеризуется термодинамической константой равновесия. Для обратимой газофазной химической реакции воспроизведём рядом друг с другом изотерму Вант-Гоффа и уравнение Гиббса-Гельмгольца:
|
|
RT ln K f ,T |
|
|
||
GT |
|
(*) |
||||
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
G |
|
(**) |
GT |
HT |
T |
T |
|
|
|
|
|
|
|
P |
|
|
Заменим в (**) энергию Гиббса на её значение из (*)
RT ln K f ,T HT |
|
( RT ln K f ,T ) |
, |
|
T |
T |
|
|
|
|
|
P |
|
|
и возьмём частную производную от произведения под знаком дифференциала:
RT lnK |
|
H |
|
|
lnK |
|
|
|
f ,T |
T R lnK |
f ,T |
RT |
|
f ,T |
|
||
|
T |
|
|
T |
|
|||
|
|
|
|
|
|
P |
||
раскроем скобки
RT ln K |
|
H |
RT ln K |
|
RT 2 |
|
ln K f ,T |
|
f ,T |
f ,T |
|
|
|
||||
|
T |
|
|
|
T |
|
||
|
|
|
|
|
|
|
P |
|
67

и после приведения подобных получим
ln K |
|
|
|
|
(1.II. 73) |
|
|
|
f ,T |
|
HT |
||
|
T |
|
|
RT |
2 |
|
|
P |
|
|
|
||
уравнение изобары химической реакции (изобара Вант-Гоффа). Аналогично выводится уравнение изохоры химической реакции (изохора ВантГоффа):
|
ln KC,T |
|
U |
, |
||
|
|
|
|
T |
|
|
|
T |
|
|
RT |
2 |
|
|
V |
|
|
|
||
где КС,Т – константа химического равновесия, выраженная через молярные концентрации реагентов в растворе.
АНАЛИЗ УРАВНЕНИЯ ИЗОБАРЫ ХИМИЧЕСКОЙ РЕАКЦИИ
Проанализируем уравнение (1.II.73) с позиций его соответствия принципу Ле Шателье. Допустим, что для равновесия (1.II.64) прямая реакция сопровождается выделением тепла, то есть она является экзотермической ( H 0), а обратная - эндотермической ( H 0). Тогда на основании (1.II.73) можно сделать следующие выводы:
1. в случае экзотермического процесса производная от логарифма константы равновесия по температуре при неизменном давлении будет отрицательной
ln K |
|
0 . |
|
|
|
f ,T |
|
|
T |
|
|
|
P |
|
|
Следовательно с ростом температуры константа равновесия будет уменьшаться.
2. для обратной эндотермической реакции производная от логарифма константы равновесия по температуре при неизменном давлении будет положительной
ln K |
|
0 . |
|
|
|
f ,T |
|
|
T |
|
|
|
P |
|
|
Следовательно, с ростом температуры константа равновесия будет увеличиваться.
68

Как видно, результаты анализа уравнения изобары Вант-Гоффа находятся в согласии с выводами, которые априори* на качественном уровне можно сделать исходя из принципа Ле Шателье.
ИНТЕГРИРОВАНИЕ ИЗОБАРЫ ВАНТ-ГОФФА
Рассмотрим наиболее простой случай, когда в рассматриваемом интервале температур тепловой эффект химической реакции от температуры не зависитH f (T ) . Тогда, разделив в уравнении (1.II.73) переменные
|
|
|
d ln K f ,T HRT |
T12 dT , |
|
|
|||||||
после интегрирования получим |
|
|
|
|
|
|
|
|
|
|
|||
|
ln K f ,T |
H |
const |
|
(1.II. 74) |
||||||||
|
|
T |
|
||||||||||
|
RT |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Выражение (1.II. 74) часто представляют в виде |
|
|
|
||||||||||
|
|
|
ln K f ,T |
|
A |
B |
|
|
(1.II. 75) |
||||
|
|
|
|
T |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
где |
|
A |
= |
const (постоянная интегрирования), а |
||||||
|
|
|
|
B HT / R . |
|
|
|
||||||
|
|
|
График |
|
уравнения |
(1.II.75) |
в координатах |
||||||
|
|
|
ln K f ,T |
f 1/T представляет собой прямую |
|||||||||
|
|
|
линию (см. рис. II. 2) с тангенсом угла наклона к |
||||||||||
|
|
|
оси абсцисс равным B. |
|
|
||||||||
|
|
|
|
|
Величину коэффициента A можно связать с |
||||||||
|
Рис. II. 2 |
|
|
|
|||||||||
|
|
изменением энтропии |
|
|
|||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
ln K f ,T |
|
H |
A . |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
T |
||||
Из уравнения (1.II.67) следует, что |
|
|
|
|
|
RT |
|
||||||
|
|
|
|
|
|
|
|||||||
|
ln K f ,T |
GT |
, |
|
тогда |
|
|
GT |
A |
|
HT |
||
|
|
|
RT |
|
|
|
|
|
|
RT |
|
|
RT |
откуда
* априори - от лат. a priori (заранее, наперёд судить утверждать), независимо от опыта, до опыта.
69

A |
G |
H |
|
( H |
T S |
) H |
, |
T |
T |
T |
T |
T |
|||
|
RT |
|
|
RT |
|
|
|
раскрыв скобки, после преобразований получим
A |
ST |
R |
|
|
(1.II. 76). |
Для небольшого интервала температур (Т2 – Т1 100K) выполняется уравнение
|
KT |
|
|
|
1 |
|
1 |
|
, |
(1.II.74.1) |
|
ln |
2 |
|
|
|
|
|
|
|
|
||
|
KT |
|
|
R |
|
|
|
|
|
|
|
|
|
|
T1 |
|
T2 |
|
|
||||
|
1 |
|
|
|
|
|
|
|
|
|
|
являющееся определенным интегралом уравнения изобары (1.II.73).
ВЛИЯНИЕ ДАВЛЕНИЯ НА РАВНОВЕСИЕ
Для гомогенной реакции a A b B cC d D, где A, B, C и D - газы,
находящиеся в идеальном состоянии, а a, b, c и d - стехиометрические коэффициенты, выразим парциальные давления газов (Pi) через их мольные доли (Xi) и общее давление (Pобщ.).
Мольная доля равна отношению количества вещества данного компонента смеси к сумме количеств вещества всех компонентов смеси или для газовой смеси - это отношение парциального давления газа к общему давлению газовой
смеси: |
|
|
|
|
|
|
|
X |
i |
|
ni |
|
Pi |
|
Pi |
|
|
N |
|
Pобщ. |
|
N |
|
|
|
|
n |
|
P |
||
Тогда, поскольку |
|
|
i 1 |
i |
|
|
i 1 i |
|
|
|
|
|
|
|
|
PA X A Pобщ. |
|
|
PB X B Pобщ. |
||||
PC XC Pобщ. |
|
|
PD X D Pобщ., |
||||
для равновесного парциального давления i-го компонента (A, B, C, D) газовой смеси получим
Pi ni Pобщ.
N |
1 |
|
ni |
|
|
i 1 |
|
равн. |
70
