
1_FIZIChESKAYa_HIMIYa_1
.pdf
После преобразований* выражение для практической термодинамической константы равновесия примет вид
|
nc |
nd |
|
Pобщ. |
н |
|
Pобщ. |
|
н |
||
KP,T |
|
|
|
|
, (1.II. 77) |
||||||
Ca |
Db |
|
N |
|
|
Kn,T |
N |
|
|
|
|
|
nA nB |
|
n |
i |
|
|
n |
i |
|
|
|
|
|
|
|
i |
|
|
i |
|
|
||
где н (c d) - (a b), |
ni nA nB nC nD |
и |
i |
|
|
|
nc |
nd |
(1.II.78). |
Kn,T |
C |
D |
||
nAa nBb |
|
|||
|
|
|
||
Из формулы (1.II. 77) видно, что в изотермических условиях (T=const) изменение давления не оказывает влияния на состав реакционной газовой смеси, если реакция протекает без изменения объёма газов (Δν = 0). Но если реакция сопровождается увеличением объёма газов (Δν > 0), то при T = const увеличение давления приводит к уменьшению Kn,T и росту содержания в равновесной газовой смеси исходных веществ, то есть равновесие смещается влево. А если объём газов в результате реакции уменьшается (Δν < 0),то при T = const увеличение давления приводит к росту содержания в равновесной газовой смеси продуктов реакции, то есть равновесие смещается вправо.
В общем случае зависимость константы равновесия Ka от давления выражается соотношением
( ln Ka 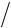 p)T V
p)T V 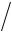 RT ,
RT ,
где V - стандартное изменение объема системы при данной реакции.
РАСЧЕТ РАВНОВЕСНОГО СОСТАВА И ВЫХОДА РЕАКЦИИ
Для определения состава равновесной газовой смеси надо решить уравнение вида (1.II. 77) относительно величин nA, nB, nC и nD. Однако на этой стадии расчета в (1.II. 77) известными величинами являются только KP,T, Pобщ.и. С целью уменьшения числа неизвестных и решения уравнения (1.II. 77) используется химическая переменная.
Химическая переменная или глубина превращения равна отношению изменения количества вещества данного реагента к величине его стехиометрического коэффициента в уравнении химической реакции:
* Преобразования рекомендуется выполнить самостоятельно !
71

|
|
ni |
(1.II.79) |
|
i |
|
|||
|
|
|
||
|
|
|
|
|
откуда для равновесного |
количества |
вещества i-го |
участника реакции |
|
получаем |
|
|
|
|
ni n0,i ni |
n0,i о i |
(1.II.80) |
||
В формулах (1.II. 79) и (1.II. 80) знак “-” следует ставить для исходных веществ, а “+” для продуктов реакции (см. табл.II.1)). Тогда, заменив в уравнении (1.II. 77) количество вещества участников реакции в соответствии с таблицей II.1, получим:
|
c |
d |
|
|
|
|
|
P |
|
||||
K P,T |
no,C c |
no,D d |
|
|
(1.II. 81) |
|
a |
b |
|
|
|
|
|
|
no,A a |
no,B b |
|
ni |
|
|
|
|
|
|
i |
|
|
где
ni no,A о a no,B о b no,C о c no,D о d |
|||||||||
i |
no,A no,B no,C no,D о (c d a b) |
|
|
||||||
|
|
|
|||||||
|
|
no,A no,B no,C no,D о н |
|
|
|||||
|
|
|
|
|
|
|
|
(1.II. 82) |
|
Если в исходной смеси продукты отсутствовали, |
т.е. при |
|
|
||||||
|
|
|
no,C no,D 0 |
|
|
||||
выражение (1.II. 82) примет вид : |
|
|
|
|
|
|
|||
|
ni no, A no,B о н |
(1.II. 83) |
|
|
|||||
|
|
|
|
|
|||||
|
i |
|
|
|
|
|
|
Таблица II. 1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Количетво вещества |
|
a A + |
b B |
c C + |
d D |
|
|||
Исходных веществ, |
|
no,A |
no,B |
|
no,C |
|
no,D |
|
|
no, i, моль |
|
|
|
|
|
|
|
|
|
Изменение к моменту |
|
|
|
|
|
|
|
|
|
наступления равновесия |
|
-ξ a |
-ξ b |
|
+ξ c |
|
+ξ d |
|
|
ni , моль |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||
В равновесной газовой |
|
no,A - ξ a |
no,B - ξ b |
|
no,C + ξ c |
|
no,D +ξ d |
|
|
смеси ni , моль |
|
|
|
|
|
|
|
|
|
Решив уравнение (1.II. 81) относительно переменной ξ, можно рассчитать: равновесные количества вещества каждого участника реакции, равновесные концентрации реагентов, степень превращения (степень диссоциации) исходных веществ и выход продуктов реакции.
72

РАСЧЕТ КОНСТАНТ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Константы равновесия зависят от природы реагентов и температуры, а величина константы Kx
Kx Kp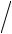 p н,
p н,
где x - молярная доля, зависит также от общего давления при нгаз 0 .
С помощью соотношения
R ln KT |
GT |
|
T ST |
(1.II.84) |
|
|
|
|
|
|
T |
|
T |
|
можно найти константы равновесия KТ при температурах, для которых известны стандартные энтропии и энтальпии образования реагентов. Рассмотрим кратко основные методы расчета констант равновесия при разных температурах.
1. Расчет констант K(T) с использованием уравнения
G |
|
T S |
|
|
( |
H |
|
) |
i |
T |
|
н (S |
S |
) |
i |
(1.II.85) |
|
T |
298 |
298 |
|
i |
T |
298 |
|
|
i T |
|
298 |
|
|
||||
по справочным табличным данным для |
H°f,298,i, |
S°f,298,i, |
(H°T - H°298)i и (S°T |
||||||||||||||
- S°298)i реагентов. Здесь, как и ранее, νi > 0 для продуктов, νi < 0 для исходных веществ.
2. Расчет Kp(T) с использованием известных зависимостей Cp,i(T) всех реагентов и уравнений
|
|
T |
T |
|
|
GT |
З 298 |
C p (T )dT T S298 |
T CTp |
(T )dT |
(1.II.86) |
|
|
298 |
298 |
|
|
где Cp (T) нiCp,i – изменение теплоемкости системы для одного пробега
реакции без фазовых переходов в интервале температур 298…Т. Допуская Gp
= 0, получаем первое приближение Улиха
|
|
|
|
GT RT ln KT 298 |
T S298 |
(1.II.87) |
|
3. Расчет Kp(T) для газовых реакций по уравнению |
|
||
|
0 |
(1.II.88) |
|
R ln KT T |
T |
||
|
|
|
|
где приведенный изобарно-изотермический потенциал ( -потенциал),
|
|
G |
H |
|
|
|
|
|
|
T |
|
и нi i |
|
|
|
|
||||
|
|
|
|
|
|
|
H°0 - изменение энтальпии для реакции при pi = 1 атм и Т = 0 K .
73

4.Расчет K(T) по известным значениям Kf,i компонентов реакции по уравнению
K ПK нf ,ii , |
ln K нi ln K f ,i |
(1.II.89) |
где Kf,,i – константа равновесия реакции образования i-го химического соединения из простых веществ [15,17].
5. Расчет констант термодинамически обратимой окислительновосстановительной реакции
a Ox1 + bRed2 a Red1 + b Ox2 ,
состоящей из процессов (полуреакций)
|
|
a Ox1 + n1 ē |
a Red1 , |
E°1 |
|
||
по уравнениям |
b Ox2 + n2 ē |
bRed2 , |
E°2 |
|
|||
|
|
|
|
|
|
||
|
|
n F ET |
или lg K 298 |
n F E |
(1.II.90) |
||
ln KT |
|
|
298 |
||||
R T |
|
|
|
0,059 |
|
||
|
|
|
|
|
|
|
|
где n = n1∙n2, F = 96485 |
Кл/моль, |
E E1 E2 G |
nF - разность |
||||
стандартных потенциалов полуреакций (B), Ox и Red – окисленная и восстановленная формы реагентов.
Для редокспроцессов с участием ионов H+ (OH-) обычно пользуются значениями реального стандартного потенциала Eo,r и реальной константы равновесия Kr (при постоянных рН и ионной силе раствора )
Влияние температуры на константу окислительно-восстановительного равновесия можно определить, измерив э.д.с
|
E |
|
|
|
G |
|
|
(1.II.91) |
nF |
|
S |
|
|||||
|
T |
|
|
|
T |
|
|
|
|
|
P |
|
|
P |
|
При оценке влияния погрешностей определения H°/T и S° на величину рассчитываемой константы равновесия KТ следует учитывать, что это влияние характеризуется не относительными (в процентах), а абсолютными погрешностями. Определенной разности значений H°/T или S°соответствует определенная величина отношения констант равновесия:
1 2 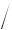 T R ln K1 ln K2
T R ln K1 ln K2
или
S1 S2 R ln K1 ln K2 |
(1.II.92) |
74

Из (1.II.92) следует, что погрешность величины H°/T или S° на 1Дж/K изменяет искомую константу равновесия в 1.13 раза, а погрешность на
20Дж/K – в 11.1 раза.
Часть III. Термодинамические расчеты
1.III.1. ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
1.III.1.1. Расчет тепловых эффектов химических реакций
Задача 1.III.1. Рассчитайте тепловой эффект реакции синтеза метанола при стандартных условиях: Т = 298.15 К, Р = 101325 Па, полагая, что а) метанол находится в жидком виде; б) все реагенты находятся в идеальном газообразном состоянии.
Решение. Для расчетов воспользуемся справочными данными по стандартным энтальпиям образования участвующих в реакции веществ (см.табл.44 на стр.72 [13]) и сведём их в таблицу 1.III.1.1:
|
|
|
Таблица 1.III.1.1 |
|
|
|
|
|
|
Термодинамические |
CO(газ) |
+ 2 Н2(газ) |
CH3OH(жидкость) |
|
функции |
|
|
|
|
H0f,298, кДж/моль |
-110,53 |
0 |
-238,57 |
|
|
|
|
|
|
В соответствии с (1.I.32) выражение для расчета теплового эффекта реакции синтеза метанола для этого случая запишем в виде:
H o |
[1 H o |
|
] - [1 H o |
+ 2 H o |
] = |
298 |
f,298, CH 3OH ж |
f,298, CO |
f,298, H 2 |
|
|
-238.57 - [-110,53 |
+ 2 0] = -128.04 кДж |
|
|
||
Если все реагенты, включая метанол, находятся в газообразном состоянии, то следует заменить значение энтальпии образования (см. таблицу 1.III.1.2)
|
|
|
Таблица 1.III.1.2 |
|
|
|
|
|
|
Термодинамические |
CO(газ) |
+ 2 Н2(газ) |
CH3OH (газ) |
|
функции |
|
|
|
|
H0f,298, кДж/моль |
-110,53 |
0 |
-201,00 |
|
|
|
|
|
|
и тогда тепловой эффект будет равен:
H o |
[1 |
H o |
CH 3 OH газ |
] - [1 H o |
+ 2 H o |
] = |
298 |
|
f,298, |
f,298, CO |
f,298, |
H 2 |
|
-201,00 - [-110,53 + |
2 0] = -90,47 |
кДж |
|
|
||
75

Задача 1.III.2. Рассчитайте тепловой эффект реакции синтеза метанола при стандартных условиях: Т = 298.15 К, Р = 101325 Па, полагая, что а) метанол находится в жидком состоянии.
Решение: Для вычислений необходимо |
воспользоваться |
другим |
следствием из закона Гесса, которое описывается формулой (1.I.33) |
и взять |
|
для расчета величины энтальпий сгорания (см. в [КС] на стр.45 табл.30), получим:
|
|
|
|
|
|
|
|
|
|
Таблица 1.III.1.3 |
|
|
|
|
|
|
|
||||||
Термодинамические |
|
CO(газ) |
|
+ 2 Н2(газ) |
CH3OH(жидкость) |
||||||
функции |
|
|
|
|
|
|
|
|
|
||
H C,298, кДж/моль |
|
-282,92 |
|
-285,83 |
-726,60 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
H o |
|
[1 H o |
|
+ 2 |
H o |
|
|
] - [1 H o |
|
] = |
|
298 |
|
c,298, CO |
|
c,298, H 2 |
c,298, CH 3OH ж |
|
|||||
[-298.92 |
2 (-285.83)] |
- [-726.60] |
= -127.98 |
кДж |
|
|
|||||
Следует обратить внимание:
1. Согласно определениям для теплоты образования и сгорания энтальпия сгорания водорода равна энтальпии образования жидкой воды:
H C,298(H2) = H f,298(H2Oж),
поэтому в [КС] приведена только последняя.
2.Величины тепловых эффектов сгорания, как правило, на порядок выше тепловых эффектов образования, поэтому абсолютная погрешность в определении значений теплот сгорания больше.
3.Тепловой эффект - экстенсивное свойство (зависит от массы), поэтому его величина зависит не только агрегатного (фазового) состояния реагентов,
но и от вида записи химического уравнения реакции :
CO(газ) + 2 |
Н2(газ) = СН3ОН(газ) |
H 298 = - 90.47 кДж |
CO(газ) + 2 |
Н2(газ) = СН3ОН(жидкость) |
H 298 = - 128.04 кДж |
0.5 CO(газ) + Н2(газ)= 0.5СН3ОН(жидкость) |
H 298 = - 64.02 кДж |
|
Рассчитанные величины тепловых эффектов реакции синтеза СН3ОН отличаются на величину энтальпии испарения 1 моль метанола:
H 298(метанол газ) - H 298(метанол жидкость) =
|
= H исп.(метанола) = -90.47 - (-128.04) |
= 37.57 кДж |
|
Задача |
1.III.3. |
Определите стандартную |
энтальпию образования |
кристаллической |
камфоры C10H16O, используя справочные значения |
||
76

энтальпии её сгорания и энтальпий образования соответствующих продуктов горения.
Решение: Запишем уравнение реакции сгорания камфоры в избытке кислорода так, чтобы в левой его части фигурировал только 1 моль органического соединения
C10H16Oкр + 13.5 О2 = 10 CO2 + 8 H2Oж
Тепловой эффект H 298 реакции, записанной таким образом, будет ничем иным как энтальпией сгорания камфоры, которая, согласно данным таблицы 30 на стр.45 справочника [КС], равна
H с,298 (камф) = -5924,84 кДж/моль.
С другой стороны, согласно второму следствию из закона Гесса, H 298 можно выразить через энтальпии образования камфоры и продуктов ее сгорания.
Ho298 =[10 Hof,298(CO2)+ 8 Hof,298(H2Oж)] – [ Hof,298(камф) + 13,5 Hof,298(O2)]
Из справочника находим H0f,298 (Н2Ож) = -285,83 кДж/моль
H f,298(СО2) = –393,51 кДж/моль; |
H f,298(О2) = 0 |
Подставив вместо H 298 значение |
|
H C,298 (камфoры) = –5924,84кДж/моль,
получим уравнение с одной неизвестной – энтальпией образования камфоры:
- 5924,84 = 10 ( - 393.51) + 8 (-285.83) - H f,298 (камф) + 0
Откуда H f,298 (камф) = - 286.9 кДж/моль
Расчеты по теплотам (энтальпиям) растворения и разбавления
Задача 1.III.4. Вычислите теплоту процесса превращения ромбической серы в моноклинную с помощью теплот растворения.
Решение: Тепловые эффекты различных процессов можно находить с помощью теплот растворения веществ.
Интегральной теплотой растворения Hm называется тепловой эффект растворения 1 моль вещества в таком количестве растворителя, чтобы моляльная концентрация полученного раствора равнялась m.
Добавление воды к раствору сопровождается тепловым эффектом
разведения. |
Hmm2 |
, где Hmm2 - |
NaCl 800 H2O(раствор)+400 H2O=NaCl 1200 H2O(раствор) |
||
|
1 |
1 |
интегральная теплота разведения от большей концентрации m2 до меньшей m1.
77
m |
= Hm |
Hm |
Hm2 |
||
1 |
2 |
1 |
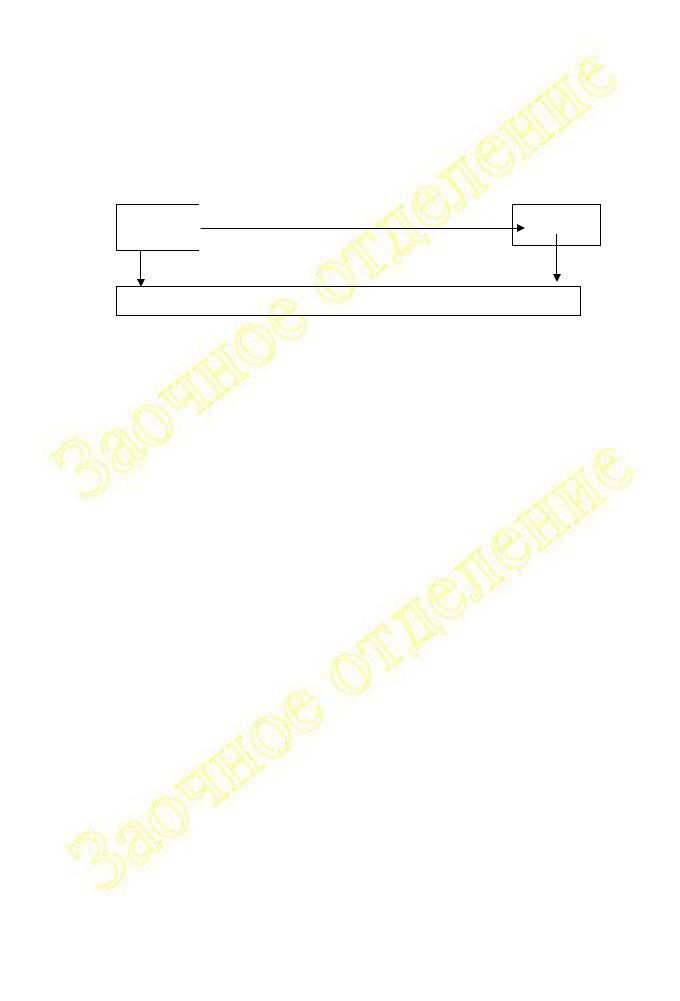
Чтобы определить теплоту превращения серы из ромбической модификации в моноклинную воспользуемся законом Гесса и составим схему превращений (см. рис. 1.III.1), согласно которой для обеих модификаций твёрдой серы конечным состоянием будет раствор в сероуглероде с концентрацией m.
|
Hx = ? |
Sромб. |
Sмонокл. |
Hm (Sромб.) |
Hm ( Sмонокл.) |
Раствор S в CS2 с моляльной концентрацией m
Рис. 1.III.1
Из представленной на рис. 1.III.1 схемы :
Hm(Sромб.) = Hm( Sмонокл.) + Hx
Hx = Hm(Sромб.) - Hm( Sмонокл.)
На рис.1.III.1 символами Hm(Sромб.) и Hm(Sмонокл.) обозначены интегральные теплоты растворения серы ромбической и моноклинной в
сероуглероде при образовании раствора с одной и той же моляльной концентрацией, равной m.
Энтальпийные диаграммы. Энергия химической связи
Путем термохимических расчетов на основе закона Гесса, зная энтальпии образования, диссоциации и других энергетических эффектов, можно вычислить прочность (энергию) межатомных, и межмолекулярных взаимодействий. С другой стороны, известные значения энергии связей можно использовать для расчета энергетических эффектов различных физикохимических процессов.
Энергетические расчеты наглядно иллюстрирует построение энтальпийных диаграмм [10-12]. Условному нулевому уровню энтальпии на таких диаграммах соответствуют простые вещества в основном стандартном состоянии (наиболее устойчивом при стандартных условиях) и в количестве, необходимом для образования 1 моль химического соединения в указанном агрегатном (фазовом) состоянии. Нулевые значения Н f,298соответствуют, в частности, состояниям H2 (г), O2 (г), N2 (г), F2 (г), Cl2 (г), Br2 (ж), I2 (к), Si (к), кристаллическим модификациям графита, ромбической серы, серого мышьяка и селена [13,14].
78
Различие в уровнях энтальпии исходных веществ, промежуточных и конечных продуктов на диаграммах отвечает тепловым (энергетическим) эффектам соответствующих реакций.
Рассмотрим характерные примеры расчета и построения энтальпийных диаграмм.
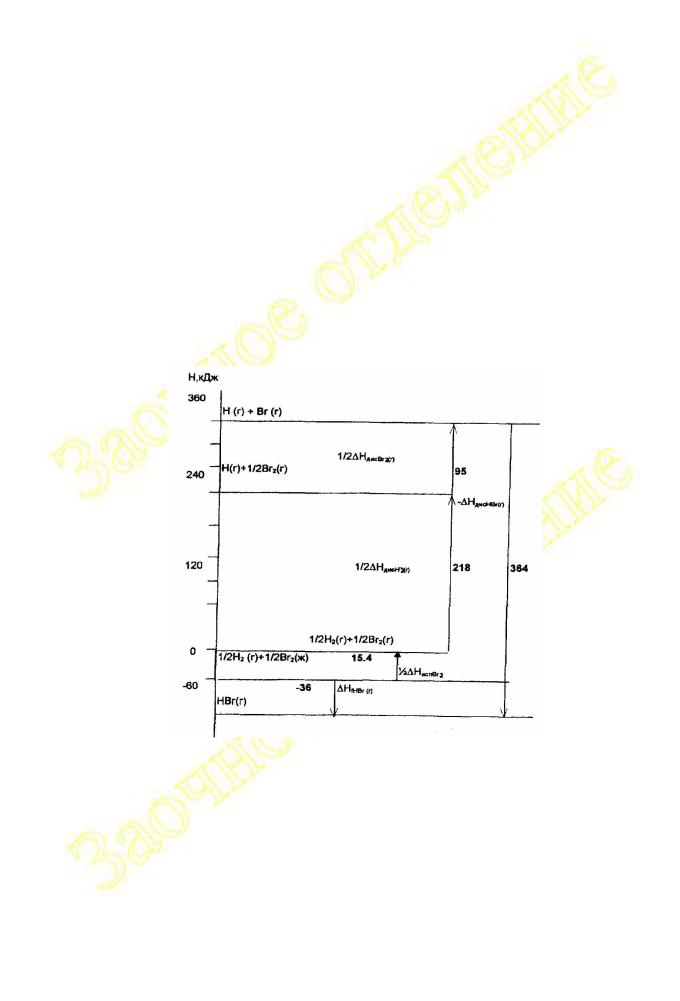
Задача 1.III.5. Вычислить энергию химической связи H-Br (EH-Br) в молекуле HBr(г) по известным [13,14] стандартным значениям энтальпии образования
( H fHBr = -36кДж/моль), энергии диссоциации молекул H2(г), Br2(г) на атомы
(соответственно H дис= 436 и 190 кДж/моль, H исп Br2 (ж) = 30,8 кДж/моль). Построить энтальпийную диаграмму.
Решение: Образование HBr из простых веществ можно мысленно представить в виде последовательных стадий испарения жидкого брома, диссоциации молекул Br2 и H2 на атомы и образования молекул HBr из свободных (изолированных) атомов (Рис. 1.III.2):
|
Рис. 1.III.2 |
|
|
0,5 Br2 |
(ж) = 0,5 Br2 (г), |
0,5 |
H исп = 15,4 кДж |
0,5 Br2 |
(г) = Br (г), |
0,5 |
H дис = 95 кДж |
0,5 H2 (г) = H (г), |
0,5 |
H дис = 218 кДж |
|
H (г) + Br (г) = HBr (г), |
–ΔHдис.HBr = –EH-Br |
||
0,5 H2 (г) + 0,5 Br2 (ж) = HBr (г), |
Hf,HBr = –36 кДж |
||
79

В соответствии с законом Гесса алгебраическая сумма тепловых эффектов промежуточных стадий образования HBr (г) из простых веществ в стандартном состоянии H2 (г) и Br2 (ж) равна стандартной энтальпии образования HBr (г):
0,5 H исп Br2 (ж) + 0,5 H дис Br2 (г) + 0,5 H дис Н2 (г) – HдисHBr (г) = Hf,HBr(г).
Расчет дает HдисHBr = ЕН-Br = 364 кДж/моль
Образование бромида водорода из простых веществ – процесс экзотермический (уровень энтальпии HBr на диаграмме ниже нулевого уровня), так как энергия, выделяющаяся при образовании связей HBr между атомами H и Br, перекрывает расход энергии на разрыв связей H–H и Br–Br в простых веществах. Подобная ситуация имеет место (табл.1.III.1.4) для газообразных HF, HCl, SiF4 и NH3 с прочными гетеросвязями.
Таблица 1.III.1.4
Стандартная энтальпия образования и энергия химической связи некоторых соединений (кДж/моль)
Функция |
|
|
Соединение (газ) |
|
|
||
HF |
HCl |
|
HBr |
|
HI |
SiF4 |
|
Н f,298 |
-271 |
-92.3 |
|
-36.1 |
|
26.4 |
-1615 |
ЕЭ-Н |
565 |
432 |
|
364 |
|
297 |
596 |
|
|
|
|
|
|
||
|
|
|
Соединение (газ) |
|
|
||
Функция |
SiH4 |
NH3 |
|
PH3 |
|
AsH3 |
SbH3 |
Н f,298 |
34.7 |
-46.1 |
|
5,4 |
|
66,4 |
145 |
ЕЭ-Н |
322 |
391 |
|
323 |
|
281 |
256 |
Как следует из таблицы 1.III.1.4, с увеличением алгебраической величиныН f,298 химических соединений уменьшается энергия гетеросвязей ЕЭ-Н и термическая устойчивость соединений к разложению на простые вещества.
Энергия кристаллической решетки. Энергия атомизации.
Энергия кристаллической решетки U 298 определяется количеством энергии, необходимой для разделения 1 моль кристалла на составляющие частицы (изолированные молекулы, атомы или ионы). Наибольшие значения U 298 имеют атомно-ковалентные и ионные кристаллы, наименьшие – молекулярные кристаллы [9,11]. Промежуточное положение занимают металлы
(Таблица 1.III.1.5)
Наиболее низкие значения U 298 и температуры плавления имеют молекулярные кристаллы с дисперсионным взаимодействием молекул (H2, CH4, I2). Кристаллы с водородными связями (HF, H2O, NH3) имеют более высокие U 298 (Таблица 1.III.1.5) и температуры плавления. Прямым способом
80
