
атм / 02_IstVEdSuhVlag
.pdf
Основы учения об атмосфере. 2 Состав и свойства воздуха
Шен_Лун – священный дракон Воздуха (Китай). Он похож на огромного змея без крыльев. Хотя Дракон и считается добрым, те, кто посмеет потревожить его, пожалеют об этом. Ярость его может воплотится в наводнения, тайфуны или засухи.
Что следует знать о составе воздуха
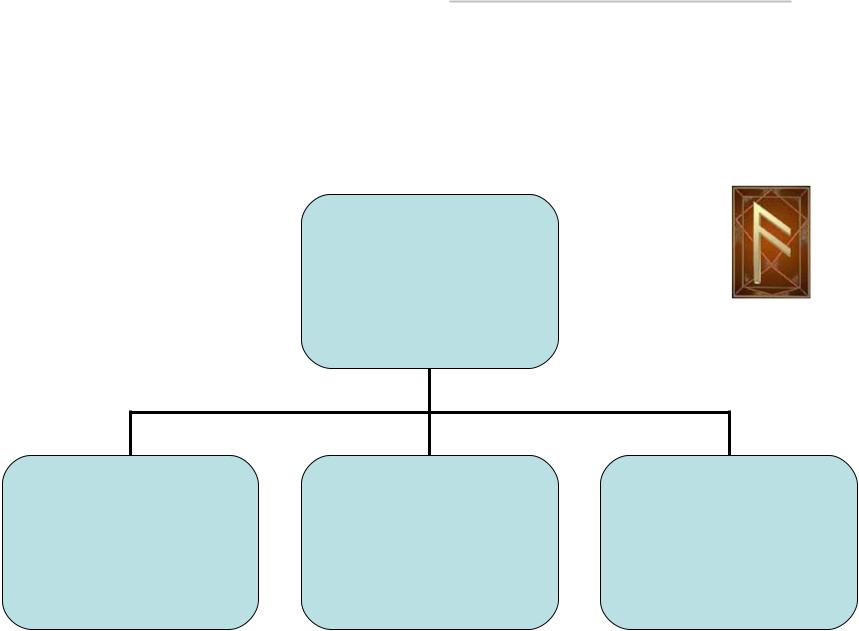
Воздух – это смесь газов с постоянным составом (сухой воздух) +
водяной пар (влажный воздух)+ СО2 , О3 и другие малые примеси газов + аэрозоль
Атмосферный
воздух
Сухой |
С переменной |
|
Концентрацией:твердые |
||
с постоянным |
||
Водяной пар |
||
Составом |
||
(малая добавка ~ 1-4%) |
||
(основная масса ~99-96%) |
||
Озон, углекислый газ |
||
|
Аэрозоль
(твердые и жидкие Частицы)
Измерение концентраций
Концентрация в единичном объеме (массовая доля):
Масса (A)/Масса(смеси газов)
Отношение смеси:
Число молей (A)/Число молей(смеси газов)
= Число молекул(A)/Число молекул(смеси газов).
Единицы измерения: 1 процент(%)=1/100=10-2 1 промилле(‰) =1/1000=10-3
1 пропромилле(ppm) =1/1000000= 10-6
1 ppb = 1/1000000000 |
(1 на миллиард) |
1 ppt = 1/1000000000000 |
(1 на триллион) |
Пригодится!
•1 ppm =0.1%=1г/кг=1 см3/м3
•1 ppb =1 мм3/м3
•1 мг/м3=0.001г/м3=0.000001 кг/м3
•1 мг/м3=
•ppm•[1.2(молек.масса вещ/ молек.масса
возд)]

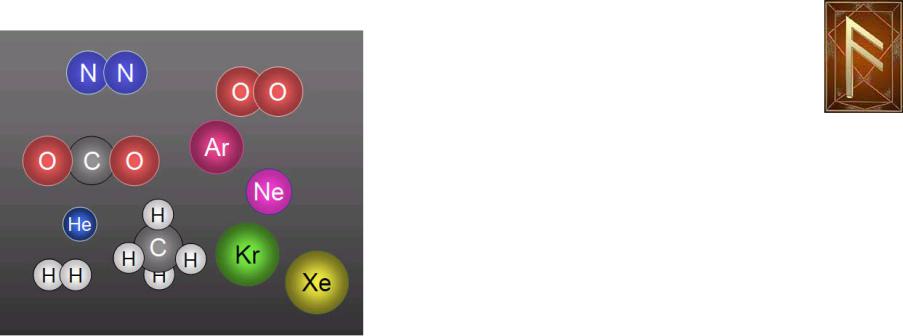
Состав атмосферного воздуха
Молекулярные веса составляющих газов.
• |
Постоянные |
|
концентрации: |
|
– 78% Азот (N2)-μ=28 |
|
– 21% Кислород (O2)- μ=32 |
|
– 1% Аргон (Ar)- μ=40 |
• |
Переменные |
|
концентрации: |
|
– 0,1- 4% (1 – 40 ‰) Водяной |
|
пар (H2O)-- μ=18 |
[μ]=кГ/кМоль=Г/моль |
– 0,03% (0.3 ‰=300 ppm ) |
|
Углекислый газ (CO2) -- μ=44 |
– 0,000003% (30 ppb) Озон (O3)
-- μ=48
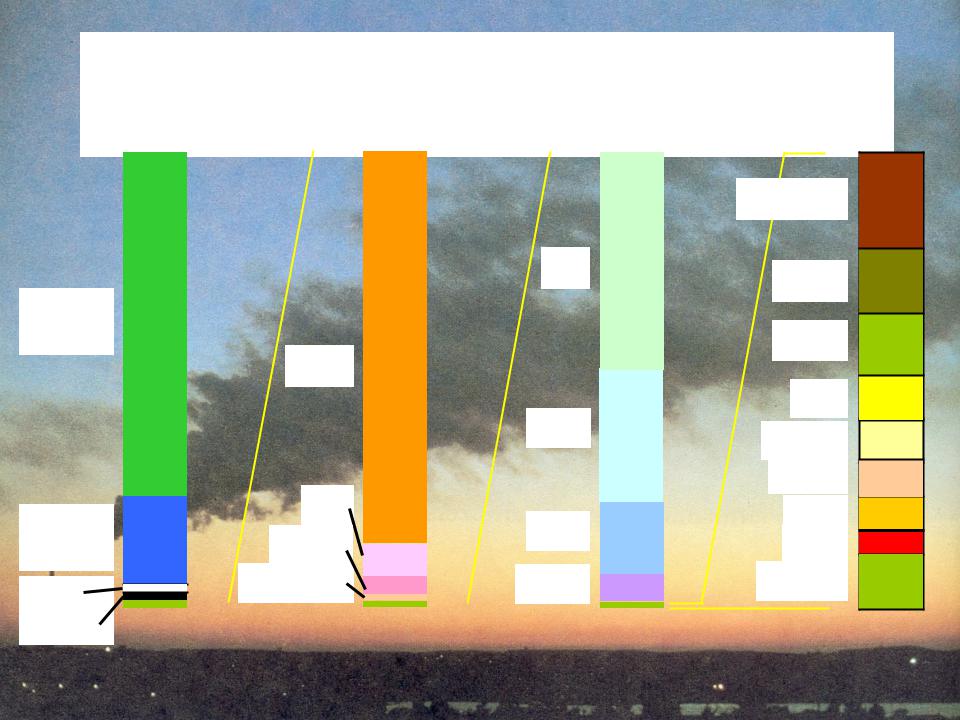
Состав сухого воздуха атмосферы (подробно)
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
|
|
500 |
Nitrogen |
78% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2 |
|
380 |
|
|
|
|
|
|
|
||
|
|
|
N2O |
|
310 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Oxygen |
|
|
|
Ne |
|
|
|
|
CO |
|
|
||||
|
|
|
|
|
|
|
|||||||||
20% |
|
|
|
|
|
100 |
|||||||||
|
|
He (5) |
|
|
|
|
|
||||||||
|
|
|
|
18 |
|
|
|
|
|
|
|
||||
|
1% |
|
|
CH4 (1.8) |
|
|
|
Ozon |
|
|
|||||
H2O |
|
|
|
|
|
|
|
30 |
|||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Argon |
|
|
|
|
|
|
|
ppm |
|
ppb |
|||||
CH3OOH 700
H2O2 500
Ethane 500
NH3 400
HCHO 300
HNO3 300
SO2 200 NOx 100
others
ppt
Dr. Martin Schultz - Max-Planck-Institut für Meteorologie, Hamburg

Водяного пара столько же, сколько и аргона и больше, чем СО2!
Закон постоянства
состава (открыт в XIX веке)
В нижнем (до 80 км) слое атмосферы молекулярный состав основных газов воздуха (их концентрации) не меняется с высотой и молекулярная масса воздуха постоянна =– 29 кг/кмоль
Этот слой называют ГОМОСФЕРА и именно его
изучает МЕТЕОРОЛОГИЯ
Выше 80 км в составе воздуха начинают преобладать атомарные формы газов и его молекулярная масса убывает с высотой
Этот слой называют ГЕТЕРОСФЕРА и его
изучают в АЭРОНОМИИ
Молекулярные веса газов сухого воздуха.
|
• |
Азот (N2)-μ=28 |
|
|
• |
Кислород (O2)- μ=32 |
|
|
• |
Аргон (Ar)- μ=40 |
|
|
• |
Водяной пар (H2O)- μ=18 |
|
|
• |
Углекислый газ (CO2)- |
|
1 моль вещества |
|
μ=44 |
|
• |
[μ]=кГ/кМоль=Г/моль |
||
весит μ грамм |
Массу атома никогда не выражают в граммах, так как это исключительно
неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10–22 г. Поэтому массу атомов выражают в
относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта.
углерода 12C
