
атм / 02_IstVEdSuhVlag
.pdf
Главное назначение уравнения состояния в метеорологии – расчет плотности воздуха
Пример.
Измерены давление 980 гПа (1 Па=1н/м2) и температура воздуха 25оС
Расчет плотности воздуха
ρ = p/RT=
=980(гПа)·100(Па/гПа)/(273+25)287
=1,146 кГ/м3
Из уравнения состояния следует, что
теплый воздух при том же давлении
легче холодного
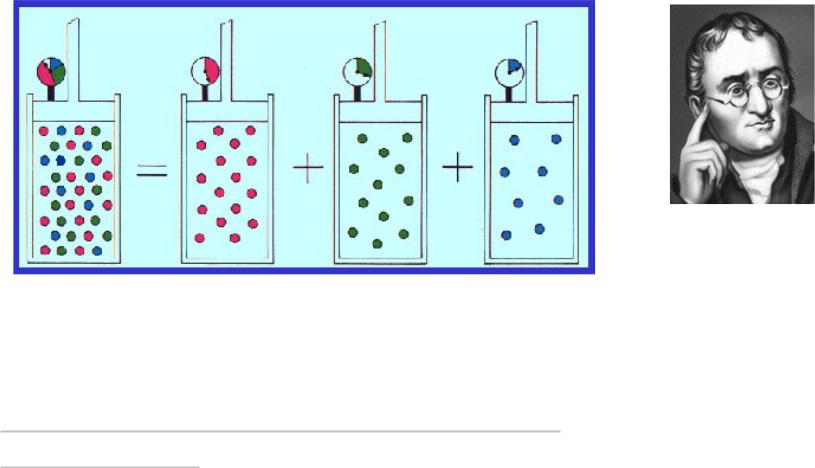
Сухой воздух – это смесь N2,O2,Ar. Почему мы считаем его единым газом?
Закон Дальтона для парциальных давлений смеси газов
•Парциальное давление – это давление, которое имел бы газ независимо от других газов смеси
•Полное давление смеси равно сумме
парциальных
Джон Дальтон,и Крупнейший физик англии XIX в школьный учитель, основатель физической атомистики

Потому, что сухой воздух можно описать
единым уравнением состояния
•Пусть в одном и том же объеме при одинаковых температурах содержится смесь азота, кислорода и аргона с постоянными концентрациями qO, qN, qA
• |
Ур.сост. N: |
P V= q |
R T, |
|
R = R*/µ |
||||||||||||||||||||||||||||||||
• |
2 |
N |
|
|
|
|
O |
N |
|
|
|
|
|
N |
|
|
|
|
|
|
N |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
Ур.сост. O: |
P V= q |
R T, |
|
R = R*/µ |
|||||||||||||||||||||||||||||||||
|
2 |
O |
|
|
|
|
N |
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
• |
Ур.сост. Ar: |
PAV= qA RAT, |
|
RA= |
R*/µ |
A |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
• |
Для смеси: (PN+PO+PA)V=R*(qN /µN+ qO /µO+ qA /µA)T |
||||||||||||||||||||||||||||||||||||
• |
Откуда: |
|
|
P |
∑ |
V= (R*/µ |
∑ |
) |
|
|
|
|
T |
|
= |
|
R |
∑ |
|
T |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
Если |
|
|
|
|
|
|
1/µ∑= (qN /µN+ qO /µO+ qA /µA) |
|||||||||||||||||||||||||||||
Именно этот молекулярный вес и приписывается воздуху
µ = 29 кг/кмоль

Пример вопроса аттестации и экзамена: Получить уравнение состояния для атмосферы Юпитера
Юпитер (318 масс Земли): Атмосфера :
H2 (90%),
He (10%)

Водяной пар – тоже идеальный газ
А почему? Ведь фазовые переходы-то есть! Тройная-то точка водяного пара при давлении 6.11 гПа и температуре 0С. НЕ ПУТАТЬ! Критическая точка
водяного пара достигается только при температуре374 °C и давлении 220640 гПа!

История измерений влажности воздуха
Николай Кузанский изобрел в 1440 г. гигрометрический принцип измерения влажности (взвешивание шерсти)
Орас Соссюр изобрел волосной гигрометр, 1783
•Эрнст Август изобрел психрометрический метод, 1825
(портрета я не нашел. Кто найдет, повышу отметку на экзамене)
Рихард Асман изобрел аспирационный психрометр, 1882

Водяной пар Н2О– идеальный газ
µп=18 кГ/кмоль,
Rп=R*/µп=462 Дж/кГ /K
Обозначение его парциального давления
Вместо p — через e
(в атмосфере O(e)≈100гПа
Читать: «порядок величины е примерно единицы гПа )
Вместо R — Rп Rп=R/µп=8.31/0.018=461.6 Дж/(кГ оК)
Тогда уравнение состояния пара H O
e = ρп Rп T [гПа]

Другие характеристики влажности воздуха
Плотность пара Н2О (ρп ) называется абсолютной влажностью
|
Оценка: |
ρп = e / Rп T [кг/м3] |
|
Концентрация пара Н2О в 1 кг воздуха ( q )называется
массовой долей водяного пара (раньше – удельной влажностью)
q =ρп/ρ= (e/RпT)/(p/RT)=(R/Rп)(e/p)
Оценка: q = 0.622 e / p [‰=г/кг]
Внимание!
Даже если e=p, то q = 0.622<1.
Это значит, что при одинаковых условиях
пар Н2О легче воздуха
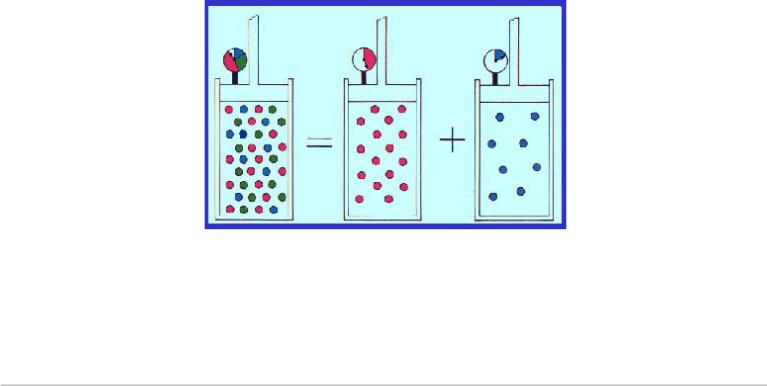
Реальный воздух – смесь сухого и пара Н2О Его называют влажным воздухом
Закон Дальтона для парциальных давлений смеси газов
•Парциальное давление – это давление, которое имел бы газ независимо от других газов смеси
•Полное давление смеси равно сумме парциальных

Применение закона Дальтона для вывода уравнения состояния влажного воздуха
ρ R T = P = Pc+ e =ρcR cT + ρпRпT= =(ρ-ρп)RcT +ρпRпT = ρR cT + ρп(Rп-R c)T=
= ρT·{Rc[1+(Rп –Rc)/Rc)(ρп /ρ)]}=
=ρRc { [1+(Rп –Rc)/Rc)](ρп /ρ)} T
Во влажном воздухе становится переменной R
Принято! Вместо переменной R вводить виртуальную(кажущуюся) температуру Tv
P = ρRcTv , Tv=T(1+0.61q)=T+ΔTv
