
атм / 02_IstVEdSuhVlag
.pdf
Плотность ─ важнейшая характеристика любой сплошной среды
В метеорологии плотность воздуха не измеряют, а вычисляют!

Закон Авогадро
Амедео Авогадро
Доказал: плотности газов ρ1 и ρ2, занимающих при равных
давлениях и температурах равный объем относятся как их молекулярные веса µ1 и µ2
Следствие1: т.к. ρ1=N1· µ1и ρ2=N2· µ2, то из ρ1 / ρ2= µ1 / µ2 следует , что N1=N2 ,то есть в равных объемов любых газов при одинаковых условиях
число молекул одинаково (N≈6 ·1023—Лошмидт)
Следствие 2: 1 моль любого газа при стандартных условиях (00С,101300 Па) занимает один и тот же объем (0,0224 м3)

Любознательный, реши задачу 1
• Если пустыню Сахару (S = 720 000 км2), аккуратно покрыть слоем из N=6 1023 (число Авогадро) песчинок кубической формы со стороной 1 мм,
• Какой толщины будет слой песка?
• Для нелюбопытных ответ: 833 м
Запомнить!
•1 м3 воды весит 1000 кг (тонну!)
•1 литр – это 1/1000 м3
•1 литр воды весит 1 кг
•1 литр воды займет слой высотой 1 мм,
если его разлить на площади 1 м2.

Любознательный, реши задачу 2
•Сколько нужно пустых поллитровых бутылок для хранения 1 моля воздуха (ρ =1,3 кг/м3, М = 29 г/моль)?
•Нужен объем V = M/ρ = 0,029 [кг/моль]/1,3 [кг/м3] = 0,022 [м3/моль]
•1 литр = 0,001 м3, значит для хранения 1 моля воздуха нужно 22 поллитровых бутылки!

Газовые законы 1
Роберт Бойль, физик, богослов и главный конкурент Ньютона
Современники Шекспира
Эдм Мариотт, приор монастыря в Дижоне, Один из основателей Французской академии и первый ее президент
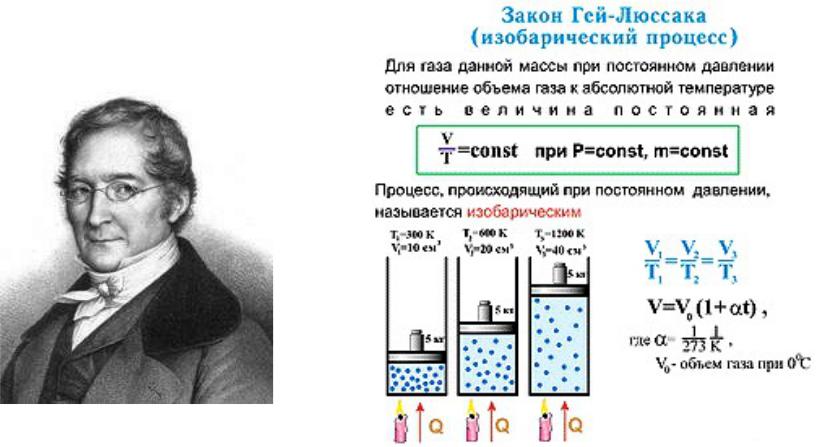
Газовые законы 2
Жозеф-Луи Гей-Люссак, физик, химик, президент Французской Академии

Газовые законы 3
Жак Шарль, ученый и инженер, изобрел водородный воздушный шар И поднялся на нем в 1783 г над Парижем на высоту 914 м

Закон Клапейрона
V’/ V1=T1 / T2 (закон Гей-Люсака)
p1V’ =V2 p2 (закон Бойля-Мариота)
p1V1/T1=p2V2/T2 =const
(закон состояния газа в форме Клапейрона)
Бенуа Поль Клапейрон, Физик и инженер, его именем названа улица в Париже

Уравнение состояние газа (закон Менделеева-Клапейрона)
Для 1 моля любого газа занимает одинаковый объем, тогда
pV/T=R* -универсальная постоянная, R* =8,31 кДж/(кмоль·K)
Т.к. плотность ρ=µ/V, получим
основную форму уравнения состояния
P = ρ R T ,
(Для воздуха µ = 29 кГ/кмоль и R = R*/µ =287 Дж/(кГ OK))
