
- •Физические и химические свойства воды
- •Физические свойства
- •Строение молекулы
- •Строение молекулы
- •Плотность воды при
- •Плотность воды
- •Поверхностное натяжение, теплота парообразования и растворяющая
- •Изотопы воды
- •Изотопы воды
- •Некоторые физические
- •Теплоемкость воды
- •Теплота плавления и
- •Вязкость воды
- •Диссоциация воды
- •Диссоциация воды
- •Диссоциация воды
- •Диссоциация воды
- •Диссоциация воды. Общие
- •Формы выражения
- •Формы выражения
- •Формы выражения
- •Миллиграмм-
- •Пример 1
- •Пример 2
- •Пример 3. Проверить результаты
- •Кремнезем, различные взвеси и некоторые органические соединения присутствуют в воде в ионизированном состоянии.
- •Гипотетические соли
- •Гипотетические соли
- •Гипотетические соли
- •Отображение хим.состава
- •Карты изохлор для различных глубин распространения подземных вод северной части
- •Графики-колонки
- •Диаграмма Стиффа
- •Другие способы
- •Общая минерализация и
- •Трехлинейная диаграмма
- •Удельная электрическая
- •Удельная электрическая
- •Удельная электрическая проводимость водных растворов различныхВлияние
- •Удельная электрическая
- •Удельная электрическая
- •Удельная электрическая
- •Подвижность элементов в
- •Средний состав двух групп пород и двух
- •Подвижность элементов в
- •Растворимость
- •Произведение
- •Пример расчета
- •Температура и
- •Растворимость и площадь
- •Растворимость и
- •Растворимость и pH
- •Растворимость и
- •Растворимость и
- •Поля устойчивости железа
- •Поля устойчивости железа
- •Ионный обмен
- •Ионный обмен
- •Обменная способность
- •Катионный обмен
- •Обменная способность
- •Биологические
- •Биологические
- •Микроорганизмы
- •Роль микроорганизмов в
- •Роль микроорганизмов в

Физические и химические свойства воды
© П.Ф.Агаханянц, 2010

Физические свойства
H2O
единственное вещество, находящееся в больших количествах на Земле в 3-х фазовых состояниях: твердом, жидком и газообразном
находится в жидком состоянии в интервале 0 – 100 С, т.е. остается жидкой в большинстве мест на Земле
Из всех распространенных жидкостей вода – наиболее универсальный растворитель, жидкость с максимальными величинами поверхностного натяжения, диэлектрической постоянной, теплотой парообразования и наивысшей (после аммиака) теплотой плавления.
высокая теплоемкость (Дж/кг*градус)высокая теплопроводность
pH = 7, т.е. реакция нейтральная
расширяется при замерзании на 9%, максимальная плотность – при 4 С
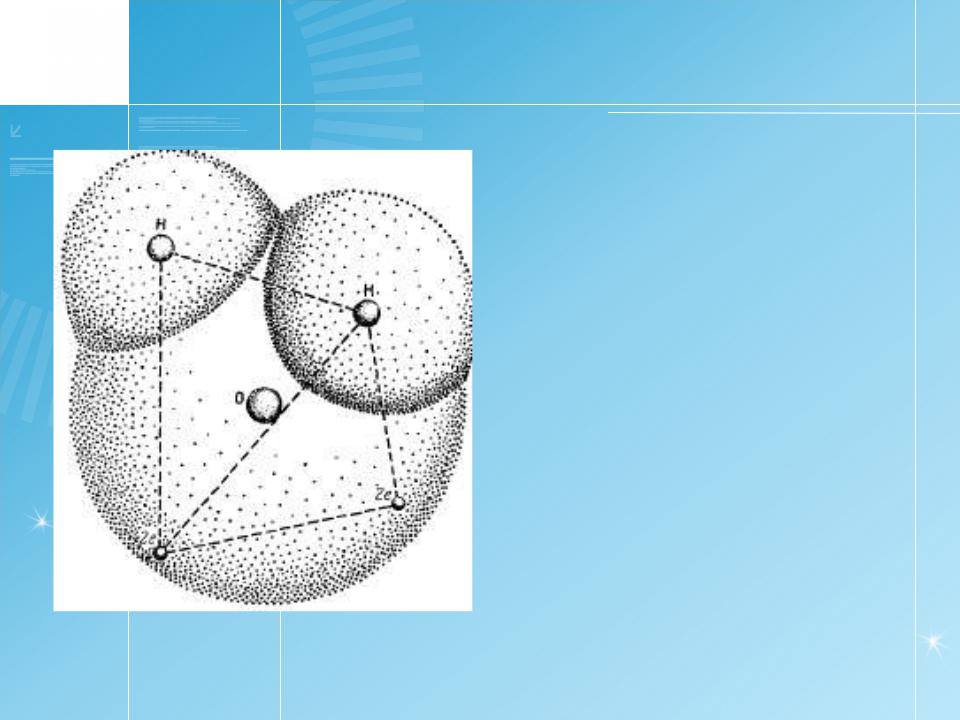
Строение молекулы
воды
Взаимное
проникновение атомов водорода и кислорода.
Ядра двух атомов водорода и две пары электронов находятся в углах тетраэдра: в центре расположено ядро атома кислорода.

Строение молекулы
воды
Ассиметричное расположение атомов молекулы воды обусловливает неравномерное распределение электрических зарядов в ней, что делает молекулу воды полярной.
Такое строение молекулы воды обусловливает притяжение молекул воды друг к другу в результате образования между ними водородных связей.

Плотность воды при
разных температурах
Температура ( С) |
Плотность (кг/л) |
0 (твердая) |
0.9150 |
0 (жидкая) |
0.9999 |
4 |
1.0000 |
20 |
0.9982 |
40 |
0.9922 |
60 |
0.9832 |
80 |
0.9718 |
100 (газ) |
0.0006 |

 Плотность воды
Плотность воды
При охлаждении воды ее молекулы группируются
вагрегаты, которые постепенно увеличиваются и становятся все более устойчивыми по мере приближения к температуре 4° С, когда вода достигает максимальной плотности.
При этой температуре вода еще не имеет жесткой структуры и наряду с длинными цепочками ее молекул существует большое количество отдельных молекул воды.
При дальнейшем охлаждении цепочки молекул воды растут за счет присоединения к ним свободных молекул, в результате чего плотность воды уменьшается.
Когда вода превратится в лед, все ее молекулы входят в более или менее жесткую структуру в виде незамкнутых цепочек, образующих кристаллы.

Поверхностное натяжение, теплота парообразования и растворяющая
Высокие величины поверхностного натяжения и теплотыспособностьпарообразования воды объясняются тем, что для отделения молекулы воды от группы молекул требуется относительно большая затрата энергии.
Стремление молекул воды устанавливать водородные связи и их полярность объясняют необычно высокую растворяющую способность воды.
Некоторые соединения, такие, как сахара и спирты, удерживаются в растворе благодаря водородным связям.
Соединения, обладающие высокой степенью ионизации в воде, например, хлористый натрий, удерживаются в растворе вследствие того, что ионы с противоположными зарядами нейтрализуются группами ориентированных молекул воды.

 Изотопы воды
Изотопы воды
Атомы водорода и атомы кислорода могут иметь различные массы при одинаковом заряде ядра. Разновидности химического элемента с различными атомными весами называются изотопами этого элемента.
Молекула воды обычно образуется водородом с атомным весом 1 (Н1) и кислородом с атомным весом 16 (О16). Более 99% атомов воды относится к этим изотопам.
Кроме того, существуют следующие изотопы: Н2, H3, О14, О15, О17 О18, О19. Многие из них скапливаются в воде в результате ее частичного испарения и вследствие своей большой массы.

 Изотопы воды
Изотопы воды
Изотопы Н3, О14, О15, О19 радиоактивны.
Наиболее распространен из них тритий Н3, образующийся в верхних слоях атмосферы под воздействием космических лучей. Этот изотоп накопился также в результате ядерных взрывов за последние несколько лет.
Путем анализа изотопного состава воды можно частично раскрыть историю некоторых природных вод.
Так, содержание тяжелых изотопов в поверхностных водах свидетельствует о длительном испарении воды, которое происходит, например, в Мертвом море, Большом Соленом озере и в других бессточных водоемах.
Изотопный анализ слишком дорог и по этой причине не может быть широко применен в исследованиях природных вод.

Некоторые физические
свойства воды, зависящие от
