
Механика(мод2)
.pdf
dA = 0; dQ = dU; dU = m CVdT; DU = m CVDT. M M
Изобарическим процессом называется процесс, в котором p=const или, как это следует из уравнения состояния идеального газа
(1.2):
V = V1 = V2 = const .
T T1 T2
Диаграмма этого изопроцесса в координатах p,V изображена на рис. 4.4.
Рис. 4.4
Работа при изобарическом расширении:
V2 V2
DA12 = ò pdV = p òdV = p(V2 - V1), DA12 = pDV при p-const
V1 V1
(4.16)
Из уравнения Менделеева-Клапейрона (1.2) при p=const следует:

pDV = m RDT M
Отсюда и из (4.16) получаем:
DA = m RDT, p = const . |
|
12 |
M |
|
|
Исследованием изобарического процесса мы фактически занимались в
предыдущем |
параграфе, где |
была |
определена |
теплоемкость |
при |
постоянном объеме. Из (4.10) и (4.7) следует: |
|
|
|
||
DQ = |
m |
CpDT , |
p = const . |
|
|||
|
M |
|
|
Приращение внутренней |
энергии здесь по-прежнему определяется |
||
формулой: |
|
||
DU = m CVDT .
M
Изотермическим процессом называется процесс при T=const или, как это следует из уравнения состояния идеального газа:
pV = p V = p V = |
m |
RT = const. |
(4.17) |
|||
|
||||||
1 |
1 |
2 |
2 |
M |
|
|
|
|
|
|
|
||
В координатах p,V диаграмма этого процесса - гипербола (рис. 4.5).

Рис. 4.5
Работа при изотермическом расширении:
V2 |
|
V2 |
m |
|
|
dV |
|
m |
V2 |
dV |
|
|||
DA12 = ò p(V)dV = ò |
RT |
= |
RT ò |
. |
||||||||||
|
|
V |
|
|
||||||||||
V1 |
|
V1 |
M |
|
|
M V1 |
V |
|||||||
После интегрирования получим: |
|
|
|
|
|
|
|
|||||||
DA = |
m |
RT ln |
V2 |
, |
T = const. |
(4.18) |
||||||||
|
|
|||||||||||||
12 |
M |
|
V1 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
При T=const внутренняя энергия идеального газа(4.12) не изменяется,
поэтому dU = 0. Отсюда и из первого начала термодинамики:
dQ = dA; DQ = m RT ln V2 , T = const.
MV1
§5. Адиабатический процесс
Адиабатическим называется процесс, идущий без теплообмена с окружающей средой. Исключить теплообмен можно либо за счет хорошей теплоизоляции, либо за счет очень короткого времени протекания

процесса (быстропротекающий процесс). Выведем уравнение адиабаты. Для этого при δQ = 0 из первого начала термодинамики (4.6) имеем:
dA = -dU, pdV = -dU.
Откуда и из (4.12) получаем:
pdV = - m CVdT × R . M CV
Продифференцировав уравнение Меделеева-Клапейрона (1.2), получим:
pdV + VdP = m RdT. M
Сложим полученное |
выражение с предыдущим, умноженным |
на |
R |
, и |
||||
CV |
||||||||
получим: |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
æ |
|
ö |
|
|
|
|
||
ç |
+ |
R |
÷ |
+ Vdp = 0. |
(4.19) |
|
||
|
|
|||||||
pdVç1 |
÷ |
|
||||||
è |
|
CV ø |
|
|
|
|
||
Поскольку
1 + R = CV + R = Cp = g, CV CV CV
уравнение (5.1) принимает вид:
gpdV + Vdp = 0 .
Или после деления на pV:
gdV + dp = 0. V p
После интегрирования получаем:

g ln V + ln p = const¢
или после простейших преобразований:
ln(pVg )= const¢
Если логарифм некоторой величины есть константа, то константой, но уже другой, является и сама эта величина:
pVg = const |
(4.20) |
Выражение (4.20) и есть уравнение адиабаты в координатах,V. Его называют также уравнением Пуассона, отношение теплоемкостей
g = Cp - коэффициентом Пуассона.
CV
5. Энтропия. Второе начало термодинамики.
Макро- и микросостояния. Статистический вес.
Равновесные и неравновесные состояния. Необратимые процессы.
Энтропия. Формулировка второго начала термодинамики.
Третье начало термодинамики.
Существует |
несколько |
различных |
формулировок |
второго |
начала |
|||||
термодинамики, которые эквивалентны между собой. Исторически второе |
|
|||||||||
начало |
возникло |
на |
основе |
анализа |
работы |
тепловых, |
и машин |
|||
формулировки |
второго |
начала |
термодинамики(Клаузиуса, Кельвина, |
|
||||||
Освальда), так или иначе, связаны с принципиальными ограничениями, |
|
|||||||||
накладываемыми |
на |
превращение |
|
тепловой |
(энергии |
|
||||
хаотического, неупорядоченного движения) в механическую работу. |
|
|
||||||||
В современной термодинамике второе начало формулируется как закон |
|
|||||||||
возрастания |
энтропии. |
Понятие |
энтропии |
можно |
четко |
и |
ясно |
|||
сформулировать в рамках статистической термодинамики, где энтропия S
определяется как величина, пропорциональная натуральному логарифму числа квантовых состояний Ω , доступных для системы:
S º k ln W |
(5.1) |
здесь k = 1,38 · 10-23 Дж/К - постоянная Больцмана.
В классической механике нет аналога квантового состояния, поэтому возникает вопрос, что же именно мы должны подсчитать, как найти
величину Ω - число квантовых состояний? Без некоторого привлечения понятий квантовой механики при подсчете энтропии реальных физических систем здесь принципиально нельзя обойтись.
Квантовая физика будет изложена позднее, поэтому для иллюстрации статистического определения энтропии мы воспользуемся простейшей моделью.
§ 1. Макро- и микросостояния. Статистический вес
Макросостояние - |
это состояние тела, содержащего огромное число |
||
частиц (N ~ NA), |
заданное |
с |
помощью макроскопических величин, |
характеризующих |
все тело |
в |
целом. Такими величинами могут быть |
давление p, объем V, температура T, внутренняя энергия U.
Задать микросостояние - это |
значит задать состояния |
всех частиц, из |
|||
которых состоит макроскопическое тело. |
|
|
|
||
В классической механике |
состояния |
материальной |
точки |
считается |
|
заданным, если задан ее радиус-векторr |
|
|
v |
||
и вектор ее скорости. |
|||||
Величины |
r и v изменяются с течением временинепрерывно, поэтому в |
||||
рамках классической механики нельзя ввести понятие"число состояний, |
|||||
в которых может находиться частица". Такая возможность появляется |
|||||
при описании микрочастиц на более глубоком, квантовом уровне, где |
|||||
величины, |
характеризующие |
состояние |
микрочастиц |
изменяются |
|
скачкообразно, дискретно.
Статистический вес (статвес) - это число различных микросостояний, соответствующих данному макросостоянию.
Мы будем обозначать статвес греческой буквой Ω.
Рассмотрим |
простую |
модель, иллюстрирующую |
понятия |
макро-, |
микросостояния статистического веса. |
|
|
||
Пусть идеальный газ, |
состоит из N частиц, помещенных в |
сосуд, |
||
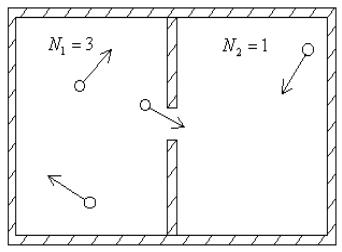
разделенный пополам перегородкой. В перегородке имеется небольшое отверстие, через которое молекулы могут случайным образом переходить из левой половины в правую и обратно (рис. 5.1).
Рис. 5.1
Макросостояние будем задавать числом молекулN в левой половине сосуда (тогда будет известно и число молекул в правой половинеN2 = N
- N1). Так как давление идеального газа
p = nkT,
то при заданном объеме сосудаV и температуре газаT такой способ задания макросостояния определяет величину давления p в левой и правой половине сосуда, таким образом, макросостояние будет иметь определенные значения трех параметров состояния: p, V, T.
Для задания микросостояний будем считать, что частицы в чем-то отличаются друг от друга, и мы их сможем пронумеровать.
Тогда микросостояние будем считать заданным, если известны номера молекул, находящихся слева от перегородки(разумеется, при этом известны и номера молекул, находящихся справа). Ясно, что такое задание

микросостояния не является полным, но для иллюстрации нужных нам понятий это достаточно хорошая модель.
Рассмотрим простейший случай, когда число молекулN = 4. Все возможные комбинации для этого случая представлены на рис. 5.2.
Рис. 5.2.
В прямоугольниках, изображающих сосуд с перегородкой, цифрами обозначены номера молекул, находящихся по обе стороны перегородки. Каждый такой прямоугольник с молекулами обозначает определенное микросостояние.
Прямоугольники |
микросостояний |
сгруппированы |
в , |
столбик |
||
соответствующие разным макросостояниям. Макросостояния (их у нас |
|
|||||
пять) обозначены прямоугольниками с цифрами, обозначающими число |
|
|||||
молекул слева и справа от перегородки. Всего микросостояний 16 = 24, |
|
|||||
т.к. каждая молекула, независимо от других, может находиться в двух |
|
|||||
положениях: слева |
и |
справа. Молекул |
4, значит |
общее |
число |
|
микросостояний Ωобщ |
= 2 · 2 · 2 · 2 = 24 = 16. Высота столбиков |
|
||||
микросостояний |
дает |
число |
различных |
микросостоянийΩi, |
||
соответствующих заданному макросостоянию с номером i.
Предположим, что все 16 |
микросостояний |
рассматриваемой |
системы |
||||||
равновероятны, |
т.е. встречаются |
с |
одинаковой |
частотой(это |
|||||
предположение |
носит |
названиеэргодической |
|
гипотезы). |
Тогда |
||||
вероятность (2.2) |
реализации |
макросостояния |
с |
номеромi |
будет |
||||
пропорциональна статвесу Ωi этого состояния:
wi = |
Wi |
. |
|
(5.2) |
|
|
|
||||
|
W |
общ |
|
|
|
|
|
|
|
||
Из рассмотренного примера видно, что с наименьшей вероятностью (1/16) |
|||||
реализуются состояния сN1 = 0, N2 |
= 4 и с N1 |
= 4, N2 = 0, т.е. |
|||
макросостояния с крайне неравномерным распределением молекул между |
|||||
половинками сосуда. |
Наибольшая |
вероятность |
у макросостояния с |
||
номером i = 3, где слева и справа от перегородки находится одинаковое число молекул.
Можно показать, что число микросостоянийΩi (N1, N - N1) нашей
модельной системы для произвольного числа молекулN определяется следующим способом:
Wi (N1, N - N1) = |
N! |
|
, |
|
N1!(N - N1)! |
||||
|
|
|||
здесь N! - произведение всех целых чисел от единицы Nдо. При увеличении числа частиц растет как общее число микросостоянийΩобщ = 2N, так и увеличивается разница в статистических весахΩi различных
макросостояний. Для N = NA = 6,02 1023 г/моль вероятность того, что все молекулы соберутся в одной половине сосуда:
w1 = |
Wi |
» |
1 |
» |
|
1 |
|
. |
Wобщ |
23 |
103×10 |
22 |
|||||
|
210 |
|
|
|
||||
Это число настолько мало, что можно считать, что такое событие никогда не произойдет.
§ 2. Равновесные и неравновесные состояния. Необратимые процессы
Макроскопическая система, состоящая из большого числа частиц(N ~ NA), согласно эргодической гипотезе проводит одинаковое время во всех
своих |
микросостояниях. В |
результате |
с |
большей |
вероятностью |
реализуются макросостояния с наибольшим статистическим весом, в этих |
|||||
макросостояниях система |
проводит большую |
часть своего времени. |
|||
Иногда система случайным образом оказывается в макросостояниях с меньшим статвесом, но так как статвес их , проводитмал в них незначительную часть своего времени. При этом физические величины, характеризующие систему, испытывают кратковременные отклонения от своих средних значений. Такие отклонения называются флуктуациями.
Равновесным называется такое макроскопическое состояние системы, которое не имеет тенденции к изменению с течением времени. Ясно, что равновесное макросостояние - это такое состояние, которое реализуется наибольшим числом микросостояний, т.е. статвес равновесного состояния максимален.
Неравновесные состояния - это состояния со статвесом меньшим, чем у равновесного. В неравновесном состоянии система находится тем меньше, чем меньше его статвес.
Необратимым называется процесс, обратный которому маловероятен.
