
Механика(мод2)
.pdf
|
|
|
m |
|
v2 |
|
|
m |
|
æ |
|
|
|
ö2 |
|
3 |
|
|
|
|
|
0 |
ср.кв. |
|
0 |
|
3kT |
|
|
|
|
||||||
< e |
пост. |
>= |
|
|
|
= |
|
ç |
|
|
÷ |
= |
|
kT . |
(3.14) |
|||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
2 |
|
2 |
ç |
|
m0 |
÷ |
|
2 |
|
|
||||
|
|
|
|
|
|
è |
|
ø |
|
|
|
|||||||
Получен уже известный нам результат (см. (1.8)).
Из (3.9), (3.11) и (3.13) следует:
vвер : <v> : vср.кв .= 1 : 1,13 : 1,22.
Из (3.6) и (3.4) получим:
|
|
|
|
|
m |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
æ |
|
|
|
|
|
|
m |
|
|
|
|
||||||
|
|
0 |
ö 2 |
|
-1 |
|
|
|
0 |
|
|
|
|||||||
|
|
|
|
F(vвер ) = 4ç |
|
|
÷ |
e |
|
~ |
|
|
|
|
|
. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
è |
2pkT ø |
|
|
|
|
|
T |
||||||||||
Отсюда и |
формулы(3.9) видно, |
|
что |
при |
увеличении температуры |
||||||||||||||
максимум функции F(v) смещается вправо vвер ~ |
|
|
|
|
и становится ниже |
||||||||||||||
|
|
|
T |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F(vвер ) ~ |
1 |
|
- см. рис. 3.5. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||

Рис. 3.5
При увеличении массы молекулы максимум функцииF(v) смещается
влево, так |
|
как vвер ~ 1 |
|
|
. Он |
становится выше, так как |
|
|
|
||||||
|
|
|
|
|
m0 |
|
|
F(vвер ) ~ |
|
. |
|
|
|
|
|
m0 |
|
|
|
|
|||
Напомним, |
что площадь, |
ограниченная |
функцией F(v), остается |
||||
постоянной и равной единице (см. (3.5)). |
|
||||||
4. Первое начало термодинамики и его применение
Основные понятия термодинамики.
Первое начало термодинамики Теплоемкость идеального газа.
Изопроцессы. Адиабатический процесс
§ 1 Основные понятия термодинамики
Термодинамическая система - это совокупность макроскопических тел,
которые |
могут |
взаимодействовать |
между |
собой и с другими телами |
||||
(внешней |
средой) |
- обмениваться |
с |
ними |
энергией и веществом. В |
|||
частности, |
термодинамическая |
система |
может |
состоять |
из |
одного |
||
макроскопического тела.
В некоторых отношениях простейшим макроскопическим телом является идеальный газ, на примере которого мы будем иллюстрировать понятия и законы термодинамики.
Состояние |
термодинамической |
системы характеризуют |
макроскопическими параметрами состояния: давлением, температурой, |
||
объемом, плотностью |
и т.д. Например, для |
заданной массы идеального |
газа параметрами состояния являются три величины: P, V, T.
Равновесное состояние - это такое состояние системы, в которое она самопроизвольно переходит через достаточно большой промежуток времени (время релаксации) в условиях изоляции от окружающей среды. В равновесном состоянии параметры системы имеют определенные значения и не меняются со временем.
Термодинамическим процессом называется всякое изменение во времени хотя бы одного из параметров состояния системы.
Равновесным |
термодинамическим |
процессом |
|
называют |
, процесс |
|||
состоящий из непрерывной последовательности равновесных состояний. |
|
|||||||
Строго равновесным может быть только бесконечно медленный процесс. |
|
|||||||
Равновесный |
процесс |
являетсяобратимым, т.к. |
он |
может |
быть |
|
||
осуществлен в обратном направлении через |
те |
же промежуточные |
||||||
состояния |
и |
без |
каких-либо |
изменений |
в |
окружающих. |
тел |
|
Классическая термодинамика дает полное количественное описание |
|
|||||||
только |
равновесных |
процессов. Термодинамика |
неравновесных |
|
||||
процессов занимается изучением количественных закономерностей в |
|
|||||||
неравновесных процессах для состояний, не сильно отличающихся от |
|
|||||||
равновесных. |
|
|
|
|
|
|
|
|
§ 2. Первое начало термодинамики
Первое начало термодинамики- это закон сохранения энергии для
систем, в которых существенную роль играют тепловые процессы.
Важнейшей характеристикой такой системы является внутренняяее
энергия. Внутренняя энергия термодинамической системыU - это
энергия физической системы, зависящая от ее внутреннего состояния.
Внутренняя энергия включает в себя энергию хаотического(теплового) движения всех микрочастиц системы и энергию взаимодействия этих частиц между собой. Во внутреннюю энергию не входит кинетическая энергия движения системы как целого и ее потенциальная энергия во внешних полях. Внутренняя энергия - функция состояния системы, т.е. величина внутренней энергии не зависит от процесса перехода системы в данное состояние, а определяется значением параметров состояния.
В идеальном газе молекулы не взаимодействуют между собой, поэтому его внутренняя энергия:
U = N < e >, |
(4.1) |
где N - число молекул в |
|
рассматриваемом |
количестве ,газакоторое, |
||||||
согласно (1.3), равно |
m |
NA ; |
<ε> - средняя |
энергия одной молекулы, |
|||||
|
|
||||||||
|
|
|
|
M |
i |
|
|
||
которая, согласно (1.9) равна |
kT |
|
|||||||
2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
Отсюда внутренняя энергия идеального газа: |
|
||||||||
U = |
m |
× |
i |
kT . |
|
|
(4.2) |
||
|
|
|
|
||||||
|
M 2 |
|
|
|
|||||
Существуют |
два |
принципиально различающихся |
способа |
изменения |
||||||
состояния |
|
системы. |
Первый |
связан |
с |
работойА |
системы |
по |
||
перемещению |
окружающих |
тел(или |
с |
работой А' |
этих |
тел |
над |
|||
системой). |
Второй способ |
состоит в сообщении |
системе |
количества |
||||||
теплоты |
Q (или отвода ее) |
при неизменном расположении окружающих |
||||||||
тел. Количество теплоты Q, сообщенное телу, есть ни что иное как
количество энергии, сообщенное телу за счет обмена энергиями между молекулами контактирующих тел.
В общем случае количество теплоты, сообщенное термодинамической
системе, идет на приращение внутренней |
энергии системы и на |
совершение работы над внешними телами, т.е.: |
|
DQ = DU + DA . |
(4.3) |
Это и есть первое начало термодинамики. |
|
Пусть идеальный газ расширяется в цилиндре под поршнем, а тот
переходит из положения1 в положение 2. Совершаемая |
при этом газом |
механическая работа: |
|
h 2 |
|
DA1,2 = ò F(h)dh . |
(4.4) |
h1 |
|
А если перейти от силы F к давлению, которое по определению равно

p = F : S
Получим
h 2 |
V2 |
|
DA1,2 = ò p(h)Sdh = ò p(V)dV |
(4.5) |
|
h1 |
V1 |
|
Рис 4.1
Как известно из курса математики, определенный интеграл (4.5) равен площади криволинейной трапеции под кривой p(v) - см. рис. (4.2).

Рис. 4.2
На этом рисунке переход из состояния1 в состояние2 осуществляется двумя способами - посредством двух различных процессов. Из рисунка видно, что величина работы А12 определяется не только начальным и конечным состоянием тела, но и характером изменения давленияp(v) в процессе расширения.
Теми же свойствами обладает и подведенное к телу количество теплоты и поэтому первое начало термодинамики для бесконечно малого изменения состояния принято записывать следующим образом:
dQ = dU + dA = dU + pdV . |
(4.6) |
Здесь δQ - бесконечно малое количество теплоты, сообщенное телу, не |
|
являющееся полным дифференциалом какой-либо |
функции; dU - |
бесконечно малое изменение внутренней энергии |
- телаполный |
дифференциал его внутренней энергии.
§ 3. Теплоемкость идеального газа
Теплоемкость |
тела - |
это |
|
отношение |
количества |
теплоты, |
||
сообщенного телу, к изменению температуры δТ, которое при этом |
||||||||
произошло: |
|
|
|
|
|
|
|
|
Cтела = |
dQтела |
, |
[Cтела |
] = |
Дж |
. |
|
|
|
|
|
|
|||||
(4.7) |
dT |
|
|
К |
|
|
||
|
|
|
|
|
|
|
|
|
Удельная теплоемкость - это отношение теплоемкости тела к его массе, т.е.:
c = |
Cтела |
= |
1 |
|
dQтела |
, |
[c] = |
Дж |
. |
|
|
|
|
||||||
|
m m dT |
|
кг × К |
||||||
(4.8) |
|
|
|
|
|
|
|
|
|
Молярная теплоемкость - это теплоемкость одного моля вещества, т.е.:
C = |
dQM |
. |
(4.9) |
|
|||
|
dT |
|
|
Здесь δQМ - количество теплоты, подведенное к одному молю вещества |
|||
для нагревания его наδТ. Так как масса одного моля равнаМ, из (4.8)
можно получить связь между С и с:
c = |
C |
= |
1 |
|
dQM |
; |
C = c × M ; Cтела |
= |
m |
c. |
(4.10) |
|
|
|
|
||||||||
|
M M dT |
|
|
M |
|
||||||
Определим молярную теплоемкость идеального газа при постоянном объеме. Согласно первому началу термодинамики:
dQM = dUM + pdVM .
При постоянном объеме dV = 0 и δQМ = dUМ.
Отсюда:
|
æ dQM ö |
|
dUM |
|
|
|
i |
RdT |
i |
|
|
|||||||
|
|
|
|
|
2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
CV |
= ç |
|
÷ |
= |
|
|
|
= |
|
|
|
|
= |
|
R . |
(4.11) |
||
|
dT |
|
dT |
|
2 |
|||||||||||||
|
è dT |
øV=const |
|
|
|
|
|
|
|
|
|
|
||||||
Здесь использовано то, что, согласно (4.2), |
|
|
|
|
|
|
||||||||||||
|
|
|
|
U = |
m |
× |
i |
RT и |
m |
=1, |
|
|||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
M 2 |
|
|
M |
|
|
|
||||||
если речь идет об одном моле вещества.
Из (4.2) и (4.11) следует:
U = |
m |
CVT . |
(4.12) |
|
|||
|
M |
|
|
Определим молярную теплоемкость идеального газа при постоянном давлении:
|
æ dQ |
ö |
|
dU |
M |
æ pdV |
ö |
|
æ dV ö |
|||||
Cp |
= ç |
|
M |
÷ |
= |
|
+ ç |
M |
÷ |
= CV |
+ pç |
M |
÷ |
|
|
|
|
|
dT |
|
|||||||||
|
è |
dT øp=const |
|
dT è |
øp=const |
|
è |
dT øp=const |
||||||
(4.13)
Для одного моля уравнение Менделеева-Клапейрона принимает вид:
|
|
|
|
|
V |
= |
RT |
, |
|
|
|
|
|
|
|||
|
|
|
|
|
M |
|
p |
|
|
|
|
|
|
|
|
||
отсюда и из (4.13): |
|
|
|
|
|
|
||
Cp = CV + p |
d æ RT ö |
= CV |
+ R . |
|||||
|
ç |
|
÷ |
|||||
|
|
|||||||
|
dT è |
p øp=const |
|
|
|
|
||
Таким образом:
Cp = CV + R = |
i |
R + R = |
i + 2 |
R . |
(4.14) |
|
|
||||
2 |
2 |
|
|
||
Отношение теплоемкостей |
Cp |
= g называют коэффициентом Пуассона. |
|||
CV |
|||||
|
|
|
|
||
Из (4.11) и (4.14) следует, что: |
|
||||
g = |
i + 2 |
. |
(4.15) |
||
|
|||||
|
i |
|
|||
Экспериментальные данные о температурной зависимости теплоемкости газов
Как следует из (4.11) и (4.14) молярные теплоемкости идеальных газов не зависят от температуры и определяются только числом степеней свободы молекул газа. Эксперимент не подтверждает эти теоретические результаты.
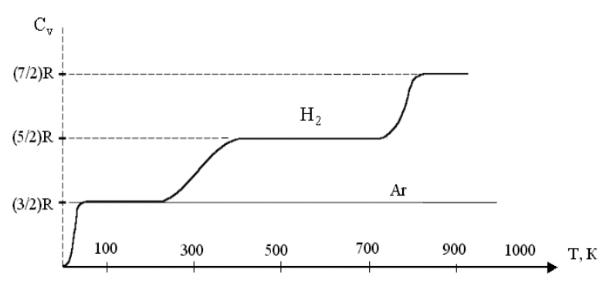
Рис. 4.3
На рисунке приведена качественная зависимость молярной теплоемкости СV от температуры для аргона(Ar) и водорода(H2). Лишь для

одноатомных |
газов (Ar) |
теплоемкость СV |
в широком |
диапазоне |
|
температур постоянна и соответствует, как и показывает теория, трем |
|||||
степеням свободы (i = 3) |
(за исключением температур, близких к |
||||
абсолютному нулю). При температурах T < 100K водород ведет себя как |
|||||
одноатомный |
газ |
сi = 3. |
Затем число степеней свободы как бы |
||
непрерывно растет и достигает значения i = 5 при Т = 400К. |
|
||||
В диапазоне температур от 100К до 400К происходит как бы постоянное |
|||||
"размораживание" |
двух |
вращательных |
степеней |
свободы. При |
|
приближении температуры к 1000К появляется и колебательная степень
свободы, на которую приходится две половинкиkT (учитывается кинетическая и потенциальная энергия колебательного движения).
Таким образом, степени свободы, связанные с поступательным движением, дают вклад в теплоемкость при любой температуре, как и предсказывает теория.
Иная ситуация с вращательным движением и колебаниями молекул. Здесь
мы имеем дело с внутренними движениями атомов |
в |
молекуле, для |
||||
которых |
законы классической |
механики |
неприменимы. Эти движения |
|||
носят дискретный, квантовый |
характер |
и проявляются, начиная с |
||||
некоторой |
пороговой |
температуры. Для |
описания |
этих |
движений |
|
необходимо использовать законы квантовой физики.
§ 4. Изопроцессы
Изопроцессами называются равновесные процессы, при которых один из параметров состояния (р, V или Т) остается постоянным.
Изохорическим процессом называется процесс, при котором V=const
или, как это следует из уравнения состояния идеального газа (1.2):
p = p1 = p2 = const . T T1 T2
Фактически мы уже занимались исследованием изохорического процесса, определяя CV в предыдущем параграфе. Итак, для изохорического процесса выполняются следующие соотношения:
