
- •СОДЕРЖАНИЕ
- •Химическая номенклатура
- •Основные понятия и законы стехиометрии
- •Основные понятия химии
- •Стехиометрические законы химии
- •Законы газового состояния вещества
- •СТРОЕНИЕ ВЕЩЕСТВА
- •Строение атома и периодическая система
- •Химическая связь и строение молекул
- •Энергетика химических процессов
- •Химико-термодинамические расчеты
- •Расчет калорийности пищи
- •Химическое равновесие
- •Способы выражения состава растворов
- •Свойства разбавленных растворов неэлектролитов
- •РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •Диссоциация, степень диссоциации
- •Реакции ионного обмена
- •Амфотерные гидроксиды
- •Произведение растворимости
- •Ионное произведение воды, водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Комплексные соединения
- •Жесткость воды и ее методы устранения
- •Коллоидные растворы
- •Гальванические элементы
- •ЭЛЕКТРОЛИЗ
- •Коррозия металлов
- •Криоскопические (К) и эбуллиоскопические (Е) постоянные
- •Латинский алфавит
- •Греческий алфавит
- •ДЕСЯТИЧНЫЕ ЛОГАРИФМЫ
- •СПИСОК ЛИТЕРАТУРЫ
43
ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. В результате бомбардировки ядра 105 Ве -частицами оно превращается в
ядро 137 N . Напишите полное и сокращѐнное уравнения ядерной реакции. Какая вторичная частица выделяется в результате этой реакции?
2.Какой из подуровней 4f или 5d будет заполнятся раньше?
3.В структуре электронных оболочек атомов элементов имеются конфигу-
рации: а) 6р3; б) 5f 2; в) 3d5; г) 3d5 4s2 ; д) 4s2 4p5.
К каким электронным семействам относятся эти элементы? Напишите их
полные электронные формулы. Назовите их.
4.Составьте электронно-графические схемы ионов Fe2+ и Fe3+. Чем можно объяснить особую устойчивость электронной конфигурации Fe3+?
5.Общей формуле Э2О7 соответствует высший оксид элемента, атом которого
имеет сокращѐнную электронную формулу:
а) 3s2 3p2 |
б) 3s2 3p4 |
в) 3s2 3p5 |
г) 3s2 3p3 |
|
6. |
Электронная формула внешнего уровня 5s2 соответствует иону: |
|||
а) Mg2+ |
б) Sb3+ |
в) Sn4+ |
г) Fe3+ |
|
7. |
Восстановительные свойства увеличиваются в ряду элементов: |
|||
а) N, O, F |
б) K, Rb, Cs |
в) As, Ge, Ga |
г) Zn, Cd, Hg |
|
Глава 4. Химическая связь и строение молекул
Студент должен уметь:
1.Определять тип химической связи между атомами и объяснять механизм еѐ образования.
2.Определять виды связи (полярная и неполярная, одинарная и кратная, и .
3.Составлять электронные схемы молекул.
4.Определять тип гибридизации атомных орбиталей указанного атома в молекуле и геометрическую форму молекулы.
44
Многие физические и всѐ химические свойства веществ определяются типом химической связи. Атомы, не обладающие завершѐнным уровнем,
находятся в неустойчивом энергетическом состоянии. Поэтому основной
движущей силой, приводящей к образованию химической связи, является стремление атомов к завершению внешнего уровня. Осуществляется это за счѐт передачи электронов одного атома другому, либо путѐм их обобществления.
Квантовая химия описывает химическую связь как результат электростатического взаимодействия между валентными электронами и положительно заряженными остовами атомов. При образовании химической связи происходит перекрывание электронных облаков связывающихся частиц,
которое сопровождается уменьшением полной энергии системы.
Основными параметрами химической связи являются ее энергия и длина. Энергией связи ( Hсв., кДж/моль) называют ту энергию, которая выделяется при образовании одной связи между свободными атомами при получении 1 моль вещества. Длиной связи называют среднее расстояние между ядрами, отвечающее минимуму энергии системы. Чем больше энергия связи и меньше еѐ длина, тем прочнее связь.
Основные типы химической связи:
а) ионная; б) ковалентная; в) металлическая.
Ионная связь возникает за счѐт электростатического притяжения между катионом и анионом, которые образуются в результате отдачи и принятия электронов.
Ковалентная связь осуществляется посредством общей электронной пары (или пар), принадлежащей обоим атомам, которая может быть получена двумя способами:
1. Каждый из атомов отдаѐт на образование общей электронной пары по одному электрону (обменный механизм образования связи). Обменная связь может быть полярной и неполярной.
45
2. Один атом отдаѐт в общее пользование два неподелѐнных электрона
(донор), а другой (акцептор) – для этой пары вакантную орбиталь (донорно-
акцепторный механизм образования связи).
.
Для приблизительной оценки ионности связи используют эмпирическую зависимость ионности от разности относительных электроотрицательностей ( ОЭО) атомов, образующих связь:
-∆ОЭО > 1,7 – преобладает ионная связь;
-∆ОЭО от 0,5 до 1,7 – ковалентная полярная связь;
-∆ОЭО < 0,5 – ковалентная неполярная связь.
Металлическая связь характерна для металлов, атомы которых на внешнем уровне имеют мало валентных электронов (чаще 2 или 3), слабо удерживающихся в атоме, и большое количество энергетически близких свободных орбиталей. Это создаѐт условия для свободного перемещения электронов по орбиталям атома. Таким образом, происходит обобществление валентных электронов между всеми атомами кристалла
Свойства ковалентной связи
Направленность – определенная ориентация связей в пространстве.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется -связью, перекрыванием АО по обе стороны линии, соединяющей ядра атомов – -связью, а перекрыванием d-
орбиталей всеми четырьмя лепестками – -связью (рис. 1).
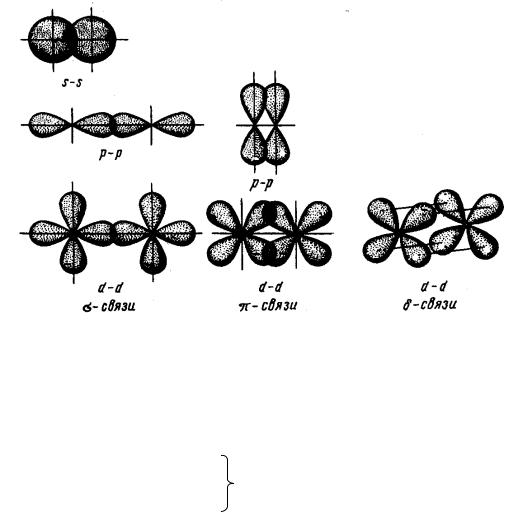
46
|
|
Рис. 1 |
|
Кратность – это число связей, образующихся между атомами. |
|
С – С |
1 |
– одинарная связь. |
С = С |
1 + 1 |
– двойная |
|
|
кратные связи |
С С |
1 + 2 |
– тройная |
Полярность связи – степень смещения центра тяжести электронных облаков связывающих электронов в сторону более электроотрицательного атома.
Гибридизация атомных орбиталей
Гибридизацией называется процесс взаимодействия различных по форме
иэнергии валентных орбиталей, приводящий к образованию новых
«смешанных» (или гибридных) орбиталей, которые одинаковы по форме и энергии. Гибридизации подвергаются орбитали одного и того же атома разных,
но близлежащих подуровней (близких по энергии). Химические связи с участием гибридных орбиталей прочнее, чем связи, образованные простыми
47
орбиталями, так как гибридные орбитали более полно перекрываются с
облаками взаимодействующих атомов.
В зависимости от вида и числа атомных орбиталей, вступающих в гибридизацию, различают несколько типов гибридизации. Наиболее распространены sp-, sp2-, sp3-гибридизации. Возможны также гибридизации с участием d- и f-орбиталей атома. Каждому типу гибридизации соответствует
определенная структура орбиталей и молекул.
Типы гибридизации
Тип молекулы |
Тип |
Геометрическая |
Примеры |
|
гибридизации |
форма |
|||
|
|
|||
|
|
|
|
|
AB2 |
sp |
линейная |
BeF2, СO2 |
|
AB3 |
sp2 |
тригональная |
ВF3, SO3 |
|
AB4 |
sp3 |
тетраэдрическая |
СН4, СCl |
|
AB5 |
sp3d |
бипирамидальная |
PF5 |
|
AB6 |
sp3d2 |
октаэдрическая |
SiF6 |
|
|
|
|
|
Основные положения метода молекулярных орбиталей (ММО)
1.Молекула рассматривается как единая система ядер и электронов, а не как совокупность атомов, сохраняющих некоторую индивидуальность.
2.Подобно тому, как электроны в атомах располагаются на АО (s, p, d, f),
общие электроны в молекуле располагаются на молекулярных орбиталях (МО).
Их обозначают латинскими буквами (сигма), (пи), (дельта), (фи).
3. Существует несколько приближенных методов расчета молекулярных орбиталей. Наиболее простой из них называется методом линейной комбинации атомных орбиталей (МЛК АО). С точки зрения этого метода молекулярную орбиталь рассматривают как линейную комбинацию соответствующих АО.

48
4.В образовании молекулярной орбитали участвуют те АО, которые имеют близкую по величине энергию и приблизительно одинаковую симметрию относительно оси связи.
5.При взаимодействии двух АО в результате их линейной комбинации образуется две МО. Молекулярную орбиталь, которая образуется при сложении волновых функций АО, когда электронная плотность в области между ядрами возрастает называют связывающей. Ее энергия ниже энергии исходных АО.
Молекулярную орбиталь, получаемую в результате вычитания с пониженной
электронной плотностью (большей энергией) называют разрыхляющей.
6.Число всех образовавшихся МО равно сумме АО исходных атомов.
7.Каждая МО характеризуется набором квантовых чисел. Заполнение МО электронами подчиняется всем законам заполнения АО.
8.Молекулы образуются лишь в том случае, если число электронов на связывающих орбиталях превышает их число на разрыхляющих орбиталях.
9.В методе МО вместо кратности связи, используемой в методе валентных связей, вводится понятие порядка связи, который равен разности между числом электронов, находящихся на связывающих орбиталях (Nсв) и числом электронов на разрыхляющих орбиталях (Nр), деленной на 2:
n = Ncв Np
2
49
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Определение типа связи, составление электронных схем молекул и ионов
Пример 1. Определите типы связей в следующих молекулах: Cl2, AsH3, H2S, NaCl. Составьте их электронные схемы.
Решение: На основании таблицы 2 Приложения вычислим разности относительных электроотрицательностей (∆ОЭО) атомов, образующих связи в данных молекулах:
Cl2 |
∆ОЭО(Cl-Cl) = 3,0 – 3,0 = 0 – ковалентная неполярная (< 0,5) |
AsH3 |
∆ОЭО(H-As) = 2,1 – 2,0 = 0,1 – ковалентная неполярная (< 0,5) |
H2S |
∆ОЭО(S-H) = 3,0 – 2,1 = 0,9 – ковалентная полярная (> 0,5, но < 1,7) |
NaCl ∆ОЭО(Cl-Na) = 3,0 – 0,9 = 2,1 – ионная (> 1,7)
Электронные схемы молекул:
Сначала составим графические схемы молекул, а затем электронные:
Cl2 |
AsH3 |
H2S |
NaCl |
Cl – Cl |
H – As – H |
H – S – H |
Na – Cl |
|
| |
|
|
|
H |
|
|
.. .. |
.. |
.. |
.. |
: Cl : Cl : |
H : As : H |
H : S : H |
[Na+] [: Cl :-] |
.. .. |
.. |
.. |
.. |
|
H |
|
|
Пример 2. |
Какая из ковалентных связей H – N, H – S, H – Te, – наиболее |
||
полярна? |
|
|
|
Решение: |
По данным таблицы 2 Приложения вычислим разность |
||
электроотрицательностей для этих связей ( ОЭО): |
|||
|
ОЭО(H) = 2,1, |
ОЭО (N) = 3,0, |
ОЭО (N-H) = 3,0-2,1 = 0,9 |
|
ОЭО(H) = 2,1, |
ОЭО (S) = 2,5, |
ОЭО (S- H) = 2,5-2,1 = 0,4 |
|
ОЭО(H) = 2,1, |
ОЭО (Те) = 2,1, |
ОЭО (Те-Н) = 2,1- 2,1 = 0 |

50
Чем больше разность электроотрицательностей соединяющихся атомов,
тем более полярна связь. Наиболее полярной является связь N – H (ОЭО= 0,9).
Определение количества связей в молекулах и вида орбиталей,
принимающих участие в образовании связи
Пример 3. В каких молекулах (N2, H2, O2, Cl2) в образовании связей участвует одна электронная пара? Какие орбитали атомов перекрываются при образовании связи?
Решение: Составим графические схемы молекул, исходя из числа
неспаренных электронов. |
|
|
|
|
|
|
|
|
|||||
|
|
|
N |
… 2s2 2p3 |
s |
|
|
p |
|
|
|
|
|
N2 |
7 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
n = 2 |
|
|
|
|
|
|
|
N N |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
|
H |
1s1 |
s |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||||
|
|
|
1 |
|
n = 1 |
|
|
|
|
|
|
|
Н – Н |
|
|
|
|
|
|
|
|
|
|
|
|||
O2 |
|
O … 2s2 2p4 |
s |
|
|
p |
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||||
|
|
|
8 |
|
n = 2 |
|
|
|
|
|
|
|
О = О |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl2 |
|
|
|
Cl … 3s2 3p7 |
s |
|
|
p |
|
|
|
|
|
17 |
|
|
|
|
|
|
|
|
|||||
|
|
|
n = 2 |
|
|
|
|
|
Cl – Cl |
||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Одинарные связи в молекулах H2 и Cl2. В молекуле H2 при образовании связи перекрываются s-орбитали, а в молекуле Cl2 – p-орбитали.
Пример 4. Сколько - и - связей в ионе PO34 ?
Решение: PO34 – кислотный остаток фосфорной кислоты. Поэтому сначала определим степень окисления кислотообразующего элемента (фосфора) по известной степени окисления кислорода (–2).
51
PO3 |
x + (–2 4) = –3 |
x = 8 – 3 = +5 |
4 |
|
|
Составим графические формулы кислоты и кислотного остатка:
|
|
Н |
|
| |
|||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
О |
| |
||||||
О |
|
|
|
|
О |
|
Н |
O P O |
|
|
Р |
|
|
||||||
|
|
|
|||||||
|
|
||||||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
||
|
|
О |
|||||||
|
|
|
O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
| |
|||||
|
|
H3PO4 |
|
PO3 |
|||||
|
|
|
|
|
|
|
|
|
4 |
В кислотном остатке 7 -связей и 1 -связь.
Определение типа гибридизации электронных облаков и
пространственной структуры молекулы
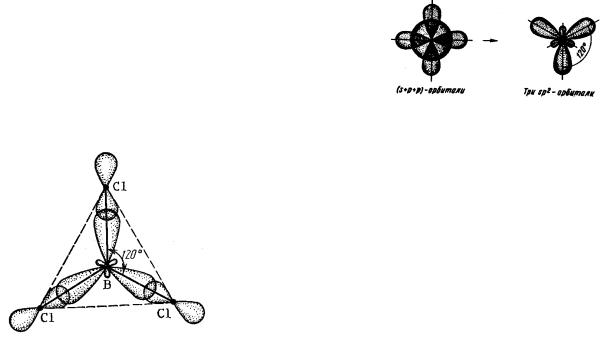
Пример 5. Определите тип гибридизации атомных орбиталей бора в молекуле
BCl3. Изобразите геометрическую формул этой молекулы.
Решение: Запишем для бора сокращенную электронную формулу и электронно-графическую формулу для возбужденного состояния:
5 B … 2s |
2 2p1 |
s |
|
|
p |
|
|
|
|
|
|
||
|
n = 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Гибридизации подвергаются одна s-орбиталь и две p-орбитали бора. Тип гибридизации – sp2.
Следовательно, при образовании молекулы BCl3
три гибридных орбитали бора взаимодействуют с p-орбиталями хлора. Молекула BCl3 имеет форму плоского треугольника (рис. 2).
Рис. 2

52
Вычисление длины связи
Пример 6. Рассчитайте длину связи в молекуле HBr, если междурядные расстояния в молекулах H2 и Br2 соответственно равны 0,74 10–10 и 2,28 10–10.
Решение: Приближенно оценить длину ковалентной связи в молекуле можно по формуле:
dA B dA A dB B ,
2
где dA B – длина связи в молекуле AB;
dA A и dB B – междурядные расстояния в молекулах A и B.
Длина связи H – Br равна:
|
|
|
dH |
|
dBr |
|
(0,74 2,28) 10 |
10 |
10 м. |
|
d |
|
|
|
2 |
2 |
|
|
|
1,51 10 |
|
H Br |
|
|
2 |
2 |
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
Вычисление дипольного момента молекулы
Пример 7. Длина диполя молекулы HCl равна 0,23 10–8 см. Вычислить дипольный момент молекулы.
Решение: Полярность молекулы характеризуется величиной дипольного момента :
= q l,
где q – заряд электрона (1,602 10–19 Кл); l – длина диполя, м.
l(HCl) = 0,23 10–8 см или 2,3 10–11 м.
= 1,602 10–19 2,3 10–11 = 3,43 10–30 Кл м
Дипольные моменты обычно измеряют в Дебаях (Д). 1Д = 3,33 10–30 Кл м.
|
3,4310 30 |
Кл м |
1,03Д . |
||
3,33 |
10 3 Кл м |
||||
|
|
||||
53
Вычисление энтальпии реакции по энергиям химических связей
Пример 8. Вычислить тепловой эффект химической реакции синтеза аммиака
(изменение энтальпии реакции), исходя из энергии химических связей реагентов и продуктов реакции.
Решение: Химическая связь N N |
H – H |
N – H |
||
H0 |
, кДж/моль |
946 |
436 |
391 |
св. |
|
|
|
|
|
|
N2(г) + 3H2(г) = 2NH3(г) |
|
|
При образовании |
химической |
связи энергия |
выделяется, а на разрыв |
|
химической связи требуются затраты энергии. Для разрыва химической связи в одном моле молекул N2 и в трех молях молекул H2 требуется 2254 кДж:
Hразр.св. =1 моль 946 кДж/моль + 3 моль 436 кДж/моль = 2254 кДж.
Вкаждой молекуле NH3 три связи N – H. Следовательно, при образовании связей в двух молях молекул NH3 выделится 2346 кДж.
Hобр.св.
N2(г)
= 2 моль(3391 кДж/моль) = 2346 кДж.
Hр ии Hразр.св. Hобр.св.
Hр ии 2254 2346 92кДж
3H2(г) 2NH3(г) : H0298 92кДж
Описание молекулы сложного вещества с помощью ММО
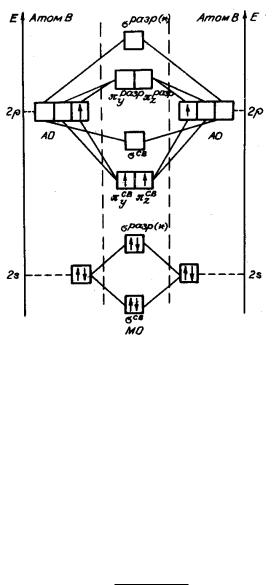
Пример 9. Нарисуйте энергетическую диаграмму молекулы B2 по методу молекулярных орбиталей (ММО), определите порядок связи.
Решение:
54
Рис. 3
Энергетическая диаграмма B2 должна включать в себя молекулярные орбитали, происходящие из 2s- и 2p-уровней изолированных атомов бора.
B2 св. 2s 2 * 2s 2 св. 2py 1 св. 2pz 1 .
Порядок связи (n), который равен половине разности числа электронов на связывающих (Nсв.) и разрыхлющих (Np) орбиталях:
n Nсв. Np 2
Примечание: Так как энергия 1s и *1s взаимно компенсируют друг друга, то они не участвуют в образовании химической связи и называются внутренними несвязывающими молекулярными орбиталями, поэтому в сокращенной записи могут либо не записываться, либо иметь условные обозначения, например K.
55
ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1.Определите тип связей в молекулах: HBr, CCl4, NH3, J2. Укажите для каждой связи направление смещения общей электронной пары.
2.Ковалентная полярная связь осуществляется в соединении:
а) SO2 |
|
б) H2Se |
в) CaO |
г) CS2 |
|
Ответ: «а» |
|
|
|
|
|
3. Наиболее прочная связь в молекуле: |
|
||||
а) O2 |
б) H2 |
в) N2 |
г) Cl2 |
|
|
Ответ: «в» |
|
|
|
|
|
4. Молекула СО2 содержит связи: |
|
||||
а) 1 и 1 |
б) 2 и 2 |
в) 3 и 1 |
г) 4 |
||
Ответ: «б»
5. Сколько валентных электронов атомов олова и хлора в сумме участвуют в образовании химической связи в молекуле SnCl4?
а) 2 б) 4 в) 6 г) 8
Ответ: «г»
6. Р-орбитали перекрываются в молекуле:
а) H2S |
б) H2 |
в) Cl2 |
г) CO |
Ответ: «в» |
|
|
|
7.Изобразите электронные схемы следующих частиц: CS2, CO32 , O2.
8.Дипольный момент молекулы NO равен 0,16 D. Вычислите длину диполя
молекулы NO.
Ответ: 0,033·10–10 м
9. Центральный атом имеет sp3-гибридизацию в молекуле:
а) PCl3 б) BeCl2 в) BF3 г) CCl4
10. Изобразите энергетическую схему образования молекулы F2 по методу МО. Сколько электронов находится на связывающих и разрыхляющих орбиталях?
