
- •21. Основной закон релятивистской динамики.
- •22. Закон взаимосвязи массы и энергии покоя.
- •23. Частицы с нулевой массой.
- •24. Модель идеального газа. Уравнение состояния.
- •25. Основное уравнение мкт газов.
- •26. Давление газа на стенки сосудов.
- •27. Средняя кинетическая энергия поступательного движения молекул идеального газа.
- •28. Распределение Максвелла. Виды скоростей молекул и их физический смысл.
- •29. Распределение Больцмана. Барометрическая формула.
- •30. Закон равного распределения энергии по степеням свободы. Внутренняя энергия.
- •31. Первое начало термодинамики.
- •32. Работа газа при изменении его объёма.
- •33. Теплоёмкость газа.
- •34. Применение первого начала к изопроцессам.
- •35. Адиабатический процесс. Уравнение адиабаты (Пуассона). Коэффициент Пуассона.
- •Адиабата Пуассона
- •36. Политропические процессы. Уравнение политропы.
- •37. Понятие энтропии. Свойства энтропии. Второе начало термодинамики.
- •38. Изменение энтропии при обратимых и необратимых процессах.
- •39. Третье начало термодинамики (теорема Нернста).
- •40. Принцип работы тепловой машины. Кпд.
- •41. Цикл Карно. Теорема Карно.
- •42. Реальные газы. Уравнение Ван-дер-Ваальса.
- •43. Экспериментальные изотермы.
- •44. Фазовые переходы.
- •45. Строение твёрдых тел. Классификация кристаллов.
- •46. Физические типы кристаллических решёток.
- •47. Дефекты в кристаллах.
- •48. Теплоёмкость твёрдых тел.
- •49. Диаграмма состояния. Тройная точка.
- •50. Физическая кинетика. Явления переноса. Диффузия. Закон Фика.
- •51. Теплопроводность. Внутреннее трение (вязкость).
- •52. Диффузия, теплопроводность и вязкость газов.
- •53. Закон Кулона. Напряженность электрического поля. Принцип суперпозиции.
- •54. Поток вектора. Теорема Гаусса. Расчёт электростатических полей.
- •55. Работа сил электростатического поля.
- •56. Потенциал. Градиент потенциала. Циркуляция вектора. Эквипотенциальные поверхности.
34. Применение первого начала к изопроцессам.
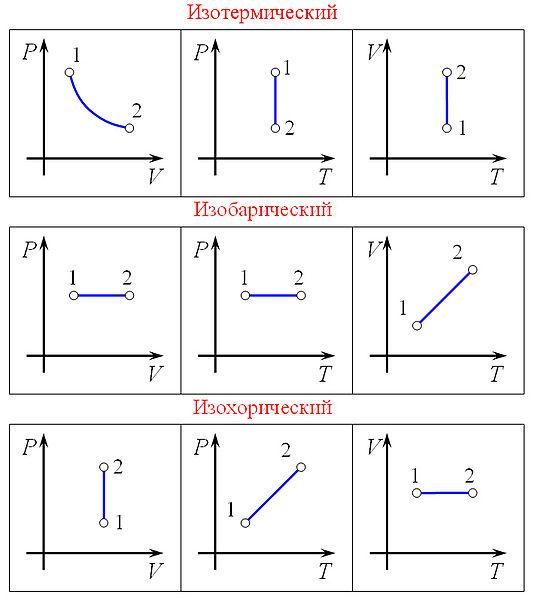
А) Изотермический процесс - процесс изменения состояния термодинамической системы при постоянной температуре
T
= const, PV = const, ∆U = const, A = RT*ln (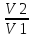 )
)
Б) Изобарный процесс - процесс изменения состояния термодинамической системы при постоянном давлении
P
= const,
 = const, ∆Q= ∆U + ∆A, A = P(V2-V1)
= const, ∆Q= ∆U + ∆A, A = P(V2-V1)
В) Изохорный процесс - процесс изменения состояния термодинамической системы при постоянном объёме
V
= const,
![]() ,
,
35. Адиабатический процесс. Уравнение адиабаты (Пуассона). Коэффициент Пуассона.
Адиабатический
процесс - термодинамический процесс в
макроскопической системе, при котором
система не обменивается тепловой
энергией с окружающим пространством.
Если термодинамический процесс в общем
случае являет собой три процесса —
теплообмен, совершение системой (или
над системой) работы и изменение её
внутренней энергии, то адиабатический
процесс, в силу отсутствия теплообмена
(![]() )
системы со средой сводится только к
последним двум процессам. Поэтому,первое
начало термодинамикив этом случае
приобретает вид
)
системы со средой сводится только к
последним двум процессам. Поэтому,первое
начало термодинамикив этом случае
приобретает вид![]()
где ![]() —
изменениевнутренней
энергиитела,
—
изменениевнутренней
энергиитела,![]() —работа,
совершаемая системой.
—работа,
совершаемая системой.
Адиабата Пуассона
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[6][15][16]
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где ![]() — абсолютная
температура газа.
Или к виду
— абсолютная
температура газа.
Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении ![]() )
газ нагревается (
)
газ нагревается (![]() возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент ![]() .
.
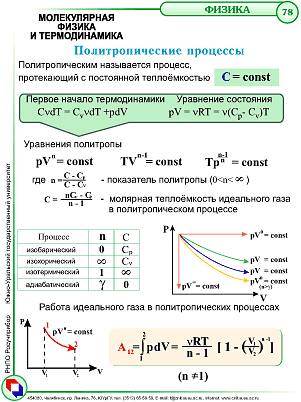
36. Политропические процессы. Уравнение политропы.
37. Понятие энтропии. Свойства энтропии. Второе начало термодинамики.
Состояние макроскопической системы, описанное с помощью объёма, давления и температуры, внутренней энергии определяет макро-состояние системы. Рассмотрим изолированную систему, состоящую из двух тел. В такой системе будет протекать процесс теплопередачи, приводящий к выравниванию температуры. Этот процесс является необратимым. Для того, чтобы знать, какие процессы могут протекать в изолированной термодинамической системе, нужно знать вероятность различных состояний этой системы. Величина, которая служит для характеристики вероятности состояний, получила название энтропии. Эта величина является функцией состояния, аналогично внутренней энергии. Если система находится в равновесии, то макро-состояние не изменяется. Однако, частицы системы всё время перемещаются и изменяют свой импульс в результате соударения. В результате, состояние системы всё время изменяется.
Свойства энтропии:
Энтропия изолированной системы при протекании необратимого процесса возрастает.
Энтропия системы, находящейся в равновесии, максимальна.
Утверждение о том, что энтропия изолированной системы может только возрастать, носит название закона возрастания энтропии, или вторым началом термодинамики.
