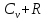- •21. Основной закон релятивистской динамики.
- •22. Закон взаимосвязи массы и энергии покоя.
- •23. Частицы с нулевой массой.
- •24. Модель идеального газа. Уравнение состояния.
- •25. Основное уравнение мкт газов.
- •26. Давление газа на стенки сосудов.
- •27. Средняя кинетическая энергия поступательного движения молекул идеального газа.
- •28. Распределение Максвелла. Виды скоростей молекул и их физический смысл.
- •29. Распределение Больцмана. Барометрическая формула.
- •30. Закон равного распределения энергии по степеням свободы. Внутренняя энергия.
- •31. Первое начало термодинамики.
- •32. Работа газа при изменении его объёма.
- •33. Теплоёмкость газа.
- •34. Применение первого начала к изопроцессам.
- •35. Адиабатический процесс. Уравнение адиабаты (Пуассона). Коэффициент Пуассона.
- •Адиабата Пуассона
- •36. Политропические процессы. Уравнение политропы.
- •37. Понятие энтропии. Свойства энтропии. Второе начало термодинамики.
- •38. Изменение энтропии при обратимых и необратимых процессах.
- •39. Третье начало термодинамики (теорема Нернста).
- •40. Принцип работы тепловой машины. Кпд.
- •41. Цикл Карно. Теорема Карно.
- •42. Реальные газы. Уравнение Ван-дер-Ваальса.
- •43. Экспериментальные изотермы.
- •44. Фазовые переходы.
- •45. Строение твёрдых тел. Классификация кристаллов.
- •46. Физические типы кристаллических решёток.
- •47. Дефекты в кристаллах.
- •48. Теплоёмкость твёрдых тел.
- •49. Диаграмма состояния. Тройная точка.
- •50. Физическая кинетика. Явления переноса. Диффузия. Закон Фика.
- •51. Теплопроводность. Внутреннее трение (вязкость).
- •52. Диффузия, теплопроводность и вязкость газов.
- •53. Закон Кулона. Напряженность электрического поля. Принцип суперпозиции.
- •54. Поток вектора. Теорема Гаусса. Расчёт электростатических полей.
- •55. Работа сил электростатического поля.
- •56. Потенциал. Градиент потенциала. Циркуляция вектора. Эквипотенциальные поверхности.
30. Закон равного распределения энергии по степеням свободы. Внутренняя энергия.
Закон равного распределения энергии по степеням свободы гласит, что на каждую поступательную степень приходится энергия E=1/2kT. На колебательную степень свободы приходитсяE=kT.
Важнейшей характеристикой молекул газа является его внутренняя энергия, которая представляет собой энергию хаотического движения молекул системы и энергию их взаимодействия. Внутренняя энергия есть однозначная функция термодинамического состояния системы. Состояние, в котором внутренняя энергия равна нулю. Важно знать изменение внутренней энергии при переходе из одного состояния в другое. Величина внутренней энергии для моля газа: U=CVT(CV– теплоёмкость приV=const).U=m/Ɲ *CVT
31. Первое начало термодинамики.
Рассмотрим термодинамическую систему, для которой механическая энергия не меняется, а изменяется лишь внутренняя энергия.
Внутренняя энергия системы может меняться в результате совершения на системой работы или сообщения ей тепла. Говорят о двух формах передачи энергии: форме работы и форме теплоты. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этом выполняется закон сохранения и превращения энергии. Допустим, что некоторая система, обладая внутренней энергией U, получила некоторое количество теплотыQи перешла в состояние с энергиейU2, совершая работу А над внешними телами.
Определение: кол-во теплоты считается положительным, если оно подводится к телу. И работа положительной, если система совершает её над внешними телами.
Из опыта известно, что при переходе из 1-го во 2-е состояние изменение энергии записывается как ∆U=U2-U1, и эта величина будет равна разности между полученной теплотойQи работой, совершаемой системой. Отсюда получаем: ∆Q= ∆U+ ∆A. Это Уравнение представляет собой первое начало термодинамики, которое гласит, что теплота, получаемая системой, затрачивается на изменение его внутренней энергии ∆Uи совершение работы над внешними телами. (измеряется в ДЖ).
Если система возвращается в исходное состояние, то изменение внутренней энергии равно нулю => Q=A.
Отсюда следует, что система не может произвести работы больше, чем кол-во теплоты, полученное системой (то есть вечный двигатель не возможен)
32. Работа газа при изменении его объёма.
Найдём в общем виде внешнюю работу, совершаемую газом при изменении его объёма. Рассмотрим газ в цилиндре. Под поршнем, внутри, находится газ под давлением Р.
Работа dA = F*dL, p = F/S, F = p*S => dA = p*S*dL = p*dV
Полную работу, совершаемую газом, при изменении объёма от V1 доV2, можно определить через интеграл:
А =

33. Теплоёмкость газа.
С =
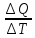 (Дж/К)
(Дж/К)
Существуют и другие виды теплоёмкости:
Удельная теплоёмкость вещества – величина, равная кол-ву теплоты, необходимое для нагревания одного вещ-ва на 1К. С =
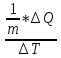 (Дж/кг*К)
(Дж/кг*К)Молярная теплоёмкость – величина теплоты, необходимая для нагрева 1 моля вещества на 1К.
С =
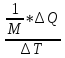
Между молярной и удельной теплоёмкостями
есть связь: Cуд
=
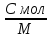
Различают теплоёмкости при постоянном объёме Сv и при постоянном давлении Ср.
Сv
=
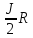
Ср. =