
- •Вопрос 2,3. Конец
- •Вопрос 4.
- •Вопрос 4. Продолжение
- •Вопрос 4. Продолжение
- •Вопрос 4. Конец
- •Вопрос 6, 7.
- •Вопрос 6, 7. Конец
- •I. Реакции присоединения
- •Вопрос 10 продолжение1.
- •Вопрос 10 продолжение2.
- •Вопрос 10 конец.
- •Вопрос 12 продолжение1.
- •Вопрос 12 продолжение2.
- •Вопрос 15 конец.
- •Сложные эфиры
- •Вопрос 19 конец.
- •Вопрос 21 конец.
- •Вопрос 23 конец.
- •Вопрос 24 конец.
Вопрос 23 конец.
ПРИМЕНЕНИЕ АМИНОКИСЛОТ Наибольший интерес представляют 20 L-α-аминокислот (аланин, аргинин, аспарагин и другие), входящих в состав белковых молекул. Смеси L-аминокислот, а также индивидуальные аминокислоты (например, метионин) применяют в медицине для парэнтерального питания больных с заболеваниями пищеварительных и других органов, при нарушениях обмена веществ и др.; лизин, метионин, треонин, триптофан - в животноводстве для обогащения кормов; глутамат натрия и лизин - в пищевой промышленности. ω-аминокислоты и их лактамы служат для промышленного производства полиамидов. γ-аминомасляная кислота (аминалон) - медиатор в центральной нервной системе, применяется как лекарственное средствово при сосудистых заболеваниях головного мозга. Ароматические аминокислоты используют в синтезе красителей и лекарственных средств. На основе аминокарбоновых и аминофосфоновых кислот синтезируют селективные комплексоны, комплексообразующие иониты, лигандообменные сорбенты, ПАВ.
Вопрос№22.
Анилин С6H5NH2 – важнейший из ароматических аминов. Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом, т.кип. 184 С, т.пл. -6 С. Ядовит. 1. Анилин - гораздо более слабое основание, чем алифатические амины (Kb = 5,2.10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо. Анилин реагирует с сильными кислотами, образуя соли фениламмония C6H5NH3+, которые хорошо растворимы в воде, но нерастворимы в неполярных органических растворителях: С6Н5NН2 + HCl → С6Н5NН3Сl. 2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце. Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:
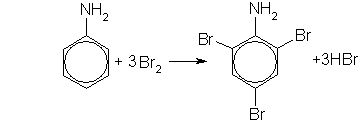
2,4,6-триброманилин 3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C6H5N2+: C6H5NH2 + NaNO2 + 2HCl → [C6H5-N≡N]+Cl- + NaCl + 2H2O. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. Применение. Основная область применения анилина — синтез красителей и лекарственных средств. В качестве примера приведем схему синтеза красителя метилового оранжевого (кислотно-основного индикатора): Анилин служит исходным веществом для получения ряда лекарственных средств (например, фенацетина и парацетамола) и при изготовлении красок.
Вопрос№23.
Строение аминокислот.
В каждой молекуле аминокислоты присутствует атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — карбоксильная группа — СООН. От карбоксильной группы легко отделяется ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — аминогруппа — NH2. Четвертый элемент аминокислоты — группа атомов, которую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль. R-группа также называется боковая цепь. Общую формулу аминокислоты в нейтральной среде (ph=7) можно записать как NH2+CHRCOO–
Аминокислотами называются азотосодержащие органические вещества, молекулы которых содержат карбоксильную группу – COOH и аминогруппу – NH2.
NH2 –CH2 –COOH NH2 –CH2 –CH2 –COOH
аминоуксусная кислота β-аминопропиновая кислота
CH3-CH-COOH α-аминопропиновая кислота | NH2
Физические свойства
Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Химические свойства
1. Кислотные свойства
а) Взаимодействие со щелочами
NH2 –CH2 –COOH + NaOH →NH2 –CH2 –COONa + H2O
б) Взаимодействие со спиртами
NH2 –CH2 –COOH + C2H5OH →NH2 –CH2 –COOC2H5 + H2O
2. Основные свойства
Взаимодействие с кислотами
NH2 –CH2 –COOH + HCl → NH3Cl–CH2 –COOH
Аминокислоты – амфотерные вещества.
3. Аминокислоты взаимодействуют друг с другом
NH2 –CH2 –COOH + NH2 –CH2 –COOH → NH2 –CH2 –CO-NH–CH2 –COOH + Н2О
дипептид
-СО–NH – пептидная группа (амидная группа)
Вопрос №24.
ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Материальный мир. в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. 2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, то есть отражать разные формы его существования. 3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды. Обобщая сказанное выше, можно дать следующее определение генетического ряда: Генетическим называют ряд веществ представителей разных классов, являющихся соединениями одною химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис. Генетическая связь — понятие более общее, чем генетический ряд. который является пусть и ярким, но частным проявлением этой связи, которая реализуется при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит н первый прицеленный в тексте параграфа ряд веществ. Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов: 1. Генетический рил металла. Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления +2 и +3:

II. Генетический ряд неметалла. Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например генетический ряд серы со степенями окисления +4 и +6. Затруднение может вызвать лишь последний переход. Если вы выполняете задания такого типа, то руководствуйтесь правилом: чтобы получить простое вещество из окнелгнного соединения элементе, нужно взять для атой цели самое восстановленное его соединение, например летучее водородное соединениенеметалла.
III. Генетический ряд металла, которому соответствуют амфотерные оксид и гндроксид, очень богат саязями. так как они проявляют в зависимости от условий то свойства кислоты, то свойства основания. Например, рассмотрим генетический ряд цинка:
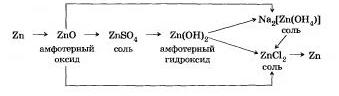
В органической химии также следует различать более общее понятие — генетическая связь и более частное понятие генетический ря. Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одикиконым числом атомов углерода в молекуле. Рассмотрим генетический ряд органических веществ, в кото-рый включим наибольшее число классов соединений:
