
- •Содержание
- •Глава 1. Обзор литературы
- •1.1.Кальпаин / кальпастатиновая протеолитическая система.
- •1.2.Биохимические механизмы нейродегенеративных заболеваний
- •Глава 2.Материалы и методы исследования
- •2.1 Реагенты и приборы
- •2.2 Моделирование нейродегенерации у лабораторных животных
- •2.3 Анализ биохимических показателей
- •2.3.1 Экстракция белков из тканей
- •2.3.2 Определение активности кальпаинов
- •2.3.3 Зимография с козеином
- •2.3.4 Электрофорез белков в полиакриламидном геле
- •2.3.5 Вестерн-блот анализ
- •2.3.6 Другие методы
- •Глава 3.Результаты исследования и их обсуждение
- •3.1. Кальпаин/кальпастатиновая система у крыс, подвергнутых индуцированной бета-амилоидом нейродегенерации на фоне эстрогенной терапии
- •3.2 Кальпаин/кальпастатиновая система у крыс, подвергнутых глутамат-индуцированной нейродегенерации на фоне терапии потенциальными нейропротекторами
- •Заключение
- •Список литературы
Глава 1. Обзор литературы
1.1.Кальпаин / кальпастатиновая протеолитическая система.
Кальпаин / кальпастатиновая протеолитическая система регулирует широкий спектр клеточных процессов. (Goll et al., 2003; Немова 2010). Она представлена во всех тканях млекопитающих основными формами Са2+-зависимых цистеиновых протеиназ – μ- и m-кальпаинами (КФ 3.4.22.52 и 3.4.22.53, соответственно) и их ингибитором – кальпастатином. (Goll et al., 2003; Nixon 2003) Эта высокочувствительная и эффективная система из трех основных компонентов (протеиназ, ингибитора и активатора – Са2+) связана взаимной регуляцией ее составляющих. Дисбаланс в этом протеолитическом союзе, наблюдаемый обычно при повышении уровня внутриклеточного Са2+, приводит к нерегулируемой деградации внутриклеточных структур и усилению кальпаинзависимых путей клеточной гибели, в результате чего развивается тканевая патология: чаще – дегенерация (в скелетных мышцах, сетчатке, тканях ЦНС), иногда – избыточная пролиферация (Carragher et al.,2006; Chakraborti et al., 2012) Определение абсолютного количества разных форм кальпаина и кальпастатина в тканях сопряжено с рядом методических трудностей (Goll et al, 2003); физиологическое соотношение μ- и m-кальпаинов в разных отделах ЦНС оценивается как 1:9, а количество кальпастатина достаточно для полного угнетения активности всего пула кальпаинов, поскольку в общих (неразделенных) тканевых экстрактах активность кальпаинов не выявляется (Goll et al, 2003; Nixon 2003).
Кальпастатин – высокоспецифичный белковый ингибитор μ- и m-кальпаинов – представлен в тканях рядом сплайс-вариантов. В составе комплекса с кальпастатином кальпаин утрачивает способность к примембранной транслокации, аутоактивации и проявлению каталитической активности. Молекулярный механизм взаимодействия кальпаинов и кальпастатина зависит от ионов кальция (Са2+) и к настоящему времени описан в деталях (Moldoveanu et al.,2008). Регуляция уровня кальпастатина в растворимой фракции клетки зависит от скоординированного действия cАМР-зависимой протеинкиназы А (PKA), способствующей образованию агрегатов кальпастатина и сокращению количества его молекул, доступных для взаимодействия с кальпаином, и протеинфосфатазы, индуцирующей освобождение молекул кальпастатина из агрегатов [9]. Кроме того, при длительном повышении активности кальпаинов кальпастатин подвергается кальпаинзависимой деградации, приводящей к еще более значительной активации фермента посредством положительной обратной связи. Вместе с тем, при истощении пула ингибитора стимулируется экспрессия его гена, CAST [9].
Другой внутриклеточный регулятор кальпаинов – ионизированный кальций; по чувствительности к нему различают μ- и m-формы фермента: оптимум для активации μ-кальпаина лежит в микромолярном, а m-кальпаина – в миллимолярном диапазоне Са2+ [10]. Механизм связывания Са2+ и Са2+-индуцируемой активации кальпаинов уже хорошо изучен [11]. Баланс внутриклеточного Са2+ строго регулируется системой Са2+-переносчиков в плазмалемме и мембранах органелл [12]. Однако, развитие тканевой патологии, включая нейродегенерацию, приводит к повышению уровня Са2+ и к ожидаемой активации кальпаинов [4, 7, 13-16]. Поскольку ряд белков-переносчиков Са2+ являются субстратами кальпаинов, в этих условиях происходит их избыточная деградация, еще более усиливающая проблему дисбаланса Са2+ и нерегулируемой активности кальпаинов. Так, при нейродегенерации наблюдается кальпаининдуцированная дисфункция Na+/Ca2+-обменника (NCX3) [17] и потенциалуправляемых Са2+-каналов L-типа [18].
Активация кальпаинов рассматривается как маркер развития нейродегенеративного процесса, естественного или индуцированного в эксперименте. Усиленный гидролиз αII-спектрина кальпаинами, приводящий к появлению двух уникальных фрагментов его расщепления (SBDP150 и SBDP145), является ранним событием в патологии нервной клетки. По образному выражению (Czogalla, Sikorski, 2005), в этом процессе спектрин является мишенью, а кальпаин – снайпером.
Основной формой кальпаинов в миелиновой оболочке является m-кальпаин. Кристаллические структуры m- кальпаинов крысы (Hosfield et al., 1999) и человека (Strobl et al.,2000) экспрессированных E. Coli (Hosfiend et al.,1999), были установлены методом рентгеноструктурного анализа (рисунок 1).
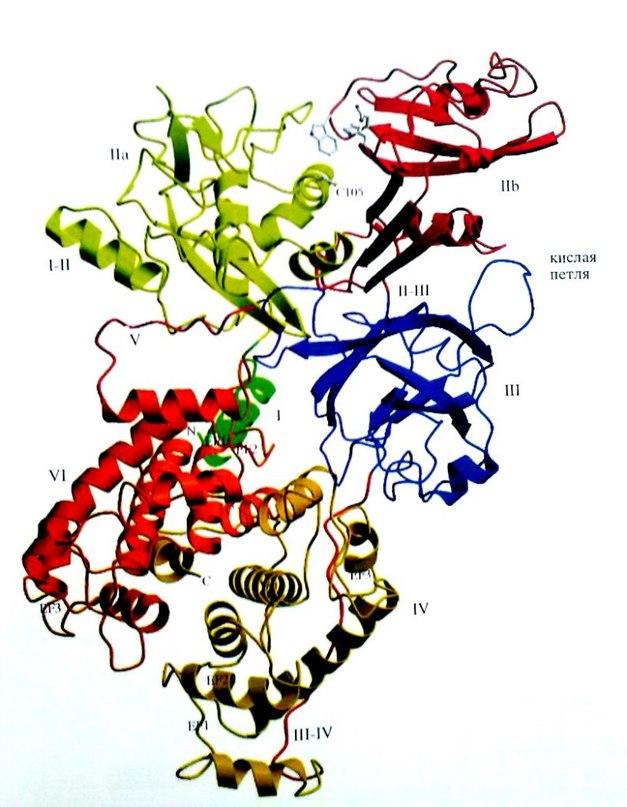
Рис.1 Кристаллическая структура m-кальпаина человека. Домены показаны разными цветами и помечены: I, IIa, IIb, III, IV, V и VI. I-II-α-спираль, связывающая домены I и IIa. Линкерный домен выделен красной линией III-IV, идущей от промежутка между доменами III и IV к правой части рисунка. Указано положение EF-1, EF-2 и EF-3 мотивов в доменах IV и VI. Cys - 105 активного центра, His-262, иTrp-288 на вершине домена IIb отмечены серым цветом (адаптировано из : Rever et. al., 2001a)
