
- •Лабораторная работа № 7 Обмен белков и нуклеиновых кислот
- •Лабораторная работа № 7 Свойства белков Цветные реакции на белки и аминокислоты.
- •Цветные реакции на белки Опыт 1. Биуретовая реакция.
- •Реакции осаждения белков
- •Опыт 5. Осаждение белков концентрированными минеральными кислотами.
- •Литература по теме:
Лабораторная работа № 7 Обмен белков и нуклеиновых кислот
Цель работы:
- изучить важнейшие свойства аминокислот и белков;
- познакомиться с составом и структурой белкового питания человека;
- изучить особенности переваривания и усвоения белков пищи;
- изучить внутриклеточный метаболизм аминокислот (синтез белка, мобилизация белка, окисление);
-провести реакции осаждения белка (в работе используют раствор овальбумина), применяя различные воздействия;
-освоить цветные реакции для качественного определения белков в биологических жидкостях, для определения присутствующих в них аминокислот или для анализа состава белков.
Белки – высокомолекулярные, азотсодержащие органические соединения, молекулы которых построены из 20 α – аминокислот. В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы).
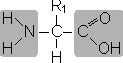
В зависимости от соотношения NH2 и COOH групп в молекуле аминокислоты различают моноаминомонокарбоновые, диаминомонокарбо-новые и моноаминодикарбоновые кислоты, например:
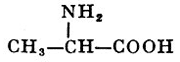

аланин(моноаминокарбоновая) аспарагиноваякислота(моноаминодикарбоновая)
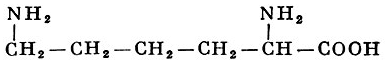
лизин (диаминомонокарбоновая)
Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
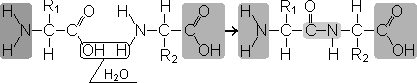
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называютС-концом).
Классификация белков по степени сложности
|
Простые (протеины) |
Сложные (протеиды) |
|
Состоят из остатков α – L - аминокислот, соединенных пептидными связями
|
Нуклеопротеиды (включают нуклеиновые кислоты) |
|
Липопротеиды (включают липиды) | |
|
Фософопротеиды (включают остатки фосфорной кислоты) | |
|
Гликопротеиды (включают остатки углеводов) |
Функции белков
|
Функция |
Примеры и пояснения |
|
Строительная |
Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
|
Транспортная |
Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
|
Регуляторная |
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
|
Защитная |
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
|
Двигательная |
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
|
Сигнальная |
В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
|
Запасающая |
В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
|
Энергетическая |
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
|
Каталитическая |
Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Со структурной точки зрения у белков различают четыре уровня организации или четыре структуры.
Первичная структура – определенная последовательность α, L -аминокислотных остатков, соединенных пептидными связями в полипептидной цепи. В составе белков обнаружено 20 остатков α, L - аминокислот различного строения. Для каждого индивидуального белка последовательность аминокислот в полипептидных цепях является уникальной. Она определяется генетически и, в свою очередь, определяет более высокие уровни организации данного белка. Замена только одного аминокислотного остатка в полипептидной цепи, состоящей из сотен аминокислот, может весьма существенно изменить свойства данного белка и даже полностью лишить его биологической активности.
Принцип построения белковых молекул обеспечивает неисчерпаемое многообразие белковых структур. Из двадцати различных аминокислот можно построить 20*20=400 дипептидов, т. е. димеров, содержащих два аминокислотных остатка, соединенных пептидной связью, 20*20*20=8000 трипептидов и т. д., а в общем случае 20N полипептидов, содержащих N аминокислотных остатков. Уже для сравнительно коротких белков длиной всего 100 аминокислотных остатков это составляет 20100-10130 различных последовательностей. Это, в частности, означает, что за всю историю существования жизни на Земле могла появиться и быть отобрана в процессе эволюции лишь ничтожная доля белковых молекул.
Следовательно, все разнообразие форм живой материи, основанное в первую очередь на многообразии белковых молекул, возникло в результате естественного отбора в пределах сравнительно небольшой, достаточно случайной выборки из неисчерпаемого множества белковых структур.
Вторичная структура – форма полипептидной цепи в пространстве, закрепленная множеством водородных связей между группами N-H и С=О.
Одна из моделей вторичной структуры – α-спираль, обусловленная внутримолекулярными водородными связями, другая модель – β-форма ("складчатый лист"), в которой преобладают межмолекулярные водородные связи.
Третичная структура – форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. Третичная структура белка отвечает определенной укладке спиралей и линейных участков полипептидной цепи в пространстве и зависит от взаимодействия полярных и неполярных заместителей в разных местах цепи, от образования ковалентных связей S-S между противоположными цистеиновыми остатками, эфирных мостиков, водородных связей. Возникают компактные глобулярные частицы и частицы, имеющие форму стержней. Молекулы белка различают по форме – глобулярные и фибриллярные.
Четвертичная структуре белка представляет собой ассоциацию нескольких полипептидных цепей (белковые комплексы), обладающих вторичной и третичной структурой и образованные за счет взаимодействия разных полипептидных цепей.
Фибриллярные белки состоят из вытянутых или свернутых в спиральполипептидных цепей, расположенных параллельно. Полипептидные цепи объединены в волокна (фибриллы). Такие белки не растворимы в воде. Из них построены, например, волосы, ногти, перья (кератины), сухожилия (коллаген), связки (эластин), шелк, паутина (фиброин).
Различия между глобулярной и фибриллярной структурой белков, так и между их свойствами очевидны. Однако следует отметить, что большинство белков имеют глобулярную форму (ферменты, гормоны, антитела, запасные белки).
Среди биологических процессов, лежащих в основе жизнедеятельности, обмен белков занимает центральное положение, так как само явление жизни представляет собой способ существования белковых тел, которые непрерывно самообновляются за счет веществ, поступающих из внешней среды. На долю белков в пищевом рационе приходится 15-20%, что составляет примерно 90-100 г в сутки, или 1,0-1,5 г\кг веса. Источниками белка для нас являются продукты животного (мясо, рыба, яйцо, молоко и продукты из него приготовленные) и растительного (бобовые, зерновые злаки) происхождения. Наиболее выгодное их соотношение в рационе 1:1.
Белки, поступающие с пищей, отличаются друг от друга аминокислотным составом и питательной ценностью. Белки животного происхождения, как правило, содержат все незаменимые аминокислоты, достаточно полно перевариваются и усваиваются (их называют полноценные), а белки растительного происхождения (их называют неполноценные) часто не содержат 1-2 из незаменимых аминокислот и хуже перевариваются, так как оболочки их клеток не гидролизуются пищеварительными ферментами.
Незаменимыми аминокислотами для взрослых людей являются: валин, гистидин, лизин, лейцин, изолейцин, метионин, треонин, триптофан, фенилаланин. Суточная потребность в них составляет от 0,5 до 2,0 г.
Необходимые для обеспечения процессов жизнедеятельности белки поступают в организм с пищей. Расщепление белков начинается в желудке под действием фермента пепсина. Соляная кислота, содержащаяся в желудочном соке, создает оптимальные условия среды для пепсина (рН 1,5-2,5) и вызывает набухание белков. Под действием пепсина молекулы белков расщепляются на фрагменты, которые называются высокомолекулярные пептиды. Последние поступают в тонкий кишечник, где их дальнейшее переваривание происходит в слабощелочной среде рН – 7,8-8,0 под действием ферментов сока поджелудочной железы и кишечных соков (трипсин, химотрипсин, пептидазы). При этом высокомолекулярные пептиды превращаются в низкомолекулярные пептиды, а затем в свободные аминокислоты.
Аминокислоты и некоторое количество низкомолекулярных пептидов всасываются кишечными ворсинками по типу активного транспорта, то есть с затратами энергии. Некоторое количество всосавшихся аминокислот уже в клетках кишечной стенки включается в синтез специфических белков, большая же их часть поступает в кровь (~ 95%) и в лимфу. Кровь приносит аминокислоты в печень, где идет активный синтез белка. Аминокислоты, не использованные в печени, поступают в большой круг кровообращения.
Часть аминокислот и непереваренные белки поступают в толстый кишечник, где под действием кишечных бактерий подвергаются гниению. В результате из ряда аминокислот образуются ядовитые продукты: амины, фенолы, меркаптаны, которые частично выводятся из организма с калом и кишечными газами, а частично всасываются в кровь, переносятся ею в печень и там обезвреживаются, превращаясь в эфиры серной и глюкуроновой кислот. В таком виде они выводятся с мочой. Обезвреживание ядовитых продуктов, образующихся при гниении белков, происходит, в основном, в печени и требует затрат энергии.
Ежесуточно в кровь взрослого человека поступает около 300 г различных аминокислот, в том числе из кишечника примерно 100 г, в результате распада белков тканей около 200 г. Определенная часть аминокислот может быть синтезирована в организме из веществ небелкового происхождения. Непосредственными предшественниками для синтеза аминокислот являются α – кетокислоты. Одна из них – пировиноградная кислота, образуется при распаде углеводов или глицерина липидов, такие кетокислоты, как щавелевоуксусная и α–кетоглутаровая являются промежуточными продуктами цикла трикарбоновых кислот. Они могут преобразовываться в аминокислоты путем восстановительного аминирования или переаминирования. Аминокислоты, полученные в организме из соединений других классов, образуют фонд заменимых аминокислот. Источником незаменимых аминокислот служат только продукты питания.
Аминокислоты, циркулирующие в крови, составляют фонд свободных аминокислот и используются для синтеза и обновления белков тканей, синтеза ферментов, ряда гормонов и других активных веществ или же включаются в процессы окисления с образованием конечных продуктов и энергии.
Большая часть свободных аминокислот используется для синтеза белков. Это энергозатратный процесс, который происходит при обязательном участии нуклеиновых кислот. Ферментативные реакции биосинтеза белка можно разделить на три этапа:
Первый – транскрипция (переписывание). Это перенос информации о структуре необходимого в организме белка с гена, находящегося на молекуле ДНК в ядре клетки, на информационную РНК (иРНК).
Второй – рекогниция (распознавание). Суть этого этапа состоит в доставке транспортными РНК (тРНК) соответствующих аминокислот к месту контакта иРНК с рибосомой.
Третий – трансляция (сборка белковой молекулы). Движение рибосомы по иРНК совместно с работой тРНК способствует образованию полипептидной цепочки – первичной структуре молекулы будущего белка.
Все реакции биосинтеза белка происходят на основе принципа комплементарности.
Для построения веществ, обладающих биологической активностью, организм использует реакцию окислительного декарбоксилирования. При этом аминокислота теряет карбоксильную группу и превращается в соответствующий амин, некоторые из них обладают биологически активным действием. Например, из глютаминовой кислоты образуется γ- аминомасляная кислота, играющая важную роль в процессах торможения в центральной нервной системе; при декарбоксилировании гистидина образуется гистамин, который вызывает расширение просвета кровеносных сосудов и падение артериального давления, а также усиливает секрецию пищеварительных желез.
Организм человека не располагает резервными белками. Однако в особых условиях (при голодании, длительной мышечной работе умеренной мощности) наблюдается вовлечение белков в энергетический обмен (мобилизация). Белки клеток различных тканей под воздействием ферментов лизосом гидролизуются до аминокислот. Далее аминокислоты вовлекаются в реакцию окислительного дезаминирования, превращаясь при этом в углекислый газ, воду, аммиак и 18-20 АТФ. При окислении 1 г белка организм получает примерно 4 ккал (~ 17 кДж), а при окислении всех аминокислот, входящих в состав белковой молекулы более 1500 АТФ.
Образовавшийся аммиак даже в небольших концентрациях ядовит для живых клеток, особенно для клеток центральной нервной системы. Поэтому в организме существуют несколько механизмов связывания аммиака. Одни из них служат для временного связывания и транспорта аммиака из одного органа в другой, другие – для образования конечных продуктов, которые выводятся из организма.
Временное связывание аммиака происходит в реакции образования амидов аспарагиновой и глутаминовой кислот – аспарагина и глутамина. Эти реакции идут с затратой АТФ.
В некоторых белках аспарагиновая и глутаминовая кислоты используют на образование пептидной связи только одну карбоксильную группу, а вторая остается свободной. Поэтому способностью связывать аммиак обладают и белки, особенно мышечные, содержащие большое количество глутаминовой кислоты. Далее аспарагин, и особенно глутамин, транспортируют аммиак из различных тканей в печень, где он обезвреживается путем синтеза мочевины, которая в физиологических концентрациях безвредна для организма. В норме в организме взрослого человека синтезируется 25-35 г мочевины в сутки.
Синтез мочевины – многоэтапный ферментативный процесс, осуществляемый с затратой энергии АТФ, поэтому наиболее интенсивно он идет в восстановительном периоде. Мочевина выделяется из клеток печени в кровь, переносится в почки и выделяется из организма с мочой. Мочевина является специфическим продуктом обмена белков, поэтому об интенсивности распада белков в организме судят по уровню мочевины в крови. Этот показатель, определяемый утром натощак, широко используется в биохимическом контроле для оценки восстановления организма спортсменов.
Контрольные вопросы.
1. Нормы потребления белка и структура белкового питания.
2. Что такое незаменимые аминокислоты?
3. Какова роль соляной кислоты желудочного сока в переваривании белков?
4. Под влиянием каких ферментов пищеварительного тракта и через какие промежуточные продукты протекает последовательный распад белков до аминокислот?
5. Участие аминокислот в пластическом обмене (синтез белков, реакции переаминирования и декарбоксилирования).
6. Участие белков в энергетическом обмене (мобилизация, реакция окислительного дезаминирования аминокислот).
7. Конечный продукт обмена белков (где образуется, как устраняется из организма?).
