
- •Ответы к экзамену
- •Структура и функции белков Вопрос №4
- •Вопрос №5
- •Вопрос №6
- •Вопрос №7
- •Вопрос №8
- •1. Методы разрушения тканей и экстракции белков:
- •Вопрос №9
- •Вопрос №10
- •Вопрос №13
- •Ферменты Вопрос №17
- •Название ферментов
- •Вопрос №27
- •Вопрос №18
- •Вопрос №21
- •Вопрос №19
- •Вопрос №20
- •Вопрос №22
- •В основе всех 4 типов регуляции лежит изменение конформации ферментов.
- •Вопрос №26
- •Вопрос №23
- •Кинетика ферментативных реакций
- •Вопрос №24
- •Вопрос №25
- •Уравнение Лайнуивера—Бэрка
- •Вопрос №28
- •Нуклеиновые кислоты и нуклеотиды Вопрос №29
- •Вопрос №30
- •Вопрос №31
- •Вопрос №32
- •Вопрос №33
- •Вопрос №34
- •Вопрос №35
- •Транскрипция
- •Трансляция
- •Посттрансляционные модификации
- •Вопрос №36
- •Вопрос №37
- •Общий путь катаболизма Вопрос №38
- •Вопрос №39
- •Вопрос №40
- •Вопрос №41
- •Вопрос № 42
- •Вопрос № 43
- •Вопрос №44
- •Вопрос №45
- •Вопрос №46
- •Вопрос №47
- •Обмен углеводов Вопрос №48
- •I стадия – переваривание (в жкт)
- •Глюкоза → Глюкоза-6ф
- •Вопрос №51
- •Вопрос №52
- •Вопрос №54
- •Гликолиз
- •Вопрос №55
- •Вопрос №56
- •Вопрос №61
- •Вопрос №57
- •Вопрос №58
- •Вопрос №63
- •Вопрос №59
- •Пентозофосфатный путь (пфп)
- •Вопрос №60
- •Вопрос №62
- •Глюконеогенез (гнг)
- •Обмен белков Вопрос № 67
- •Вопрос №68
- •Вопрос №71
- •Вопрос №72
- •Вопрос №73
- •Вопрос №74
- •Вопрос №75
- •Вопрос №77
- •Вопрос №78
- •Вопрос №79
- •Вопрос №80
- •Обмен липидов Вопрос №81
- •Вопрос №82
- •Вопрос №87
- •Вопрос №88
- •Вопрос №89
- •Вопрос №90.
- •Вопрос №92
- •Вопрос №94
- •Вопрос №97
- •Вопрос № 98
- •Вопрос №100
- •Обмен нуклеотидов Вопрос №102
- •Вопрос №103
- •Вопрос №104
- •Вопрос №105
- •Вопрос №106
- •Витамины
- •Вопрос №125
- •Общие принципы регуляции метаболических процессов в организме человека Вопрос №128
- •I. По химической структуре:
- •II. По влиянию на организм:
- •III. По механизму действия:
- •Вопрос №129
- •Гормоны белково-пептидной природы
- •Стероидные гормоны
- •Тиреоидные гормоны
- •Вопрос №130
- •Вопрос №131
- •Вопрос №132
- •Вопрос №133
- •Вопрос №134
- •Вопрос №135
- •Вопрос №136
- •Вопрос №137
- •Вопрос №138
- •Вопрос №139
- •Вопрос №140
- •Вопрос №141
- •Вопрос №142
- •Аденилатциклазный механизм
- •Механизм действия гормонов через рецепторы, обладающие ферментативной активностью
- •Вопрос №143.
- •Вопрос №144
- •Механизм действия через липиды мембран
- •Биохимия органов и тканей Вопрос №145
- •Вопрос №147
- •Вопрос №148
- •1. Первичный гемостаз
- •3. Фибринолиз
- •Вопрос №149
- •Вопрос №150
- •Вопрос №151
- •Вопрос №152
- •Вопрос №153
- •Желтуха
- •2. Печеночная
- •3. Подпеченочная
- •4. Физиологическая желтуха новорожденных
- •Вопрос №154
- •1 Стадия обезвреживания: гидрофобное → гидрофильное
- •2 Стадия: конъюгация
- •Вопрос №159
- •Вопрос №160
- •Вопрос №161
- •Вопрос №162
- •Вопрос №163
- •1) Синтез препро-α-цепей
- •2) Внутриклеточные модификации
- •3) Секреция
- •4) Внеклеточные модификации
- •Вопрос №167.
- •Вопрос №169
Вопрос №77
Специфический обмен аминокислот: глицина, серина. Роль Н4-фолата и его производных
в обмене аминокислот и нуклеотидов.
Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты.
Г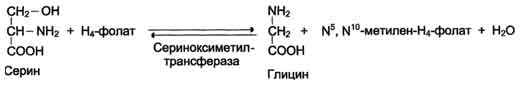 лицин
- также заменимая аминокислота, основным
источником которой служит серии. Реакцию
синтеза глицина из серина катализирует
фермент серин-оксиметилтрансфераза,
кофермен-том которой является Н4-фолат.
лицин
- также заменимая аминокислота, основным
источником которой служит серии. Реакцию
синтеза глицина из серина катализирует
фермент серин-оксиметилтрансфераза,
кофермен-том которой является Н4-фолат.
Р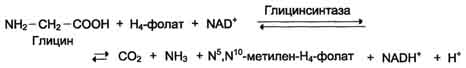 еакция
превращения серина в глицин легко
обратима. Основной путь катаболизма
глицина у человека и других позвоночных
также связан с использованием Н4-фолата.
еакция
превращения серина в глицин легко
обратима. Основной путь катаболизма
глицина у человека и других позвоночных
также связан с использованием Н4-фолата.
Эта реакция обратима и катализируется глицинсинтазой - ферментным комплексом, похожим на пируватдегидрогеназный комплекс, и локализованным в митохондриях клеток печени. По последним данным глицинрасщепляющая ферментная система несколько отличается от глицинсинтазы и содержит 4 белка: Р-белок, включающий кофермент ПФ, Н-белок, содержащий липоевую кислоту, Т-белок с коферментом Н4-фолат, L-белок, являющийся дигидролипоилдегидрогеназой с коферментом NAD+.
1. Пути метаболизма
серина и глицина. О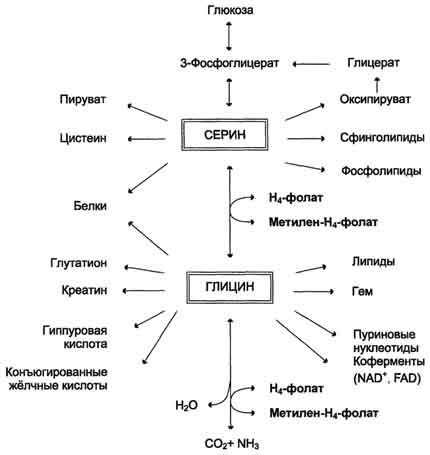 бе
аминокислоты необходимы не только для
синтеза белков и глюкозы (при её недостатке
в клетках), но и нукле-отидов, коферментов,
тема, сложных липидов, креатина и других
соединений. Многие из этих реакций
представлены в соответствующих разделах
учебника.
бе
аминокислоты необходимы не только для
синтеза белков и глюкозы (при её недостатке
в клетках), но и нукле-отидов, коферментов,
тема, сложных липидов, креатина и других
соединений. Многие из этих реакций
представлены в соответствующих разделах
учебника.
Роль фолиевой кислоты в обмене
В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Этот витамин широко распространён в животных и растительных пищевых продуктах. Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот.
Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат).
Ф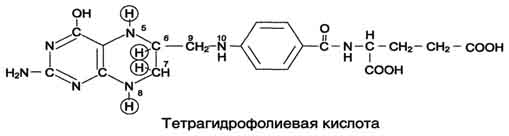 олиевая
кислота в печени превращается в Н4-фолат
в несколько стадий с участием ферментов
фолатредуктазы и дигидрофолатредуктазы,
коферментом которых служит NADPH.
олиевая
кислота в печени превращается в Н4-фолат
в несколько стадий с участием ферментов
фолатредуктазы и дигидрофолатредуктазы,
коферментом которых служит NADPH.
Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат
Дефицита фолиевой - мегалобластная анемия-уменьшением количества эритроцитов, снижением гемоглобина, увеличение размера эритроцитов. Причина - нарушение синтеза ДНК и РНК из-за недостатка предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата.
Вопрос №78
Основные пути превращения метионина в организме;
значение реакций трансметилирования. Синтез креатина.
М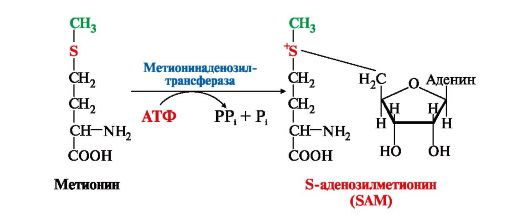 етионин
- незаменимая аминокислота, необходимая
для синтеза белков. Мет-тРНКмет участвует
в инициации процесса трансляции каждого
белка. Как и многие другие аминокислоты,
метионин подвергается транс- и
дезаминированию. Особая роль метионина
заключается в том, что метильная группа
этой аминокислоты используется для
синтеза целого ряда соединений в реакциях
трансметилирования. Основным донором
метильной группы является S-аденозилметионин
(SAM) - активная форма метионина, который
присутствует во всех типах клеток и
синтезируется из метионина и АТФ под
действием фермента метионин-аденозилтрансферазы.
етионин
- незаменимая аминокислота, необходимая
для синтеза белков. Мет-тРНКмет участвует
в инициации процесса трансляции каждого
белка. Как и многие другие аминокислоты,
метионин подвергается транс- и
дезаминированию. Особая роль метионина
заключается в том, что метильная группа
этой аминокислоты используется для
синтеза целого ряда соединений в реакциях
трансметилирования. Основным донором
метильной группы является S-аденозилметионин
(SAM) - активная форма метионина, который
присутствует во всех типах клеток и
синтезируется из метионина и АТФ под
действием фермента метионин-аденозилтрансферазы.
Структура -S+-CH3 в SAM является нестабильной, метильная группа легко отщепляется, что определяет высокую способность ее к переносу на другие соединения в реакциях трансметилирования.
В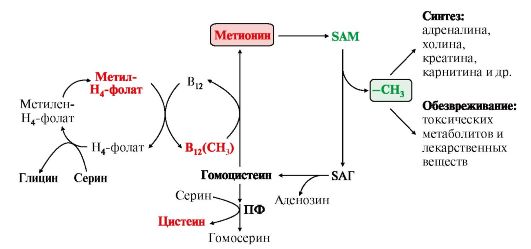 реакциях трансметилирования SAM
превращается в S-аденозилгомо- цистеин
(SAr), который гидролитически расщепляется
с образованием аденозина и гомоцистеина.
Последний может снова превращаться в
метионин с участием метил-Н4-фолата и
витамина В12. Регенерация метионина
тесно связана с обменом серина и глицина
и взаимопревращениями производных
Н4-фолата.
реакциях трансметилирования SAM
превращается в S-аденозилгомо- цистеин
(SAr), который гидролитически расщепляется
с образованием аденозина и гомоцистеина.
Последний может снова превращаться в
метионин с участием метил-Н4-фолата и
витамина В12. Регенерация метионина
тесно связана с обменом серина и глицина
и взаимопревращениями производных
Н4-фолата.
Метионин и серин необходимы для синтеза условно заменимой аминокислоты цистеина, причем в этом процессе метионин является донором атома серы. Цистеин образуется непосредственно из гомоцистеина в ходе двух реакций, которые происходят с участием пиридоксальфосфата. Генетический дефект этих ферментов приводит к нарушению использования гомоцистеина в организме и превращению его в гомоцистин, который может накапливаться в крови и тканях, выделяться с мочой, вызывая гомоцистинурию. Заболевание сопровождается эктопией хрусталика глаза, катарактой, остеопорозом, умственной отсталостью.
С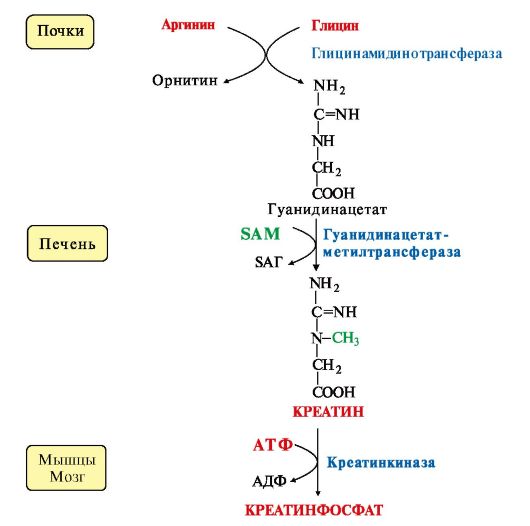 интез
креатина
происходит с использованием трех
аминокислот: аргинина, глицина и
метионина. Процесс начинается в почках,
в реакцию вступают аргинин и глицин.
Образующийся гуанидинацетат поступает
в печень, где подвергается метилированию
с участием SAM и превращается в креатин.
Из печени креатин транспортируется в
мышцы и головной мозг. Креатин в клетках
превращается в креатинфосфат -
макроэргическое соединение, являющееся
резервной формой энергии в мышечной и
нервной тканях. Содержание креатинфосфата
в покоящейся мышце в восемь раз выше,
чем АТФ. Эту реакцию катализирует фермент
креатинкиназа.
интез
креатина
происходит с использованием трех
аминокислот: аргинина, глицина и
метионина. Процесс начинается в почках,
в реакцию вступают аргинин и глицин.
Образующийся гуанидинацетат поступает
в печень, где подвергается метилированию
с участием SAM и превращается в креатин.
Из печени креатин транспортируется в
мышцы и головной мозг. Креатин в клетках
превращается в креатинфосфат -
макроэргическое соединение, являющееся
резервной формой энергии в мышечной и
нервной тканях. Содержание креатинфосфата
в покоящейся мышце в восемь раз выше,
чем АТФ. Эту реакцию катализирует фермент
креатинкиназа.
Креатинфосфат играет важную роль в обеспечении работающей мышцы энергией в начальный период физической работы. В работающей мышце концентрация АТФ некоторое время остается постоянной, а концентрация креатинфосфата быстро снижается. Часть образовавшегося креатина и креатинфосфата с постоянной скоростью превращается в креатинин, который выводится с мочой (норма - 1-2 г/сут, или 8,8-17,6 ммоль/л). При уменьшении массы мышц вследствие длительного отрицательного азотистого баланса, при состояниях, ведущих к атрофии мышц, выделение креатинина снижается (голодание, острые инфекции, сахарный диабет, гипертиреоз).
