
- •Методические указания
- •Содержание
- •Введение
- •Этапы синтеза органического соединения
- •Выбор пути синтеза
- •Расчет количеств исходных продуктов
- •50 См3 95%-го этилового спирта;
- •51,2 Г калий бромида;
- •57,1 См3 98%-й серной кислоты.
- •53,0 См 3 95%-ного этилового спирта,
- •54,6 Г бромистого калия,
- •59,2 См 3 98%-ной серной кислоты.
- •Выделение и очистка целевого продукта. Контроль чистоты
- •Подтверждение состава и строения полученного органического соединения
- •Структура и содержание отчета
- •Титульный лист
- •Введение
- •Общие методы получения органических соединений данного класса
- •2.4. Синтез заданного органического соединения
- •Синтезы органических соединений
- •Галогенирование
- •Синтез бромистого этила
- •Синтез бромистого бутила
- •Нитрование
- •Синтез 1-нитронафталина
- •Синтез 3-нитрофталевой кислоты
- •Окисление
- •Синтез бензойной кислоты
- •Синтез ацетона
- •Алкилирование спиртов и аминов
- •Синтез дибутилового эфира
- •Синтез диэтиланилина
- •Ацилирование
- •Синтез уксусноэтилового эфира
- •Синтез уксусноизоамилового эфира.
- •Присоединение по карбонильной группе
- •Синтез 2-метилбутанола-2
- •Синтез этилмагнийбромида
- •Синтез 2-метилбутанола-2
- •Диазотирование, азосочетание.
- •Синтез2-нафтолоранжевого красителя
- •Диазотирование
- •Азосочетание
- •Ледяное крашение
- •Синтез метилоранжа (гелиантина)
- •Получение мыла
- •Углеводы
- •Синтез1,2,3,4,6--пентаацетилглюкопиранозида
- •Синтез фурфурола
- •Список литературы
- •Приложение а
- •Синтез бромистого этила Лабораторная работа № 1
- •Приложение б
- •Приложение в
50 См3 95%-го этилового спирта;
51,2 Г калий бромида;
57,1 См3 98%-й серной кислоты.
Из уравнения реакции следует, что из 0,43 моль бромида калия (продукт, взятый в недостатке) получается 0,43 моль бромистого этила. Поэтому теоретический выход бромистого этила:
0,43109 = 46,9 г.
Ожидаемый выход бромистого этила можно рассчитать по пропорции, учитывая, что по этой методике (с. 18 этих методических указаний) из 30 г бромистого калия образуется 22 г бромистого этила:
30 22
51,2 Х
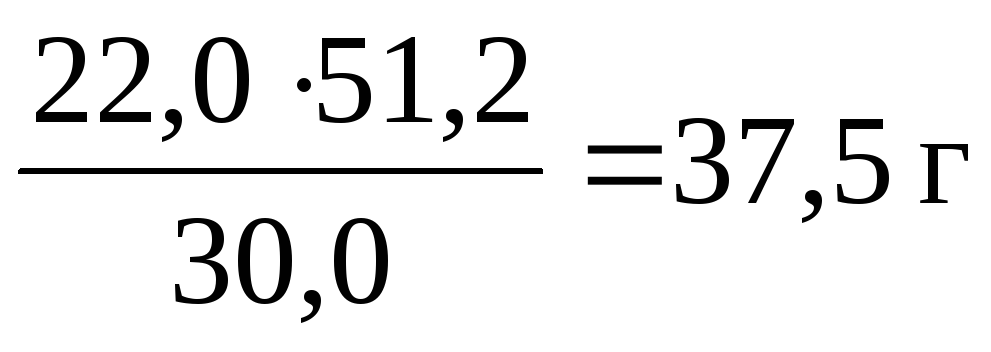
![]()
Обратный расчет.
Задание:получить 40 г бромистого этила.
В соответствии с методикой синтеза, приводимой на с. 16, аналогично тому, как это делалось в прямом расчете (см. с. 5), находится мольное соотношение реагирующих веществ.
Мольное соотношение реагентов:
С2Н5ОН :KBr: Н2SО4 = 0,48 : 0,25 : 0,61.
Далее делим все три числа на 0,25 – число молей калий бромида, который в недостатке, и получаем новое мольное соотношение: 1,92 : 1,00 : 2,36.
По методике 22 г бромистого этила получают, исходя из 30 г калий бромида, 40 г – х
![]()
![]()
где 119 - мольная масса калий бромида.
Если ожидаемый выход по методике указывается в процентах от теоретического (в данной методике выход бромистого этила составляет 80% от теоретического), то находится теоретический выход целевого продукта в граммах:
![]()
![]()
где 109 - мольная масса этила бромистого, г/моль.
Число моль исходного продукта, который берется в недостатке, в данном случае это бромистый калий, также равно 0,46 моль, что составляет 0,46 119 = 54,6 г КВr.
Используя мольное соотношение реагентов, находим количество этилового спирта и серной кислоты.
Число моль этилового спирта:
0,46 1,92 = 0,88 моль, что составляет 0,88 46 = 40,5 г 100 %-го спирта,
![]()
![]()
где 46 г – молярная масса, 0,804 – относительная плотность этилового спирта, г/см3.
Число моль серной кислоты:
0,46 2,36 = 1,09 моль, что составляет 1,09 98 = 106,4 г 100%-й серной кислоты или
![]()
![]()
где 98 г – молярная масса, а 1,84 – относительная плотность 98% кислоты, г/см3.
Таким образом, для получения 40 г бромистого этила необходимо в синтез ввести:
53,0 См 3 95%-ного этилового спирта,
54,6 Г бромистого калия,
59,2 См 3 98%-ной серной кислоты.
Выделение и очистка целевого продукта. Контроль чистоты
В результате экспериментального проведения реакций обычно получается смесь, в состав которой помимо основного вещества могут входить растворители и некоторые количества исходных реагентов и продуктов промежуточных и побочных реакций. Поэтому очередной операцией в синтезе является выделение и очистка целевого соединения. Методы ее осуществления зависят от физических и химических свойств разделяемых веществ. В стандартных синтезах очистка обычно описывается в прописях. Очень часто для разделения органических веществ используются химические методы, которые в результате селективного проведения реакций с отдельными компонентами смеси дают возможность перевести их в соединения, легко удаляемые из реакционной массы. Примером может служить извлечение из органических смесей малорастворимых в воде кислот и оснований с переводом их в водорастворимые соли. Вещества, находящиеся в осадке, обычно отделяют от маточного раствора фильтрованием или центрифугированием. Смеси твердых веществ разделяются кристаллизацией или возгонкой. Различные виды перегонок (простая перегонка, перегонка в вакууме, перегонка с водяным паром, экстрактивная и азеотропная перегонки, ректификация и др.) дают возможность разделять смеси жидких, а иногда и твердых веществ. Различия в растворимости органических соединений используются при выделении и очистке их экстрагированием. Иногда для получения чистых веществ применяют хроматографию (тонкослойную, бумажную, колоночную) и некоторые другие физико-химические методы.
Для удаления остатков воды, которая часто используется как растворитель в синтезе и при разделении и очистке веществ, твердые вещества сушат на воздухе или под вакуумом, в сушильных шкафах при повышенной температуре, в эксикаторах с поглощающими влагу веществами. Широко распространены методы сушки жидкостей при помощи осушающих веществ, связывающих воду. Сушка газов проводится вымораживанием влаги или пропусканием их через слой осушающего агента.
Наиболее простым и удобным способом контроля наличия примесей в полученном соединении является сопоставление его физических констант (температур кипения и плавления, показателя преломления и др.) с их справочными значениями. В случае отсутствия справочных данных о чистоте продукта можно судить по достижению неизменных значений физических констант в процессе многократно повторяемых циклов очистки. Чистота вещества проверяется также спектральными и хроматографическими методами, с помощью химического анализа. При проведении органических синтезов часто бывает достаточным достижение 97-99% чистоты целевого продукта.
