
- •Строение атомов. Современная формулировка Периодического закона.
- •Квантово-механическое описание состояния электрона в атоме
- •Электрон имеет двойственную природу. Он обладает свойствами и частицы, и волны одновременно.
- •Положение электрона в атоме неопределенно.
- •Формирование электронной оболочки атома.
- •3.1 Формирование электронной оболочки атома
- •Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
- •Электронные конфигурации атомов и Периодическая система.
-
Электронные конфигурации атомов и Периодическая система.
Электронная конфигурация атома – это распределение всех электронов атомов по уровням, подуровням и орбиталям.
Существуют 2 способа описания электронной конфигурации:
1 – электронные формулы,
2– электроно-графические конфигурации.
Для атома характерно основное состояние (с минимумом энергии) или состояние покоя и возбужденное.
Элементы первого периода (H, He)
Порядковый номер элемента в периодической таблице равен заряду ядра атома Z, а следовательно, и общему числу электронов в атоме.
Наиболее устойчивое (невозбуждённое) состояние электрона в атоме соответствует минимально возможному значению энергии данного электрона.
Любое другое состояние является возбуждённым; из него электрон самопроизвольно переходит в состояние с более низкой энергией.
В невозбуждённом атоме водорода (Z = 1) единственный электрон находится на самом низком из возможных энергетических уровней: n = 1. В этом случае орбитальное квантовое число может принимать только одно значение l = 0. Следовательно, первый энергетический уровень образован единственной s-орбиталью, на которой и находится электрон.
Э![]() лектронно-графическая
схема атома водорода:
лектронно-графическая
схема атома водорода:
Электронная формула атома водорода: 1s1.
В атоме гелия (Z = 2) второй электрон также находится на 1s орбитали. Электронная формула атома гелия: 1s2.
Электронно-графическая схема атома гелия:
Э![]() лементы
второго периода (Li – Ne)
лементы
второго периода (Li – Ne)
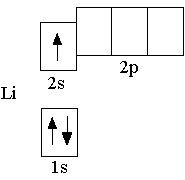
У следующего за гелием элемента – лития (Z = 3) – третий электрон уже не может разместиться на первом энергетическом уровне, так как на одной орбитали не может находиться более двух электронов. Поэтому третий электрон должен располагаться на втором энергетическом уровне n = 2 .
При n = 2 орбитальное квантовое число может принимать два значения: l = 0; 1. Таким образом, второй энергетический уровень образован орбиталями двух типов: одной s-орбиталью и тремя p-орбиталями.
Заполнение орбиталей электронами происходит таким образом, что сначала заполняется более низкая по энергии орбиталь. Поэтому третий электрон в невозбужденном атоме лития располагается на 2s-орбитали, так как 2s-орбиталь имеет более низкую энергию, чем 2p-орбиталь. Полная электронная формула атома лития: 1s22s1. Ниже показана полная электронно-графическая схема невозбуждённого атома лития:
Сокращённая электронная формула атома лития: 2s1.
Ниже показана сокращённая электронно-графическая схема атома лития.
|
2s1.
|
Иногда, чтобы подчеркнуть наличие в атоме не заполненных электронами орбиталей, сокращённую электронную формулу записывают так: Li 2s12p0.
Сокращённая электронно-графическая схема и сокращённая электронная формула следующего за литием атома бериллия (Z = 4) выглядят следующим образом:
Be
2s2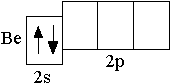
Элементы, в атомах которых электронами заполняются s-орбитали, называются s-элементами (т.е. H, He, Li, Be – это s-элементы). Следует отметить, что все s-элементы, за исключением водорода и гелия, являются металлами.
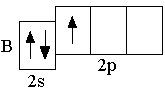
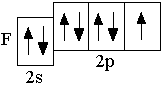
Следующие за бериллием элементы второго периода – бор, углерод, азот, кислород, фтор, неон – являются p-элементами: у них заполняются электронами p-орбитали. Ниже представлены сокращённые электронно-графические схемы и сокращённые электронные формулы этих элементов.
|
B 2s22p1
|
C 2s22p2
|
|
F 2s22p5
|
N
|
Элементы III периода (Na – Ar)
Электронная конфигурация внешнего энергетического уровня невозбуждённых атомов элементов III периода такая же, как и у элементов соответствующих групп II периода. Различие состоит лишь в том, что у элементов III периода заполняются орбитали третьего энергетического уровня (n = 3). В этом случае орбитальное квантовое число l может принимать три значения: 0; 1; 2. Следовательно, третий энергетический уровень образован орбиталями трёх типов: одной s-орбиталью, тремя p-орбиталями, пятью d-орбиталями.
Элемент второго периода: Элемент третьего периода:


Таким образом, номер периода, в котором находится элемент, равен главному квантовому числу, которое характеризует электроны внешнего энергетического уровня.
У атомов всех элементов III периода, находящихся в невозбуждённом состоянии, 3d-орбитали являются вакантными (т.е. незаполненными электронами). При возбуждении атома, которое происходит в результате передачи атому извне дополнительной энергии, спаренные электроны, находящиеся на 3p-подуровне (а также на 3s-подуровне), могут расспариваться и переходить на более высокий по энергии 3d-подуровень.
н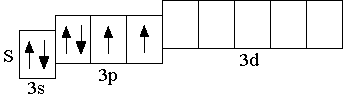 евозбуждённое
евозбуждённое
состояние
возбуждённое
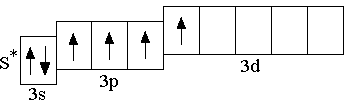 состояние
состояние
возбуждённое
состояние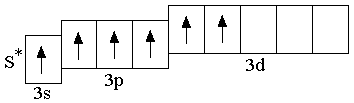
Таким образом, расположение элементов в периодической системе соответствует электронному строению их атомов, а электронное строение атомов определяется зарядом их ядер. Поэтому современная формулировка Периодического закона – это свойства элементов и образуемых ими простых веществ и химических соединений находятся в периодической зависимости от зарядов ядер атомов;


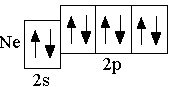 e
2s22p6
e
2s22p6