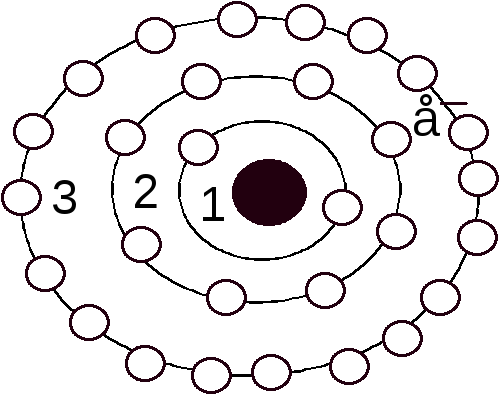
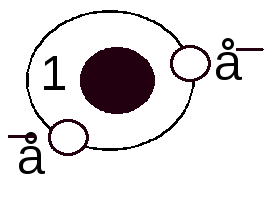- •Строение атомов. Современная формулировка Периодического закона.
- •Квантово-механическое описание состояния электрона в атоме
- •Электрон имеет двойственную природу. Он обладает свойствами и частицы, и волны одновременно.
- •Положение электрона в атоме неопределенно.
- •Формирование электронной оболочки атома.
- •3.1 Формирование электронной оболочки атома
- •Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
- •Электронные конфигурации атомов и Периодическая система.
-
Формирование электронной оболочки атома.
3.1 Формирование электронной оболочки атома
Таблица 2- Формирование электронной оболочки атома
|
Энергетический уровень, n |
Энергетический подуровень, l |
Орбиталь, n, l, ml |
К-во электронов на уровне |
|
n=1
|
l=0, (S) |
1S (1 орбит.) |
2 электр. |
|
n=2
|
l=0, (S) l=1, (p) |
2S (1 орбит.) 2p (3 орбит.) |
2 электр.+ 6 электр.= 8 электр. |
|
n=3
|
l=0, (S) l=1, (p) l=2 (d) |
3S (1 орбит.) 3p (2 орбит.) 3d (5 орбит.) |
2 электр.+ 6 электр.+ 10 электр.= 18 электр. |
|
n=4
|
l=0, (S) l=1, (p) l=2 (d) l=3 (f) |
4S (1 орбит.) 4p (2 орбит.) 4d (5 орбит.) 4f (7 орбит.) |
2 электр.+ 6 электр.+ 10 электр.+ 14 электр.= 32 электр. |
На 5,6,7 энергетических уровнях также, как и на 4 может располагаться 32 электрона (5S, 5p, 5d, 5f)
-
Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
Заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атома определяется следующими закономерностями:
I – Принцип минимума энергии: в устойчивом состоянии электроны находятся на наиболее низких энергетических уровнях и подуровнях.
Это означает, что каждый новый электрон попадает в атоме на самый низкий (по энергии) свободный подуровень. Для многоэлектронного атома энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2 s < 2р < З s < Зр < 4 s < 3d < 4р < 5 s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p .
II – Правило Клечковского (правило n+l).
Последовательность заполнения атомных орбиталей в зависимости от значений главного и орбитального квантовых чисел определяется правилами Клечковского:
-
при увеличении заряда ядра атома последовательное заполнение электронами атомных орбиталей происходит от орбиталей с меньшей величиной суммы главного и орбитального квантовых чисел (n + l) к орбиталям с большим значением этой суммы;
Например, 3d, сумма n+l= 3+2 =5
4S, сумма n+l= 4+0=4
2) при одинаковых величинах суммы (n + l) заполнение орбиталей происходит в направлении возрастания значения главного квантового числа n (таблица 1.2).
Таблица 1.2 – Последовательность заполнения атомных
орбиталей электронами.
|
Энергия орбитали |
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d< |
|||||||||
|
Сумма n + l |
1 |
2 |
3 |
3 |
4 |
4 |
5 |
5 |
5 |
6 |
|
Энергия орбитали |
<5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p |
||||||||
|
Сумма n + l |
6 |
6 |
7 |
7 |
7 |
7 |
8 |
8 |
8 |
Таким образом, хотя 3d-орбитали появляются уже у элементов третьего периода, заполнение 3d-орбиталей происходит только после заполнения 4s-орбиталей, т.е. у элементов четвёртого периода.
III – Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Каждая орбиталь — это энергетическое состояние, которое характеризуется значениями трех квантовых чисел: п, l и ml. Эти числа определяют размер, форму и ориентацию орбитали в пространстве. Следовательно, на одной орбитали может быть не более двух электронов, и различаться они будут значением четвертого (спинового) квантового числа: тs = +1/2 или - 1/2
IV – Правило Хунда: при формировании электронного подуровня электроны заполняют максимальное число свободных орбиталей так, чтобы число неспаренных электронов было наибольшим.
Устойчивому состоянию атома соответствует такое распределение электронов в пределах подуровня, при котором абсолютное значение суммарного спина максимально (правило Хунда). Поэтому при заполнении p-орбиталей атомов углерода и азота каждый электрон заполняет свободную орбиталь, а не спаривается с другим электроном.
Структура электронной оболочки атома и положение элемента в периодической системе связаны между собой. Зная положение элемента в периодической системе, можно определить структуру электронной оболочки атома любого элемента.
Порядковый номер элемента в периодической системе показывает заряд ядра его атома и число электронов в атоме.
Номер периода соответствует числу энергетических уровней в электронной оболочке атомов всех элементов данного периода.
Номер группы соответствует, как правило, числу валентных электронов в атомах элементов данной группы.
Валентные электроны — это электроны последних энергетических уровней. Валентные электроны имеют максимальную энергию и участвуют в образовании химической связи между атомами в молекулах.
В атомах элементов главных подгрупп (А) все валентные электроны находятся на последнем энергетическом уровне, и их число равно номеру группы.
В атомах элементов побочных подгрупп (В) на последнем энергетическом уровне находится не более двух электронов, остальные валентные электроны находятся на предпоследнем энергетическом уровне. Общее число валентных электронов, как правило, равно номеру группы.
Число заполняемых электронами энергетических уровней в атоме соответствует номеру периода, в котором находится элемент: у атомов элементов I периода — один энергетический уровень, у атомов II периода — два и т.д.
Наибольшее число электронов на энергетическом уровне равно:
N=2n2
где п — номер уровня, или главное квантовое число.
Следовательно, на первом энергетическом уровне может находиться не более двух электронов, на втором — не более 8, на третьем —не более 18, на четвертом — не более 32.
Теперь рассмотрим строение отдельно взятого электронного уровня. Начиная со значения п = 2 энергетические уровни подразделяются на подуровни, отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа, но не превышает четырех.
Н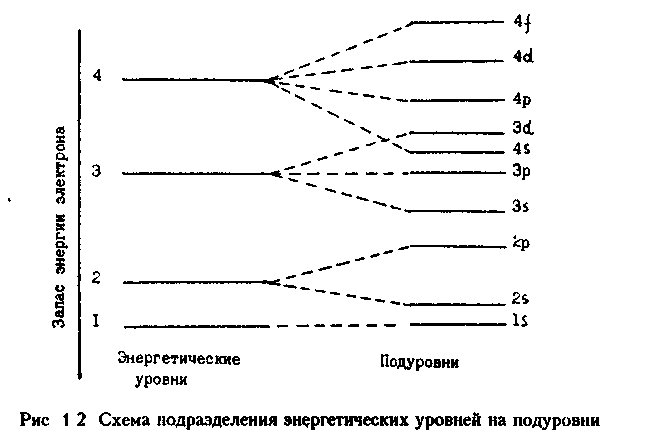 а
рис. 1.2 дана схема подразделения
энергетических уровней на подуровни.
а
рис. 1.2 дана схема подразделения
энергетических уровней на подуровни.
Распределение электронов по уровням и подуровням (электронные конфигурации атомов) записывают в виде электронных формул.
Например, электронная формула атома натрия записывается так: