- •Строение атомов. Современная формулировка Периодического закона.
- •Квантово-механическое описание состояния электрона в атоме
- •Электрон имеет двойственную природу. Он обладает свойствами и частицы, и волны одновременно.
- •Положение электрона в атоме неопределенно.
- •Формирование электронной оболочки атома.
- •3.1 Формирование электронной оболочки атома
- •Основные закономерности заполнения электронами уровней, подуровней и орбиталей в электронной оболочке атома
- •Электронные конфигурации атомов и Периодическая система.
-
Электрон имеет двойственную природу. Он обладает свойствами и частицы, и волны одновременно.
Как частица электрон имеет массу и заряд, однако движение электронов - это волновой процесс. Электронам свойственно явление дифракции (это означает, что поток электронов может огибать препятствия).
-
Положение электрона в атоме неопределенно.
Это означает, что невозможно одновременно точно определить и скорость электрона, и его координаты в пространстве.
Электрон, который движется с очень большой скоростью, может находиться в любой части пространства вокруг ядра, и различные моментальные его положения образуют так называемое электронное облако с неравномерной плотностью отрицательного заряда (рисунок 3.1).
Форма и размеры электронного облака могут быть разными в зависимости от энергии электрона.
Для химической характеристики элемента, которая определяется состоянием электронов в электронной оболочке его атома, необходимо знать:
— энергию электрона в атоме (точнее, энергию системы, состоящей из этого электрона, других электронов и ядра;
— форму образуемого данным электроном электронного облака.

Квантовые числа
Состояния электрона в атоме можно описать с помощью четырёх квантовых чисел: главного, орбитального, магнитного и спинового.
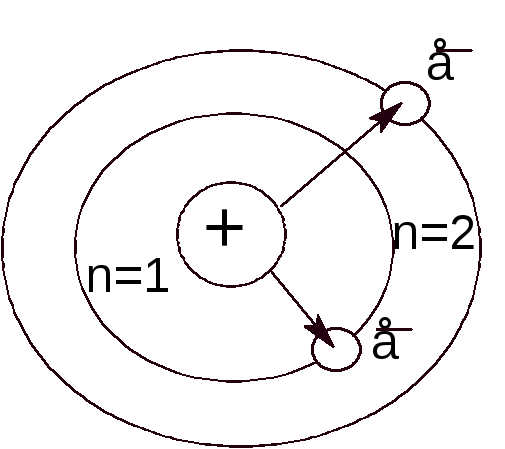
В зависимости от энергии электроны в атоме распределяются по энергетическим уровням и подуровням.
Главное квантовое число (п) характеризует энергетический уровень и определяет размер электронного облака, т. е. среднее расстояние электрона от ядра.
Главное квантовое число принимает целочисленные значения 1, 2, 3, ..., п, которые соответствуют номеру энергетического уровня.
Чем больше п, тем выше энергия электрона, следовательно, минимальная энергия соответствует первому уровню (п = 1). Более высокие значения n соответствуют более высоким значениям энергии электрона. Чем больше энергия электрона, тем более удалён он от ядра.
Большему значению главного квантового числа соответствует больший размер электронного облака. Электроны, характеризующиеся одним и тем же значением главного квантового числа n, образуют электронные облака приблизительно одинаковых размеров.
Орбитальное или побочное квантовое число (l) характеризует энергетический подуровень и определяет форму электронного облака
Орбитальное или побочное квантовое число (l) принимает целочисленные значения от 0 до (п - 1). Его значения обычно обозначаются как цифрами, так и буквами:
l = 0 1 2 3
s p d f
Число возможных значений l соответствует числу возможных подуровней на данном уровне, равному номеру уровня (п).
|
При п = 1 |
l = 0 (1 значение) |
подуровень S |
|
п = 2 |
l = 0, 1 (2 значения) |
подуровни: S, p, |
|
п = 3 |
l = 0, 1, 2 (3 значения) |
подуровни: S, p, d, |
|
п = 4 |
l = 0, 1, 2, 3 (4 значения) |
подуровни: S, p, d, f |
Энергия электронов на разных подуровнях одного уровня изменяется в зависимости от l следующим образом:
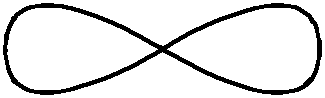
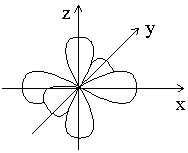
– каждому значению l соответствует определенная форма электронного облака: s - сфера, р - объемная восьмерка, d и f - объемная четырех лепестковая розетка или более сложная форма (табл. 1.1).
Таблица 1.1 – Форма электронных облаков
-
Главное
квантовое
число (n)
Возможные
значения
орбитального
квантового
числа (l= п-1)
Форма
электронного
облака
Буквенное
обозначение
1
0

s
2
0

s
1

p
3
0

s
1
p
2


d
Магнитное квантовое число
Ориентация электронного облака в пространстве также не может быть произвольной: она определяется значением магнитного квантового числа (ml).
Магнитное квантовое число (ml) может принимать любые целочисленные значения в интервале от -l до +l, и рассчитывается по формуле:
ml = 2l + 1
|
число значений, l |
число значений, ml |
Ориентация электр.облака |
Колич. орбиталей |
|
для s-электронов, l = 0, |
ml = 0 |
сфера |
1 |
|
р-электронов, l = 1, |
ml = -1; 0; 1 |
по оси Х,Y и Z |
3 |
|
d-электронов, l = 2, |
ml = -2;-1; 0; 1; 2 |
разные ориентации в пространстве |
5 |
|
f-электронов, l = 3, |
ml = -3; -2-1; 0; 1; 2; 3 |
–«– |
7 |
Электроны, имеющие одинаковые значения п, l и ml, находятся на одной орбитали.
Например, три p-электронных облака с ml = -1; 0; +1 располагаются в пространстве перпендикулярно друг другу, как показано на рисунке
Спиновое квантовое число (тs)
Исследование атомных спектров показало, что помимо квантовых чисел n, l, ml, электрон характеризуется ещё одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное движение. Эта величина получила название спинового квантового числа (ms).
У электрона спиновое квантовое число может принимать два значения: ms = +1/2 и ms = -1/2 . Схематическое изображение:
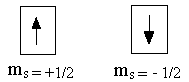
Согласно принципа Паули в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Из этого следует, что на каждой атомной орбитали, характеризующейся определёнными значениями n, l, ml , может находиться не более двух электронов, причём спины этих электронов должны быть противоположно направлены (так как только в этом случае спиновые квантовые числа электронов будут отличаться: у одного электрона ms = +1/2, у другого ms = -1/2).
О![]() бозначение
неспаренного
электрона на атомной орбитали:
бозначение
неспаренного
электрона на атомной орбитали:
О![]() бозначение
двух спаренных
электронов с противоположными спинами,
находящихся на одной атомной орбитали:
бозначение
двух спаренных
электронов с противоположными спинами,
находящихся на одной атомной орбитали:
Итак, четыре квантовых числа n, l, ml, ms однозначно определяют состояние электрона в атоме.
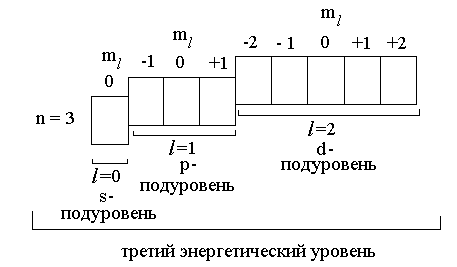
Атомные орбитали
Состояние электрона в атоме, характеризующееся тремя квантовыми числами n, l, ml , называется атомной орбиталью. Часто орбиталь также определяют как область пространства, в которой наиболее вероятно нахождение электрона.
Совокупность орбиталей с одним и тем же значением главного квантового числа n образует энергетический уровень.
Орбитали некоторого энергетического уровня, характеризующиеся одним и тем же значением орбитального квантового числа l, образуют энергетический подуровень.
Очевидно, что число орбиталей на подуровне равно числу значений магнитного квантового числа ml, которые оно может принимать при данном l.
Графическое изображение орбитали:
![]()
Например, показанные ниже орбитали все вместе образуют третий энергетический уровень, так как все они характеризуются одним и тем же значением главного квантового числа n = 3. Третий энергетический уровень делится на три подуровня, несколько различающихся по энергии: s-орбитали имеют более низкую энергию, чем p-орбитали, а p-орбитали, более низкую энергию, чем d-орбитали. Каждый подуровень образован орбиталями с одинаковым значением орбитального квантового числа l.