
ФизХим_лаборат
.pdfлатина. Определить золотые числа этих коллоидов и сравните их защитное действие.
Лабораторная работа № 11
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ. ИЗУЧЕНИЕ СВОЙСТВ РАСТВОРОВ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
Цель работы. Определить молекулярную массу ВМС вискозиметрическим методом.
Основные понятия. ВМС, вязкость, вискозиметр.
Оборудование. Вискозиметр.
Реактивы. 1 % раствор крахмала.
Краткие теоретические положения
Кчислу основных высокомолекулярных соединений, входящих в состав всех живых организмов, относятся полисахариды
ибелки. Эти вещества служат основой для построения клетки и всего живого организма. Свойства этих веществ, их строение и взаимодействие с другими соединениями и рассматривает данный раздел физической химии.
Важнейшие явления, связанные с набуханием, растворением, старением растворов ВМС, а также вязкость, тиксотропия, коацервация, защитное действие имеют огромное значение во многих областях человеческой деятельности, в том числе и в сельском хозяйстве.
Квысокомолекулярным соединениям относят соединения с молекулярной массой порядка 104—106 и выше. Они могут быть природного происхождения (белки, полисахариды, пектины, натуральный каучук) или получаются синтетически в процессах полимеризации и поликонденсации (пластмассы, синтетические волокна).
Молекулы ВМС чрезвычайно велики и носят название макромолекул. Природные ВМС (биополимеры) характеризуются постоянным значением молекулярной массы. В отличие от них синтетические полимеры всегда являются полидисперсными системами, так как состоят из смеси макромолекул, различных по длине и массе. Поэтому молекулярная масса таких полимеров
71
представляет собой среднее значение М.
Высокомолекулярные вещества могут образовывать как истинные, так и коллоидные растворы (дисперсии). Характер раствора зависит от сродства ВМС к растворителю. В растворителях, полярность которых соответствует полярности ВМС, происходит истинное растворение с образованием молекулярных растворов (например, агар-агар и желатин в воде или каучук в неполярном растворителе). При несоответствии полярности растворителя и ВМС образуются золи или дисперсии.
Истинному растворению полимеров часто предшествует процесс набухания. Он заключается в увеличении объема и массы полимера за счет поглощения им какого-то количества растворителя. При контакте полимера с растворителем начинается взаимная диффузия молекул растворителя в полимер, а макромолекул полимера — в растворитель. В зависимости от структуры полимера и температуры набухание может быть ограниченным или неограниченным. При набухании полимеров их объем увеличивается в 10—15 раз и возникает давление набухания, достигающее иногда сотен мегапаскалей. Это давление легко обнаруживается, когда какое-либо препятствие мешает увеличению объема образца. Давление набухания эквивалентно внешнему давлению, приложение которого могло бы остановить увеличение объема набухающего полимера.
Растворы полимеров в хорошо растворяющих их жидкостях агрегативно устойчивы. Нарушить устойчивость растворов полимеров можно путем ухудшения растворимости ВМС — введением электролитов или нерастворителей (жидкостей, плохо растворяющих данный полимер). Так, например, для белков и полисахаридов нерастворителями являются этанол, ацетон.
Под влиянием электролитов и нерастворителей происходит процесс выделения ВМС из раствора, называемый высаливанием. Внешне такой процесс сходен с коагуляцией, однако если для коагуляции золей требуются малые количества электролита и процесс коагуляции необратим, то для разрушения раствора ВМС требуется большая концентрация электролита, при этом протекает обратимый процесс и наблюдается неподчинение правилу Шульце—Гарди. В основе механизма высаливания ВМС лежит
72
процесс дегидратации. Высаливание ВМС имеет большое практическое значение. Его применяют для фракционирования белков, полисахаридов и других веществ.
Вконцентрированных растворах ВМС могут возникать ассоциаты, которые затем становятся зародышами новой фазы. Выделение новообразовавшейся фазы в виде мельчайших капель называют коацервацией, а образующуюся двухфазную систему — коацерватом. Коацерват — термодинамически неравновесная система, по свойствам сходная с эмульсиями. Процессу коацервации способствует не только высокая концентрация, но и низкая температура, изменение рН среды, введение низкомолекулярных электролитов.
Практическая важность коацервации возросла в связи с развитием технологии микрокапсулирования. Микрокапсулирование
вфармацевтической промышленности применяют с целью защиты лекарственного вещества от соприкосновения с окружающей средой. Микрокапсулы представляют собой заключенные в оболочку из полимера твердые, жидкие или газообразные лекарственные вещества. Оболочка их образуется из адсорбированных капелек коацервата полимера, которые сливаются в сплошную пленку и специальной обработкой переводятся в твердое состояние.
Впротивоположность золям осмотическое давление растворов ВМС существенно и может быть измерено с достаточной точностью. Такие измерения используют для определения молекулярной массы ВМС.
Характерной особенностью растворов ВМС является их высокая вязкость по сравнению с чистым растворителем даже при малых концентрациях. Особенно сильно это свойство проявляется у полимеров с длинными линейными макромолекулами, например, у каучука. Растворы полимеров с той же молекулярной массой, но сферической формой молекул (глобулярные ВМС) имеют меньшую вязкость. Отсюда следует, что вязкость растворов полимеров возрастает пропорционально асимметрии их молекул. При одинаковой химической структуре молекул вязкость закономерно возрастает с увеличением молекулярной массы. Вязкость зависит также от концентрации полимера и межмоле-
73
кулярных сил взаимодействия.
Зависимость вязкости от концентрации в настоящее время используют для определения молекулярной массы ВМС на осно-
ве уравнения |
|
KM a , |
(12.1) |
где [η] – характеристическая вязкость;
K, a - константы, зависящие от ВМС и растворителя, М – молекулярная масса полимера.
ηуд/С
[η] |
|
С |
|
Рисунок 15. Зависимость |
|
приведенной вязкости от |
Рисунок 16. |
концентрации ВМС |
Капиллярный вискозиметр |
Величина характеристической вязкости [η] определяется графически – это отрезок отсекаемый графиком зависимости ηуд/С от С на оси ординат (рисунок 15).
Величину ηуд/С называют приведенной вязкостью
уд 0 , (12.2)
0
где η – вязкость раствора; η0 – вязкость растворителя.
Одним из характерных свойств растворов ВМС является их старение, которое проявляется в постепенном самопроизвольном изменении вязкости растворов при стоянии. Старение вызывается действием на цепи полимеров кислорода и примесей. В результате происходит разрушение макромолекул или их агрегация.
74
Ход работы
Для определения молекулярной массы ВМС готовят растворы с разной концентрацией (таблица 20).
Таблица 20 – Определение молекулярной массы ВМС
Параметры |
|
|
Концентрация раствора ВМС, % |
|||||||
|
|
0 (Н2О) |
0,25 |
0,50 |
0,75 |
1,0 |
||||
|
|
|
|
|
||||||
|
|
|
Приготовление раствора |
|
|
|
||||
Объем 1 % раствора крахмала, мл |
0 |
|
5 |
10 |
15 |
20 |
||||
Объем воды, мл |
|
|
|
|
20 |
|
15 |
10 |
5 |
0 |
|
|
|
|
Результаты измерения |
|
|
|
|
||
|
|
|
|
1 |
|
|
|
|
|
|
Время истечения раствора |
|
2 |
|
|
|
|
|
|
||
в вискозиметре τ, с |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
среднее |
|
|
|
|
|
|
τ – τ0, с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уд |
|
0 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ηуд/С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приготовленные растворы перемешивают, выдерживают 5 мин при комнатной температуре, затем определяют вязкость этих растворов путем измерения времени истечения этих растворов через капилляр вискозиметра (рисунок 16).
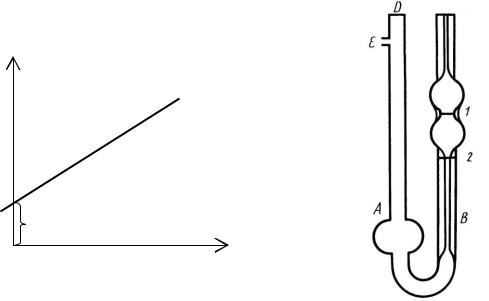
Вискозиметр представляет собой U-образную трубку, в колено которой впаян капилляр. Измерение вязкости жидкости при помощи капиллярного вискозиметра основано на определении времени истечения через капилляр определённого объёма жидкости из измерительного резервуара.
Для этого в колено А наливают 10 мл исследуемого раствора, закрывают пальцем отверстие D и грушей нагнетают воздух в вискозиметр через отверстие E, таким образом, чтобы уровень жидкости в колене B был выше отметки 1. Убирают палец, и в момент, когда уровень жидкости опустится до отметки 1, засекают время. Останавливают время, когда уровень жидкости достигнет отметки 2. Результат заносят в таблицу 18. Измерение проводят три раза, рассчитав затем среднее значение. Измерив время истечения всех растворов, рассчитывают удельную и приведен-
75
ную вязкость растворов. По окончании измерений вискозиметр тщательно моют и заполняют дистиллированной водой.
Строят график зависимости ηуд/С от С, и на нем находят величину характеристической вязкости [η] (рисунок 13). Расчет мо-
лекулярной массы ВМС ведут по формуле |
|
||||
|
|
|
|
|
|
|
lg |
|
|
|
|
|
K |
|
(12.3) |
||
lg M |
|
|
. |
||
|
a |
|
|
||
|
|
|
|
|
|
Для крахмала константы равны: K =1,32·10–4; a = 0,68.
Вывод должен содержать:
1.Значение найденной молекулярной массы крахмала.
2.Структурную формулу простейшего звена этого полимера.
Контрольные вопросы
1.Привести примеры природных и искусственных ВМС.
2.В чем сходство и различие между растворами ВМС и коллоидными растворами?
3.Электрические, молекулярно-кинетические и оптические свойства растворов ВМС.
4.Изоэлектрическое состояние. Изоэлектрическая точка.
5.Вязкость. Осмотическое давление.
6.Набухание и растворение ВМС. Факторы набухания.
7.Свободная и связанная вода в коллоидных системах.
8.Нарушение устойчивости растворов ВМС. Высаливание. Коацервация.
Контрольные задачи
1.При электрофорезе в нейтральной среде молекула белка движется к катоду. В кислой или щелочной области находится изоэлектрическая точка этого белка?
2.К какому электроду при электрофорезе в нейтральной среде будет двигаться молекула белка, если его изоэлектрическая точка находится в кислой области?
3.В растворе содержится смесь белков (ВМС): казеин, глиадин и глобулин, характеризующиеся соответственно изоэлектрическими точками: 4,6; 9,8; 5,4. К каким электродам двигаются молекулы белков при электрофорезе в
76
нейтральной среде (рН = 7)?
4.При каких значениях рН можно электрофоретически разделить белки из предыдущей задачи?
77
ПРИЛОЖЕНИЯ
Приложение 1 Термодинамические константы некоторых веществ при стан-
дартных условиях
Вещество |
Η0обр, |
S0, |
G0обр, |
|
кДж/моль |
Дж/моль·К |
кДж/моль |
||
|
||||
Al (кр.) |
0 |
28 |
0 |
|
Al2O3 (корунд) |
–1676 |
51 |
–1582 |
|
C (алмаз) |
2 |
2 |
3 |
|
С (графит) |
0 |
6 |
0 |
|
CO (г.) |
–111 |
198 |
–137 |
|
CO2 (г.) |
–394 |
214 |
–394 |
|
Cu (кр.) |
0 |
33 |
0 |
|
CuO (кр.) |
–162 |
43 |
–134 |
|
Cl2 (г.) |
0 |
223 |
0 |
|
CH4 (г.) |
–75 |
186 |
–51 |
|
Fe-α (кр.) |
0 |
27 |
0 |
|
FeO (кр.) |
–265 |
61 |
–244 |
|
Fe2O3 (кр.) |
–822 |
88 |
–740 |
|
H2 (г.) |
0 |
131 |
0 |
|
H2O (г.) |
–242 |
189 |
–229 |
|
H2O (ж.) |
–286 |
70 |
–237 |
|
HCl (г.) |
–92 |
187 |
–95 |
|
NO (г.) |
91 |
211 |
88 |
|
NH3 (г.) |
–46 |
193 |
–17 |
|
O2 (г.) |
0 |
205 |
0 |
78
Приложение 2 Интегральные теплоты растворения некоторых веществ при
25 ºС
Сm, |
|
|
∆H , кДж/моль |
|
|
|||
|
|
|
m |
|
|
|
|
|
моль/кг |
KCl |
NH4Cl |
NH4NO3 |
KNO3 |
KI |
KOH |
NaOH |
|
воды |
||||||||
|
|
|
|
|
|
|
||
0,01 |
17,39 |
14,85 |
25,77 |
35,03 |
20,67 |
–55,10 |
–42,66 |
|
0,02 |
17,44 |
14,94 |
25,79 |
35,02 |
20,71 |
–55,00 |
–42,55 |
|
0,05 |
17,51 |
15,02 |
25,82 |
34,94 |
20,73 |
–54,87 |
–42,47 |
|
0,1 |
17,55 |
15,10 |
25,75 |
34,77 |
20,71 |
–54,75 |
–42,36 |
|
0,2 |
17,57 |
15,19 |
25,56 |
– |
20,67 |
– |
– |
|
0,3 |
17,55 |
15,23 |
25,38 |
– |
20,59 |
–54,56 |
–42,30 |
|
0,4 |
17,50 |
15,27 |
25,21 |
– |
20,42 |
– |
– |
|
0,5 |
17,43 |
15,27 |
25,06 |
– |
20,29 |
–54,45 |
–42,34 |
|
1,0 |
17,28 |
15,31 |
24,31 |
– |
19,73 |
–54,33 |
–42,53 |
|
2,0 |
16,72 |
15,27 |
23,05 |
– |
18,62 |
–53,80 |
–42,70 |
|
Приложение 3 Константы диссоциации некоторых слабых электролитов при
25 ºС
Электролит |
Выражение |
Кдис |
|
|
рК = –lgKдис |
|||||||||||
СH COOH |
[CH3COO- ][H+ ] |
1,75·10 |
–5 |
4,75 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
3 |
|
|
|
[CH3COOH] |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
HCOOH |
|
[HCOO- ][H+ ] |
1,77·10–4 |
3,75 |
||||||||||||
|
|
|
[HCOOH] |
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
NH OН |
|
|
[NH4 |
+ ][OH- ] |
1,79·10 |
–5 |
4,75 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
4 |
|
|
|
[NH4OH] |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
(I) |
[HCO3- ][H+ ] |
|
|
4,45·10–7 |
6,35 |
||||||||||
H2CO3 |
|
[H2CO3 ] |
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
(II) |
[CO32- ][H+ ] |
4,69·10 |
–11 |
10,33 |
||||||||||||
|
|
|
[HCO - ] |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
79
Приложение 4 Основные физические постоянные
Наименования |
Символ |
Значения |
|
|
|
|
|
Скорость света в вакууме |
с |
2,99792458·108 м/с |
|
Элементарный заряд |
е |
1,60219·10–19 Кл |
|
Постоянная Авогадро |
NA |
6,022·1023 моль–1 |
|
Постоянная Фарадея |
F |
96484,56 Кл/моль |
|
|
|
|
|
Универсальная газовая посто- |
R |
8,314 Дж/(моль·К) |
|
янная |
|||
|
|
||
|
|
|
|
Молярный объем идеального |
Vm |
22,4·10–3 м3/моль |
|
газа при нормальных условиях |
|
|
|
|
|
|
|
Абсолютный ноль температуры |
Т0 |
0 К= –273,15 ºС |
|
|
|
|
|
Скорость звука в воздухе при |
v |
331,5 м/с |
|
нормальных условиях |
|||
|
|
||
|
|
|
|
Ускорение свободного падения |
g |
9,80665 м/с2 |
|
Нормальное атмосферное дав- |
P0 |
101325 Па = 760 мм |
|
ление |
рт. ст. |
||
|
|||
|
|
|
|
Плотность воды максимальная |
Н2О |
999,973 кг·м–3 |
|
(t = 3,98 ºC и p = 101325 Па) |
|
|
|
|
|
|
|
Электрическая постоянная |
εo |
8,854188·10–12 Ф·м–1 |
80
