
ФизХим_лаборат
.pdf
|
. |
(7.3) |
|
|
|
|
|
Молярная электрическая |
проводимость |
электролита при |
|
бесконечном разбавлении (λ∞) равна сумме предельных подвиж-
ностей анионов |
и катионов . Это соотношение установлено |
|
|
Кольраушем и называется законом независимого движения ионов. Предельная подвижность ионов зависит только от природы растворителя и температуры; для многих ионов эта величина экспериментально определена и приведена в справочниках (таблица 12). Характер зависимости молярной электрической проводимости от концентрации (рисунок 8) для сильных и слабых электролитов различен, поскольку влияние концентрации обусловлено различными причинами.
Таблица 12 – Предельные подвижности ионов (См·см2/моль) при
25 °С
Катион |
|
|
Анион |
|
|
|
|
||||
|
|
|
|
||
Н+ |
349,8 |
ОН– |
198,0 |
||
К+ |
73,5 |
I– |
76,8 |
||
Na+ |
50,1 |
Вг– |
78,4 |
||
Li+ |
38,7 |
С1– |
76,3 |
||
Ag+ |
61,9 |
NO – |
71,4 |
||
|
|
|
3 |
|
|
Ва2+ |
127,2 |
СН3СОО– |
40,9 |
||
Са2+ |
119,0 |
SO 2– |
160,0 |
||
|
|
|
4 |
|
|
Mg2+ |
106,1 |
[Fe(CN)6]3– |
297,0 |
||
Аl3+ |
189,0 |
[Fe(CN)6]4– |
444,0 |
||
Fe3+ |
204,0 |
|
|
|
|
Измерения электрической проводимости растворов производят с помощью приборов, называемых кондуктометрами. Любые исследования, основанные на измерении электрической проводимости, объединяются под названием кондуктометрии. Кондуктометрические методы применяются для изучения свойств как сильных, так и слабых электролитов, чаще всего для определения констант и степени диссоциации:
|
|
(уравнение Аррениуса). |
(7.4) |
|
|
||||
|
|
|
||
|
|
|
|
41
Явления электрической проводимости в тканях растительных и животных организмов имеют большое физиологическое значение.
Ход работы
Перед проведением работы готовят растворы уксусной кислоты разной концентрации из имеющегося 0,5 М раствора:
-для приготовления 0,1 М раствора исходный (0,5 М) раз-
бавляют в 5 раз (пипеткой берут 10 мл 0,5 М CH3COOH в мерную колбу на 50 мл и доводят водой до метки);
-для приготовления 0,05 М раствора исходный (0,5 М) раз-
бавляют в 10 раз (пипеткой 5 мл 0,5 М CH3COOH в мерную колбу на 50 мл и водой до метки);
-для приготовления 0,01 М раствора исходный (0,5 М) раз-
бавляют в 50 раз (пипеткой 1 мл 0,5 М CH3COOH в мерную колбу на 50 мл и водой до метки).
Таблица 13 – Физико-химические свойства растворов электролитов, полученные на основе измерения электропроводимости
Электролит |
H2O |
|
CH3COOH |
||
CM, моль/л |
дист |
0,01 |
0,05 |
0,1 |
0,5 |
Удельная электрическая про- |
|
|
|
|
|
водимость κ, мкСм/см |
|
|
|
|
|
Молярная электрическая про- |
– |
|
|
|
|
водимость λ, См·см2/моль |
|
|
|
|
|
(таблица 12), См·см2/моль |
– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Степень диссоциации α, % |
– |
|
|
|
|
|
|
|
|
|
|
Константа диссоциации кисло- |
– |
|
|
|
|
ты Кдис (эксперим.) |
|
|
|
|
|
|
|
|
|
|
|
Кдис (эксперим.) средняя |
– |
|
|
|
|
|
|
|
|
|
|
Константа диссоциации кисло- |
– |
|
|
|
|
ты Кдис (приложение 3) |
|
|
|
|
|
|
|
|
|
|
|
Измеряют удельную электрическую проводимость (κ) растворов, погружая кондуктометрическую ячейку (электрод) в рас-
42
творы на 2 мин, начиная с раствора с наименьшей концентрацией уксусной кислоты. При снятии показаний (по истечении времени) учитывают единицы измерения. Кондуктометрическую ячейку тщательно промывают дистиллированной водой после каждого измерения. Результаты эксперимента и данные теоретических расчетов занести в таблицу 13.
Построить графики зависимостей и приложить их к отчету:
а) κ–CM; б) λ–CM; в) α–CM.
Вывод должен содержать ответы:
1.Как изменяются удельная и молярная электрические проводимости растворов при разбавлении растворов электролитов?
2.Сравните экспериментальные и табличные значения молярной электрической проводимости при бесконечном разбавлении и константы диссоциации электролита. В чем причина их различий?
3.Как влияет разбавление электролита на степень его диссоциации?
Контрольные вопросы
1.Какая величина называется удельной электрической проводимостью? Какая величина называется молярной проводимостью? Как она связана с удельной проводимостью?
2.Какая величина называется предельной молярной проводимостью? Как ее определяют?
3.В чем состоит сущность закона независимого движения ионов? Для чего этот закон применяют?
4.Какова причина аномальной подвижности ионов Н+ и ОН–?
5.Написать выражение закона разбавления Оствальда и дать его анализ.
6.Что такое кондуктометрическое титрование? Начертите типичные графики кондуктометрического титрования.
Контрольные задачи
43
1.Вычислить молярную электрическую проводимость децимолярного раствора НСl, если удельная электрическая проводимость раствора 0,039 См/см.
2.Определить удельную электропроводимость сантимоляр-
ного раствора гидроксида натрия, если молярная проводимость раствора составляет 5,6 мСм·см2/моль.
3.Удельная электрическая проводимость децимолярного
раствора этиламина при 25 °С равна 0,0015 См/см. Предельная молярная проводимость 204 См·см2/моль. Найти степень диссоциации и константу диссоциации этиламина.
4.Предельная молярная проводимость пикрата калия при 25 °С равна 103,97 См·см2/моль. Предельная подвижность иона калия 73,58 См·см2/моль. Вычислить предельную подвижность пикрат-иона.
5.Какова молярная электропроводимость раствора уксусной кислоты, если степень ее диссоциации составляет 4 %?
6.Удельная электрическая проводимость миллимолярного раствора уксусной кислоты равна 0,492·10–4 См/см. Чему равна константа диссоциации уксусной кислоты?
7.Исходя из закона разбавления Оствальда, рассчитать степень диссоциации децимолярного и миллимолярного раствора гидроксида аммония.
8.Рассчитать молярные электрические проводимости элек-
тролитов при бесконечном разбавлении: H2O; NaOH; BaCl2; CH3COONa; Al2(SO4)3; K4[Fe(CN)6].
Лабораторная работа № 7
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Цель работы. Провести электролиз раствора сульфата меди (II), определить выход меди по току.
Основные понятия. Электролит, электролиз, проводники первого и второго рода, перенапряжение.
Оборудование. Электролизная ванна с электродами, источник тока, амперметр,
44

Реактивы. Раствор электролита (CuSO4 (200 – 250 г/л); H2SO4 (50 – 70 г/л)), раствор для протравливания электродов
(H2SO4 (≈ 40 %), HNO3 (≈ 20 %)).
Краткие теоретические положения
При растворении электролита в воде происходит распад его на ионы, в результате чего раствор способен проводить электрический ток. Такое свойство называется электропроводностью растворов. И чем больше концентрация этих ионов, тем выше электропроводность.
При пропускании электрического тока через раствор ионы перемещаются к соответствующему электроду, на которых идет процесс восстановления или окисления ионов, в результате чего происходит разложение электролита. Этот процесс и называется
электролизом.
Одни ионы при электролизе легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений.
РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pt, Au
Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его
ионы (легче всего разряжаются ионы Аu3+, Ag+; труднее всего Li+, K+).
Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого отрицательный потенциал меньше (или положительный
– больше). Например, из раствора, содержащего ионы Zn2+ и Cu2+, сперва выделяется металлическая медь. Но величина потенциала металла зависит и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов может
45
случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала).
В водных растворах солей, кроме ионов соли, всегда имеются и ионы воды (Н+ и ОН–). Из них ионы водорода будут разряжаться легче, чем ионы всех металлов, предшествующих водороду в ряду напряжений. Однако ввиду ничтожной концентрации водородных ионов при электролизе всех солей, кроме солей наиболее активных металлов, у катода происходит выделение металла, а не водорода. Только при электролизе солей натрия, кальция и других металлов до алюминия включительно разряжаются ионы водорода и выделяется водород.
У анода могут разряжаться или ионы кислотных остатков или гидроксильные ионы воды. Если ионы кислотных остатков не содержат кислорода (Cl–, S2–, CN– и другие), то обычно разряжаются именно эти ионы, а не гидроксильные, которые теряют свой заряд значительно труднее, и у анода выделяются Cl2, S и т.д. Наоборот, если электролизу подвергается соль кислородсодержащей кислоты или сама кислота, то разряжаются гидроксильные ионы, а не ионы кислородных остатков. Образующиеся при разряде гидроксильных ионов нейтральные группы ОН тот-
час же разлагаются по уравнению:
4ОН– – 4ē → 4OH → 2H2O + O2↑
В результате у анода выделяется кислород.
Основными законами электролиза являются законы Фарадея, математически суммарно которые можно представить в виде
m |
M |
I , |
(8.1) |
|
z F |
||||
|
|
|
где m – масса вещества, выделившаяся на электроде, г; M – молярная масса этого вещества, г/моль;
z – количество электронов, участвующих в электродном процессе;
F – постоянная Фарадея; I – сила тока, А;
τ – время электролиза, с; Для практического осуществления электролиза конкретного
электролита необходимо определенное минимальное пороговое
46
напряжение, значение которого тем выше, чем труднее разряжаются на электродах катионы и анионы. Это напряжение называется напряжением разложения электролита, т.е. это минимальное напряжение между электродами, при котором начинает протекать электролиз.
Электрохимическим реакциям, протекающим на электродах, препятствуют другие процессы: процессы переноса частиц в растворе, разрушение гидратной оболочки, объединение атомов в двухатомные молекулы и т.д. Вследствие существования данных процессов требуется бóльшее напряжение для осуществления электролиза. Такое повышение напряжения называется перена-
пряжением.
Противоположным по своему принципу является гальванический элемент. Это источник тока, где химическая энергия превращается в электрическую.
Ход работы
Перед проведением работы составить уравнения реакции электролиза раствора сульфата меди (II) на медных электродах.
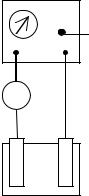
Работа выполняется на установке, схема которой приведена на рисунке 9.
Режим электролиза: температура 20 – 25 ºС; плотность тока
2 – 5 А/дм2; время электролиза 30 – 40 мин; соотношение Sано-
да/Sкатода = 1:1.
1 |
2 |
|
+–
А3
4
Рисунок 9. Схема установки для проведения электролиза:
1– источник постоянного тока;
2– регулятор напряжения;
3– амперметр;
4− электролизная ванна с электродами
1. Электрод, предназначенный для покрытия медью, предварительно очистить наждачной бумагой, замерить геометрические размеры линейкой, затем протравить в растворе серной кислоты (≈ 40 %) с добавлением азотной кислоты (≈ 20 %) в течение 1 мин
47
в вытяжном шкафу. Образец после травления промыть дистиллированной водой, протереть фильтровальной бумагой и высушить над электрической плиткой, охладить до комнатной температуры
ивзвесить на весах.
2.Силу тока, необходимую для проведения электролиза, рассчитать исходя из геометрических размеров образца и режима электролиза, указанного преподавателем. Для расчета воспользоваться формулой
i |
I |
, |
(8.2) |
|
S
где i – плотность тока, А/дм2; I – сила тока, А;
S– площадь поверхности электрода, дм2.
3.После проведения электролиза катод тщательно промыть дистиллированной водой, протереть фильтровальной бумагой, высушить над электрической плиткой и вновь взвесить.
Таблица 14 – Результаты электролиз раствора соли меди
Масса |
Площадь |
Сила |
Плот- |
Время |
Масса |
Масса |
Толщина |
Выход |
||
электрода |
ность |
элек- |
электрода |
осажден- |
||||||
электрода, |
тока, |
покры- |
по то- |
|||||||
до элек- |
тока, |
тролиза, |
после элек- |
ной меди, |
||||||
дм |
2 |
А |
тия, мкм |
ку, % |
||||||
тролиза, г |
|
А/дм2 |
с |
тролиза, г |
г |
|||||
|
|
|
|
|
|
|
|
|
|
|
4. На основании полученных данных рассчитать выход по току и толщину медного покрытия, приняв плотность меди 8,96 г/см3. Данные занести в таблицу 14.
Вывод должен содержать полученные данные.
Контрольные вопросы
1.Дать понятие электропроводности, удельной и эквивалентной электропроводности. Что такое проводники первого и второго рода? Приведите примеры.
2.Поясните появление и строение двойного электрического слоя. Электродный потенциал. Уравнение Нернста.
3.Что представляет собой ряд напряжений металлов и каково его значение?
4.Каковы строение и принцип работы гальванических эле-
48
ментов? Как рассчитывается ЭДС гальванического элемента?
5.Концентрационные гальванические элементы.
6.Индикаторные электроды и электроды сравнения, принцип работы и применение.
7.Коррозия металлов и меры борьбы с ней.
8.Электролиз. Законы электролиза. Что такое выход по току? Почему введено такое понятие?
9.Поляризация и ее виды.
10.Окислительно-восстановительные реакции и потенциал в почвах.
Контрольные задачи
1.Определить электродный потенциал медного электрода, опущенного в миллимолярный (0,001 М) раствор своей соли, при 30 ºС.
2.Определить электродный потенциал цинкового электрода, опущенного в сантимолярный (0,01 М) раствор своей соли, при 15 ºС. Как измениться потенциал, при разбавлении раствора в два раза? При нагревании раствора на
20º?
3.ЭДС элемента Cu Cu2+(a = x) Cu2+(a = 1) Cu равна 0,0885 В при 25 С. Найти х.
4.Определить ЭДС гальванического элемента, составленного из железного электрода, опущенного в 0,01 М раствор
FeCl3, и оловянного электрода, опущенного в 0,05 М раствор SnCl2, при температуре 17 ºС. Написать уравнения происходящих процессов и составить схему гальванического элемента.
5.Написать реакции, протекающие в элементе
Fe Fe2+(a = 0,5) Cd2+(a = 0,03) Cd. Определить ЭДС этого элемента.
6.Определить ЭДС и константу равновесия Кравн реакции, протекающей в элементе при 20 С:
Zn Zn2+(a = 0,5) Cu2+(a = 0,8) Cu.
7.При рафинировании меди ток 50 А выделяет за 4 ч 224 г меди. Рассчитать выход по току.
8.Рассчитать ЭДС элемента Al Al3+(a=0,01) Cu2+(a = 0,1) Cu
49
при 25 С.
9.Какие продукты получаются при электролизе растворов серной кислоты, сульфата калия, сульфата цинка?
10.Написать процессы, происходящие на инертных электродах при электролизе раствора CuSO4. Определить массу вещества и объем газа (н.у.), выделяющихся на соответствующих электродах, если через раствор пропускали ток силой 2 А в течение 8 ч. Выход по току составил 70%.
Лабораторная работа № 8
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. ИССЛЕДОВАНИЕ АДСОРБЦИИ ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА (ПАВ) ИЗ РАСТВОРА НА ПОВЕРХНОСТИ ТВЕРДОГО ТЕЛА
Цель работы. Наблюдать адсорбцию ПАВ на границе раздела твердой – жидкой фаз. Построить изотерму адсорбции. Проверить применимость уравнений Фрейндлиха и Ленгмюра для данного вида адсорбции.
Основные понятия. Адсорбция, адсорбент, адсорбат, ПАВ, ПИАВ, изотерма.
Оборудование. Пять конических колб, пипетка на 10 мл, бюретка на 50 мл, пять воронок для фильтрования, фильтровальная бумага.
Реактивы. Уголь активированный или почва; 0,5 М СН3СООН; 0,1 М NaOH; фенолфталеин.
Краткие теоретические положения
Поверхностные явления (адсорбция) чрезвычайно широко распространены в природе. Там, где соприкасаются газы (или пары), жидкости и твердые тела, имеют место адсорбционные процессы. Почва хорошо поглощает (адсорбирует) не только растворенные в воде органические и минеральные соединения, но и воздух, углекислоту, пары воды, аммиак. Поглощение корнями питательных элементов из почвы начинается с их адсорбции на поверхности корневых волосков и тонких неопробковевших корней. Усвоение растением углекислого газа при фотосинтезе начинается с адсорбции СO2 на внутренней поверхности листа. Превращения поглощенных солей и углекислоты связаны с явле-
50
