
ФизХим_лаборат
.pdfсказывается внесение в почву органических, минеральных, орга- но-минеральных и бактериальных удобрений. Иными словами, растворы — наиболее распространенные системы в природе, и потому учение о растворах является важным разделом физической химии.
Буферными растворами называются водные растворы веществ, которые сохраняют определенное значение рН, практически не изменяющееся при добавлении небольших количеств кислот, солей или оснований и при разбавлении в 2–5 раз.
Способность буферных систем противостоять изменениям рН среды получила название буферного действия. По химическому составу буферные системы могут быть представлены:
-многокомпонентными растворами из слабых кислот и их солей;
-слабыми основаниями и их солями;
-смесями солей многоосновных кислот;
-растворами высокомолекулярных полиэлектролитов, таких как гуминовые кислоты, белки и др.
Пример:
аммиачный буферный раствор (основной): NH4OH + NH4Cl; фосфатный буферный раствор (рН около 7): Na2HPO4 + NaH2PO4; гидрокарбонатный буферный раствор (кислый): Н2СО3 + NaHCO3;
ацетатный буферный раствор (кислый): СН3СООН + CH3COONa. Величина рН кислой буферной системы вычисляется по фор-
муле
рН = – lgКдис(кисл) – lgСкисл + lgСсоли, |
(4.1) |
где Кдис(кисл) – константа диссоциации слабой кислоты;
Скисл и Ссоли – концентрации кислоты и соли в буферном растворе.
Величина рН основной буферной системы вычисляется по
формуле |
|
рН = 14 + lgКдис(осн) + lgСосн – lgСсоли, |
(4.2) |
где Кдис(осн) – константа диссоциации слабого основания; |
|
Сосн и Ссоли – концентрации основания и соли в буферном растворе.
В случае равных концентраций компонентов при образовании
21
буферного раствора величину концентрации можно заменить на объемы этих компонентов.
Величина рН буферного раствора зависит от константы диссоциации слабого электролита и объемных соотношений компонентов. Варьируя количеством слабого и сильного электролитов, можно приготовить буферные растворы с определенными значениями рН. Для практических целей составлены специальные таблицы рН буферных растворов при различных соотношениях компонентов для наиболее часто применяемых буферных систем и таблицы для приготовления универсальных буферных смесей. Приготовленный буферный раствор сохраняет исходное значение рН при разбавлениях и добавлениях некоторых количеств кислот или оснований.
Рассмотрим механизм буферного действия, т. е. сохранения исходного значения рН буферной среды в этих условиях на примере ацетатного буферного раствора.
1.При разбавлении буферной системы водой в равных долях уменьшаются концентрации уксусной кислоты и ацетата натрия (соли), а отношение между ними не изменяется. Поэтому величина рН буферного раствора не изменяется при разведении в 2–5 раз.
2.Добавление к ацетатной буферной системе ионов Н+ в виде раствора НСl вызывает смещение равновесия диссоциации слабо-
го электролита – СН3СООН в сторону ассоциации. Поэтому аце- тат-ионы соли взаимодействуют с добавленными ионами Н+ и
образуют дополнительное количество молекул СН3СООН до установления исходной рН:
СН3СООН 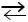 СН3СОО– + H+.
СН3СОО– + H+.
Буферное действие проявляется до тех пор, пока не израсходуются ацетат-ионы.
3.Добавление к ацетатной буферной системе (кислая среда)
гидроксильных ионов в виде раствора NaOH вызывает реакцию нейтрализации с ионами водорода, имеющимися в растворе: H+ + OH – 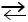 H2O, что приводит к уменьшению равновесной концентрации водородных ионов. Поэтому происходит смещение в ионизационном равновесии уксусной кислоты в сторону диссоциации до восстановления исходной рН:
H2O, что приводит к уменьшению равновесной концентрации водородных ионов. Поэтому происходит смещение в ионизационном равновесии уксусной кислоты в сторону диссоциации до восстановления исходной рН:
22
СН3СООН 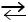 СН3СОО– + H+.
СН3СОО– + H+.
Буферное действие будет проявляться до тех пор, пока не продиссоциируют все молекулы уксусной кислоты.
Таким образом, за пределами некоторых количеств вводимых веществ с кислыми или основными свойствами происходит резкое изменение рН буферной системы, что указывает на прекращение буферного действия.
Буферное действие количественно может выражаться в виде буферной ёмкости (β). Это количество эквивалентов сильной кислоты или щелочи, которое необходимо добавить к 1 л буферной системы, чтобы изменить величину рН на единицу:
|
СТ |
VT |
, |
(4.3) |
||
VБ |
рН |
|||||
|
|
|
||||
где СТ – нормальная концентрация добавленной сильной кислоты или щелочи;
VT – объем добавленной сильной кислоты или щелочи, мл; VБ – объем буферной системы, мл;
рН – величина изменения рН буферной системы при титровании, которая может колебаться от 0,5 до 1,0.
Величина буферной ёмкости зависит от концентрации компонентов раствора и соотношения этих концентраций. С увеличением концентрации компонентов буферная емкость возрастает. Наибольшей величиной буферной емкости обладают буферные системы при равных концентрациях компонентов:
Скисл (или Сосн ) = Ссоли.
Ход работы
Опыт 1. Приготовление буферных систем
Втри стаканчика отмерить 0,1 н. раствора уксусной кислоты
иуксуснокислого натрия в количествах, указанных в таблице 3.
Таблица 3 – Строение и свойства исследуемых буферных систем
Номера |
Объем |
Объем |
Объем буфер- |
рН |
рН |
стаканчика |
CH3COOН, мл |
CH3COONa, мл |
ного р-ра, мл |
теорет. |
экспер. |
1 |
1,5 |
13,5 |
15 |
|
|
2 |
7,5 |
7,5 |
15 |
|
|
3 |
13,5 |
1,5 |
15 |
|
|
23
Вычислить величину рН каждой буферной системы и внести в таблицу 3. Определить величины рН всех буферных систем с помощью рН-метра (потенциометрический метод).
Совпали ли теоретически рассчитанные значения рН буферных растворов с экспериментально измеренными?
Опыт 2. Разбавление буферного раствора
Взять буферный раствор в стаканчике 2 (рН известна), разбавить водой в два раза (15 мл Н2О), размешать и измерить величину рН на рН-метре. Затем разбавить исходную буферную систему в три раза (еще 15 мл Н2О), измерить величину рН.
Таблица 4 – Влияние разбавления на буферную систему
Исходное рН |
рН после разбавления |
||
1:1 |
1:2 |
||
|
|||
|
|
|
|
Изменилось ли значение рН буферного раствора и почему?
Опыт 3. Действие кислот и щелочей на буферные растворы
Взять стаканчик 1 из опыта 1, содержащий раствор с наибольшей величиной рН, прилить 5 капель 0,1 н. НСl, размешать, измерить величину рН и сравнить ее с исходным значением.
Взять стаканчик 3 из опыта 1, содержащий раствор с наименьшей величиной рН, прилить 5 капель 0,1 н. NaOH, размешать, измерить величину рН и сравнить ее с исходным значением.
Аналогично провести эксперименты с 15 мл Н2О с добавлением равных количеств капель растворов НСl и NaOH. Данные занести в таблицу 5 и сделать выводы.
Таблица 5 – Свойства буферных растворов
Исследуемый |
Исходное рН |
рН после добавле- |
рН после добавле- |
|
раствор |
ния НСl |
ния NaOH |
||
|
||||
Раствор 1 |
|
|
– |
|
Раствор 3 |
|
– |
|
|
Н2О |
|
|
|
Изменились ли значения рН буферных растворов после при-
24
бавления кислоты и щелочи? Сравнить эти изменения с чистой водой.
Опыт 4. Измерение буферной ёмкости
Приготовить в двух стаканчиках буферные растворы объемом по 15 мл в следующих соотношениях компонентов:
1-й раствор – 11 мл 0,1 н. СН3СООН и 4 мл 0,1 н. CH3COONa; 2-й раствор – 4 мл 0,1 н. CH3COOH и 11 мл 0,1 н. CH3COONa.
Измерить рН-метром величины рН, затем приливать по 1 мл из бюретки 0,1 н. раствор NaOH, перемешивать и измерять величины рН до тех пор, пока значение рН не увеличится на 0,5 и более, но не превысит 1,0 от исходного значения рН. Вычислить величины буферных ёмкостей и сделать выводы относительно зависимости величины ёмкости от концентрации компонентов буферной системы.
Таблица 6 – Определение буферной емкости буферных растворов
Растворы |
Исходное |
Объем прили- |
рН после при- |
Буферная емкость |
|
рН |
той NaOH, мл |
ливания NaOH |
β, мэкв/л |
||
|
|||||
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
В каком растворе буферная емкость выше и почему?
Опыт 5. Измерение буферных свойств почвенной вытяжки
Взять 5 г почвы, поместить в колбу с плотной пробкой и залить 200 мл воды. Смесь почвы и воды встряхивать 5–10 мин, дать отстояться и профильтровать через бумажный фильтр. Взять 50 мл фильтрата, перенести в стаканчик и измерить рН на рН- метре. Провести измерение буферной емкости аналогично предыдущему опыту. В случае кислой среды – титрование провести 0,1 н. раствором NaOH, при щелочной среде – 0,1 н. раствором HCl и вычислить буферную емкость.
Таблица 7 – Буферная емкость почвенной вытяжки
Тип |
Исходное |
Объем прилитого |
рН после |
Буферная ем- |
почвы |
рН |
электролита, мл |
приливания |
кость β, мэкв/л |
|
|
|
|
|
Высоко ли значение буферной емкости почвенной вытяжки
25
по сравнению с растворами предыдущего опыта? Вывод. Выводы делать после каждого опыта.
Контрольные вопросы
1.Дать определение буферных систем, буферного действия. Привести примеры по составу буферных растворов.
2.Что такое ионное произведение воды, водородный и гидроксильный показатели?
3.Привести формулы для расчета рН кислых и основных буферных растворов.
4.Пояснить механизм буферного действия при введении Н+ и ОН– -ионов.
5.Дать определение буферной емкости, записать формулу для ее вычисления по результатам измерения.
6.Как можно повлиять на величину буферной емкости растворов?
7.Биологическое значение буферных систем почвенных растворов, соков растений, крови.
8.Какими методами определяется рН раствора? Необходимо ли при этом поддерживать постоянную температуру и почему?
9.Какова роль концентрации ионов Н+ в биологических процессах?
Контрольные задачи
(Константы диссоциации веществ даны в приложении 3)
1.Вычислить рН буферного раствора, содержащего 60 мл 0,05 н. раствора NH4Cl и 40 мл 0,1 н. раствора NH4OН.
2.Вычислить рН раствора, если в 2 л раствора содержится 23 г НСООН и 21 г НСООК.
3.Определить [H+] и рН раствора, состоящего из слабого основания (пиридина) и его хлорида, если концентрации
компонентов в растворе соответственно равны 0,1 и 0,06 моль/л, Кдис(пиридина) = 1,6∙10–5.
4.Вычислить рН буферного раствора, содержащего по 20 мл 0,01 н. растворов NH4Cl и NH4OН.
5.Определить объем 0,1 н. раствора уксусной кислоты, который следует прибавить к 40 мл 0,1 н. раствора ацетата
26
натрия, чтобы получить буферный раствор со значением
рН = 5,05.
6.Вычислить рН буферного раствора, содержащего в 0,5 л раствора 1,5 моля гидроксида аммония и 2,5 моля хлорида аммония.
7.Рассчитать рН ацетатного буферного раствора, в 700 мл которого содержится 0,2 моля уксусной кислоты и 0,3 моля ацетата натрия.
8.При добавлении к 50 мл ацетатного буферного раствора 10 мл 0,01 н. раствора NaOH рН изменился на 0,8. Определить буферную емкость данного раствора.
9.Какой объем децимолярного раствора HCl необходимо прилить к 60 мл аммиачного буфера, чтобы рН изменился на 1 (буферная емкость составляет 5 мэкв/л)?
10.Как изменится рН гидрокарбонатного буферного раствора, если к 100 мл его с β = 4 мэкв/л добавить 5 мл 0,1 н. раствора NaOH?
ЛАБОРАТОРНАЯ РАБОТА № 4
ИЗУЧЕНИЕ КОЛЛИГАТИВНЫХ СВОЙСТВ РАЗБАВЛЕННЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Цель работы. Ознакомиться с основными свойствами растворов. Определить «кажущуюся» степень диссоциации сильного электролита.
Основные понятия. Раствор, степень диссоциации, изотонический коэффициент.
Оборудование. Электроплитка, термометры, колба, пробка с обратным холодильником, кристаллизатор, весы.
Реактивы. NaCl тв.
Краткие теоретические положения
Раствором называется однофазная система, образованная двумя или более компонентами и способная в известных пределах к непрерывному изменению состава.
Свойства растворов, которые не зависят от природы растворенного вещества, а определяются числом частиц в растворе,
называются коллигативными свойствами. К
27
ним относят осмотическое давление, понижение давления насыщенного пара над раствором, а также повышение температуры кипения и понижение температуры замерзания растворов.
Если к растворителю с температурой кипения T0 прибавить нелетучее вещество, то давление пара понизится. Чтобы этот раствор закипел, т.е. чтобы давление пара над раствором стало равным внешнему давлению, его следует нагреть до более высокой температуры T1, чем чистый растворитель. Повышение температуры кипения Ткип = T1 - T0 можно рассчитать по закону Рауля, согласно которому
Ткип = Eэб∙Сm, |
(5.1) |
где Ткип – повышение температуры кипения; |
|
Сm – моляльная концентрация раствора; Eэб – эбулиоскопическая константа.
Закон Рауля для случая замерзания раствора записывается
аналогично: |
|
Тзам = Eкр∙Сm, |
(5.2) |
где Eкр - криоскопическая константа.
Eэб и Eкр – коэффициенты пропорциональности, численное значение которых зависит от природы растворителя.
В таблице 8 приведены значения этих констант для некоторых растворителей.
Таблица 8 – Значения криоскопической и эбулиоскопической констант некоторых растворителей
Растворитель |
Eкр |
Eэб |
Растворитель |
Eкр |
Eэб |
Вода |
1,85 |
0,52 |
Ацетон |
2,40 |
1,48 |
Бензол |
5,10 |
2,57 |
Уксусная кислота |
3,90 |
3,10 |
Циклогексан |
20,20 |
2,75 |
Фенол |
7,30 |
3,60 |
Законы Рауля справедливы для растворов неэлектролитов. Если растворенное вещество является электролитом и распадается в растворе на ионы, то число частиц в растворе увеличивается. Поэтому в растворах электролитов понижение давления насыщенного пара, понижение температуры замерзания, повышение температуры кипения больше, чем в растворе неэлектролитов с той же моляльной концентрацией.
28
Для разбавленных растворов электролитов закон Рауля принимает вид
Ткип = i∙Eэб∙Сm ; Тзам = i∙Eкр∙Сm, (5.3)
где i – изотонический коэффициент Вант-Гоффа.
По этим уравнениям для слабых электролитов можно вычислить изотонический коэффициент i, следовательно, и степень
диссоциации α, так как |
|
|
|||
|
i 1 |
|
, |
(5.4) |
|
n 1 |
|||||
|
|
|
|||
где n – число частиц, на которые распадается электролит при диссоциации.
Для сильных электролитов можно вычислить только «кажущуюся» степень диссоциации αкаж, так как степень диссоциации сильных электролитов в разбавленных растворах равна 1 и, казалось бы, что i = n. Но в действительности i < n, так как между ионами в растворе существует электростатическое взаимодействие.
Ход работы
Перед началом работы рассчитать и приготовить 5- и 1- моляльные растворы поваренной соли.
Опыт 1. Определение температуры кипения воды и 5- моляльного раствора поваренной соли
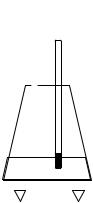
Задание выполняется на установке (рисунок 5).
1 |
|
|
|
|
|
|
|
|
|
2 |
|
Рисунок 5. Схема установки для определения |
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
температуры кипения растворов: |
|
|
|
|
|
|
|
||
3 |
|
1 |
– обратный холодильник; |
||||
|
|
|
|
|
|
2 |
– термометр; |
|
|
|
|
|
|
3 |
– тонкостенная коническая колба; |
|
|
|
|
|
|
4 |
– электроплитка |
|
|
|
|
|
4 |
||
|
|
|
|
|
|||
В колбу налить 100 мл дистиллированной воды и бросить несколько кусочков битого стекла или фарфора для равномерного кипения раствора. Включить электроплитку. Проследить за процессом нагрева воды до кипения. Через 2-3 мин после начала ки-
29
пения записать температуру, которую показывает термометр. Измеренную температуру кипения воды сопоставить с таковой при нормальных условиях.
Аналогично определить температуру кипения 5-моляльного раствора поваренной соли. По полученным данным рассчитать «кажущуюся» степень ионизации поваренной соли в воде. Данные занести в таблицу 9.
Таблица 9 – Эбулиоскопическое определение кажущейся степени диссоциации соли
Ткип (Н2О) |
Ткип (р-ра NaCl) |
∆Ткип |
i |
αкаж |
|
|
|
|
|
Опыт 2. Определение температуры замерзания воды и 1- моляльного раствора поваренной соли
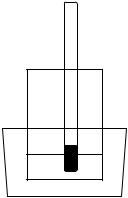
Задание выполняется на установке (рисунок 6).
3
Рисунок 6. Схема установки для определения 2 температуры замерзания растворов:
1 – кристаллизатор с охлаждающей смесью;
2 – стакан с водой или раствором;
13 – термометр
Вкристаллизаторе приготовить охлаждающую смесь, состоящую из снега (льда) и поваренной соли в пропорциях: 3-5 столовых ложек соли на 5-8 ложек снега (льда). В стакан налить 10 мл дистиллированной воды и поместить его в охлаждающую смесь. Помешивая воду термометром (осторожно, чтобы не разбить термометр), определить температуру замерзания воды.
Температурой замерзания считать ту, которую покажет термометр после появления первых кристалликов льда в замораживаемой жидкости. Измеренную температуру замерзания воды сопоставить с таковой при нормальных условиях.
Аналогично определить температуру замерзания 1- моляльного раствора поваренной соли. По полученным данным
30
