
- •Тема 9.2. Переваривание белков в желудке и кишечнике, всасывание аминокислот
- •Тема 9.3. Трансаминирование и дезаминирование аминокислот
- •Тема 9.4. Обмен аммиака: источники, превращение в тканях
- •Тема 9.5. Орнитиновый цикл и его биологическая роль
- •Тема 9.6. Гипераммониемия и ее причины
- •Тема 9.8. Биосинтез заменимых аминокислот
- •Тема 9.10. Обмен метионина. Реакции трансметилирования
- •Тема 9.11. Обмен фенилаланина, тирозина и гистидина в разных тканях
- •Тема 9.12. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •Тема 9.13. Биогенные амины: синтез, инактивация, биологическая роль
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •4. Нарушения переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •Тема 12.2. Обезвреживание продуктов катаболизма аминокислот в кишечнике
- •8.1. Распад белков и аминокислот
- •1. Особенности обмена метионина
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
Тема 9.10. Обмен метионина. Реакции трансметилирования
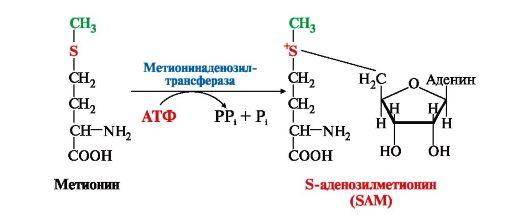
1. Метионин - незаменимая аминокислота, необходимая для синтеза белков. Мет-тРНКмет участвует в инициации процесса трансляции каждого белка. Как и многие другие аминокислоты, метионин подвергается транс- и дезаминированию. Особая роль метионина заключается в том, что метильная группа этой аминокислоты используется для синтеза целого ряда соединений в реакциях трансметилирования. Основным донором метильной группы является S-аденозилметионин (SAM) - активная форма метионина, который присутствует во всех типах клеток и синтезируется из метионина и АТФ под действием фермента метионин-аденозилтрансферазы:
|
|
 Структура
-S+-CH3 в
SAM является нестабильной, метильная
группа легко отщепляется, что определяет
высокую способность ее к переносу на
другие соединения в реакциях
трансметилирования (рис. 9.20).
Структура
-S+-CH3 в
SAM является нестабильной, метильная
группа легко отщепляется, что определяет
высокую способность ее к переносу на
другие соединения в реакциях
трансметилирования (рис. 9.20).
 Рис.
9.20. Метаболизм метионина
Рис.
9.20. Метаболизм метионина
В реакциях трансметилирования SAM превращается в S-аденозилгомо- цистеин (SAr), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина В12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата (см. рис. 9.20).
2. Метионин и серин необходимы для синтеза условно заменимой аминокислоты цистеина, причем в этом процессе метионин является донором атома серы. Цистеин образуется непосредственно из гомоцистеина в ходе двух реакций, которые происходят с участием пиридоксальфосфата (см. рис. 9.20). Генетический дефект этих ферментов приводит к нарушению использования гомоцистеина в организме и превращению его вгомоцистин.
Гомоцистин может накапливаться в крови и тканях, выделяться с мочой, вызывая гомоцистинурию. Заболевание сопровождается эктопией (смещением) хрусталика глаза, катарактой, остеопорозом, умственной отсталостью (-50% больных). Причиной заболевания могут служить как наследственные нарушения обмена гомоцистеина, так и гиповитаминоз фолиевой кислоты или витаминов В12 и
SАМ как донор метильной группы участвует в синтезе многих веществ (лецитина, адреналина, карнитина, ацетилхолина, креатина и др.), а также в инактивации нормальных метаболитов и обезвреживании токсических веществ в печени.
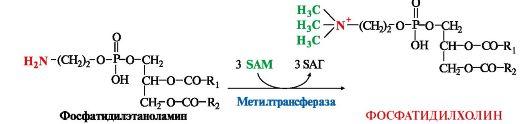
3. Синтез фосфатидилхолина (лецитина) наиболее активно протекает в печени, которая использует лецитин на построение мембран и формирование липопротеинов. Реакцию катализирует фосфатидилэтаноламинтрансметилаза.
|
|
 В
клетки других тканей фосфатидилхолин
доставляется в составе ЛПНП. Особую
роль лецитин играет в метаболизме ЛПВП
(см. модуль 8).
В
клетки других тканей фосфатидилхолин
доставляется в составе ЛПНП. Особую
роль лецитин играет в метаболизме ЛПВП
(см. модуль 8).
4. Синтез карнитина - переносчика ацильной группы в митохондрии - происходит путем метилирования γ-аминомасляной кислоты с участием SAM:
 5.
Синтез креатина происходит
с использованием трех аминокислот:аргинина,
глицина и метионина. Процесс
начинается в почках, в реакцию вступают
аргинин и глицин. Образующийся
гуанидинацетат поступает затем в
печень, где подвергается метилированию
с участием SAM и превращается в креатин.
Из печени креатин транспортируется в
мышцы и головной мозг.
5.
Синтез креатина происходит
с использованием трех аминокислот:аргинина,
глицина и метионина. Процесс
начинается в почках, в реакцию вступают
аргинин и глицин. Образующийся
гуанидинацетат поступает затем в
печень, где подвергается метилированию
с участием SAM и превращается в креатин.
Из печени креатин транспортируется в
мышцы и головной мозг.
Креатин в клетках превращается в креатинфосфат - макроэргическое соединение, являющееся резервной формой энергии в мышечной и нервной тканях. Содержание креатинфосфата в покоящейся мышце в восемь раз выше, чем АТФ. Эту реакцию катализирует ферменткреатинкиназа (рис. 9.21).
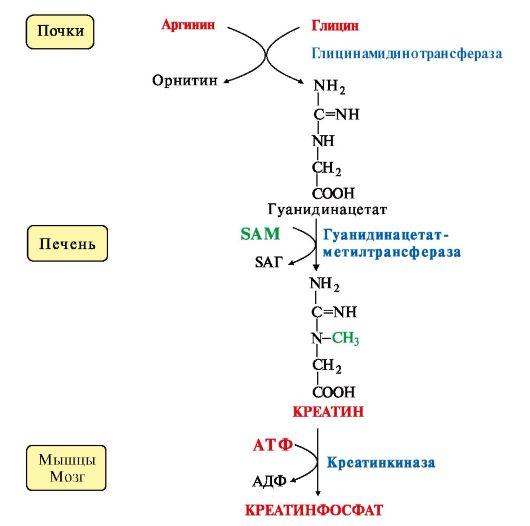 Рис.
9.21. Схема синтеза и использования
креатина
Рис.
9.21. Схема синтеза и использования
креатина
Креатинфосфат играет важную роль в обеспечении работающей мышцы энергией в начальный период физической работы. В работающей мышце концентрация АТФ некоторое время остается постоянной, а концентрация креатинфосфата быстро снижается. Часть образовавшегося креатина и креатинфосфата с постоянной скоростью превращается в креатинин, который выводится с мочой (норма - 1-2 г/сут, или 8,8-17,6 ммоль/л)
При уменьшении массы мышц вследствие длительного отрицательного азотистого баланса, при состояниях, ведущих к атрофии мышц,выделение креатинина снижается (голодание, острые инфекции, сахарный диабет, гипертиреоз и т.д.). Определение содержания в крови креатина и креатинина используется для диагностики заболеваний, а также как показатель эффективности работы мышц в спортивной медицине.
