
- •Тема 9.2. Переваривание белков в желудке и кишечнике, всасывание аминокислот
- •Тема 9.3. Трансаминирование и дезаминирование аминокислот
- •Тема 9.4. Обмен аммиака: источники, превращение в тканях
- •Тема 9.5. Орнитиновый цикл и его биологическая роль
- •Тема 9.6. Гипераммониемия и ее причины
- •Тема 9.8. Биосинтез заменимых аминокислот
- •Тема 9.10. Обмен метионина. Реакции трансметилирования
- •Тема 9.11. Обмен фенилаланина, тирозина и гистидина в разных тканях
- •Тема 9.12. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •Тема 9.13. Биогенные амины: синтез, инактивация, биологическая роль
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •4. Нарушения переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •Тема 12.2. Обезвреживание продуктов катаболизма аминокислот в кишечнике
- •8.1. Распад белков и аминокислот
- •1. Особенности обмена метионина
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
Тема 12.2. Обезвреживание продуктов катаболизма аминокислот в кишечнике
Аминокислоты, не всосавшиеся в клетки кишечника, используются микрофлорой толстой кишки. Ферменты микроорганизмов расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие, токсичные для организма соединения. Этот процесс называют гниением белков в кишечнике. В основе его лежат реакции декарбоксилирования и дезаминирования аминокислот. Продукты гниения частично всасываются в нижних отделах тонкой кишки и с током крови поступают в печень и другие ткани, где могут оказывать токсическое действие.
|
|
1. Образование и обезвреживание и-крезола и фенола. Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол или крезол путем отщепления боковых цепей (рис. 12.3).
Часть этих соединений попадает в кровоток и по воротной вене поступает в печень, где подвергаются конъюгации двух видов:
• с сульфатом в составе (ФАФС),
• с глюкуроновой кислотой в составе УДФ-глюкуроната.
Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфераза (рис. 12.4).
 Рис.
12.3. Катаболизм тирозина под действием
бактерий:
Рис.
12.3. Катаболизм тирозина под действием
бактерий:
Е - бактериальные ферменты
 Рис.
12.4. Конъюгация фенола и крезола с ФАФС:
Рис.
12.4. Конъюгация фенола и крезола с ФАФС:
Е - сульфотрансфераза
Конъюгация фенола и крезола с глюкуроновой кислотой происходит при участии фермента УДФ-глюкуронилтрансферазы. Продукты конъюгации - фенолглюкуронат и крезолглюкуронат хорошо растворимы в воде и выводятся с мочой. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом в моче обнаруживается при усилении гниения белков в кишечнике.
2. Образование и обезвреживание индола и скатола. В кишечнике из аминокислоты триптофан микроорганизмы образуют индол и скатол. Бактерии отщепляют карбоксильную и α-амино-группу триптофана, оставляя нетронутым гетероциклический радикал. Индол образуется в результате отщепления бактериями боковой цепи с образованием серина или аланина
(рис. 12.5).
 Рис.
12.5. Катаболизм триптофана под действием
бактерий:
Рис.
12.5. Катаболизм триптофана под действием
бактерий:
Е - бактериальные ферменты
Скатол и индол обладают гидрофобными свойствами и обезвреживаются в печени в два этапа:
- сначала в результате микросомального окисления они приобретают гидроксильную группу, индол превращается в индоксил;
- затем индоксил вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана. Анализ последнего в моче использовали для оценки детоксикационной функции печени (рис. 12.6).
|
|
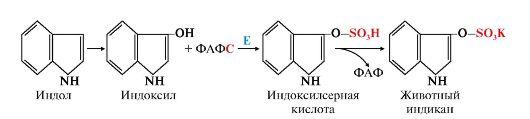 Рис.
12.6. Участие сульфотрансферазы в
обезвреживании индола:
Рис.
12.6. Участие сульфотрансферазы в
обезвреживании индола:
Главный путь экскрекции азота у млекопитающих происходит в составе мочевины, представляющей собой инертное, водорастворимое, нетоксичное вещество:

Как отмечалось ранее, мочевина синтезируется в печени, затем поступает в кровь и экскретируется почками. На долю мочевины приходится 80-90% выделяемого азота у человека при сбалансированном режиме питания.
Орнитиновый цикл синтеза мочевины. В начале XX в. в печени был открыт гидролитический фермент аргиназа, отщепляющий гуанидиновую группу от аминокислоты аргинина. В процессе гидролиза аргинина образуется мочевина и аминокислота орнитин, не входящая состав белка:

Спустя 30 лет Г. Кребс и К. Гензелайт вывели уравнение реакции синтеза мочевины и предположили существование циклического процесса, в котором орнитин, образующийся при распаде аргинина, вновь регенерируется в аргинин. Дальнейшие исследования подтвердили циклический характер механизма биосинтеза мочевины. Впоследствии были детализированы отдельные реакции цикла, ферментные системы, энергетика и регуляция этого процесса. Так был окончательно расшифрован знаменитый цикл синтеза мочевины, получивший название орнитинового цикла Кребса-Гензелайта.
Механизм орнитинового цикла. Цикл мочевинообразования происходит в три этапа, включающие пять реакций, каждая из которых катализируется отдельным ферментом:
– синтез аминокислоты цитруллина (две реакции);
– синтез аминокислоты аргинина (две реакции);
– образование мочевины (одна реакция).
Суммарную реакцию синтеза мочевины можно представить следующим образом:
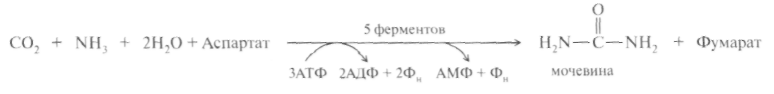
Из реакции следует, что:
– непосредственных источников азота мочевины – два: аммиак и NH2-acпартата, который превращается в безазотистое соединение фумаровую кислоту;
– источником углерода мочевины является СO2, который можно представить как акцептор азота;
– процесс сильно эндэргонический: на синтез одной молекулы мочевины затрачивается три молекулы АТФ.
Первый этап – синтез аминокислоты цируллина протекает в митохондриях печени, где аммиак обезвреживается путем связывания с СO2 и образования кар-бамоилфосфата при участии фермента карбамоилфосфатсинтетазы I (КФС I):

Реакция является эндэргонической и сопровождается гидролизом двух молекул АТФ.
В настоящее время в клетках животных выделены два типа карбамоилфос-фатсинтетаз (КФС): аммиак-зависимая КФС I, локализованная в митохондриях печени и катализирующая синтез КФ в процессе образования мочевины, иглутамин-зависимая КФС II, широко распространенный фермент цитозоля клеток различных тканей, катализирующий образование КФ в процессе синтеза пиримидиновых оснований (гл. 26).
КФС I – регуляторный фермент синтеза мочевины, регуляция осуществляется по аллостерическому механизму, ингибитором фермента является аргинин. В состав КФС I входит биотин (витамин Н), максимальная активность фермента проявляется в присутствии N-ацетилглутаминовой кислоты – активатора КФС I.
Затем следует реакция конденсации образовавшегося карбамоилфосфата и аминокислоты орнитина, катализируемая ферментом орнитинкарбамоил-трансферазой (ОКТФ); в ходе реакции образуется цитруллин и регенерирует молекула неорганического фосфата:

ОКТФ в митохондриях печени ассоциирована с КФС I, что помогает избежать гидролиза карбамоилфосфата и способствует необратимости реакции образования цитруллина. Так же как и первый фермент, ОКТФ выполняет ре-гуляторную функцию в процессе синтеза мочевины.
Второй этап – синтез аргинина из цитруллина и аспартата (донора аминогруппы) протекает уже в цитоплазме печени и включает две реакции.
1. Конденсация цитруллина и аспарагиновой кислоты с образованием ар-гининосукцината катализируется аргининосукцинатсинтетазой:

2. Аргининосукцинат распадается на аргинин и фумаровую кислоту при участии фермента аргининосукцинатлиазы:

На третьем этапе аргинин расщепляется на мочевину и орнитин под действием фермента аргиназы:

Необходимо учесть, что аргиназа содержится в печени только тех организмов, которые экскретируют мочевину как основной и конечный продукт азотистого обмена. Очень незначительное количество аргиназы выявлено в почках и мозговой ткани. Аргиназа относится к аллостерическим регуляторным ферментам, ее ингибитором является орнитин и лизин.
Таким образом, орнитиновый цикл мочевинообразования может быть представлен в следующем виде (рис. 24.10).

Процесс синтеза мочевины является необратимым, поскольку сопровождается значительным уменьшением свободной энергии ( G = -40 кДж). Примечательна компартментализация цикла мочевины и связанных с ним реакций. Так, образование аммиака в реакциях трансдезаминирования, его включение в карбамоилфосфат и синтез цитруллина происходят в митохонд-риальном матриксе, а все последующие реакции (второй и третий этапы) – в цитозоле клетки печени.
Важную роль в синтезе мочевины имеет образование фумарата, поскольку он связывает между собой орнитиновый цикл мочевины с циклом трикарбоновых кислот (рис. 24.11).

Как видно из рис. 24.11, фумарат под действием ферментов цикла трикар-боновых кислот превращается в оксалоацетат. Последний имеет ключевое значение, поскольку существует несколько возможных путей его превращения: 1) он может подвергаться трансаминированию в аспартат; 2) превращаться в глюкозу по пути глюконеогенеза; 3) при конденсации оксалоацетата с ацетил-КоА образуется цитрат, т. е. могут инициироваться реакции цикла три-карбоновых кислот. Таким образом, между обоими циклами имеются сложные взаимосвязи, определяющие скорость реакций, зависящую от энергетических потребностей клетки и концентраций конечных продуктов метаболизма.
Нарушения синтеза мочевины. Метаболические нарушения мочеви-нообразования могут быть обусловлены недостатком любого из пяти ферментов, катализирующих в печени синтез мочевины. Как указывалось ранее, ско-ростьлимитирующими стадиями являются реакции, катализируемые карбамо-илфосфатсинтетазой и орнитинкарбамоилтрансферазой (первый этап), а также аргиназой (третий этап). Все нарушения синтеза мочевины вызывают аммиачное отравление, клиническими симптомами которого являются рвота, нарушение координации движения, раздражительность, сонливость и умственная отсталость. Лечение большинства подобных заболеваний основано прежде всего на ограничении белка в диете; пищу следует принимать небольшими порциями, чтобы избежать быстрого повышения уровня аммиака. Большинство известных заболеваний, приводящих к нарушению мочевинообразо-вания, являются наследственными.
Обмен дикарбоновых аминокислот
Классическими работами советских ученых А.Е. Браунштейна и С.Р. Мар-дашева и американского биохимика А. Майстера доказана роль дикарбо-новыхаминокислот (глутаминовой и аспарагиновой кислот и их амидов – глутамина иаспарагина) в интеграции азотистого обмена в организме. Система дикарбоновых аминокислот, к которой относят также соответствующие α-кетокислоты, теснейшим образом связана не только с азотистым метаболизмомв целом, но и с обменом липидов и углеводов. Ранее отмечалась особая роль дикарбоновых аминокислот и ферментов, катализирующих их превращения, в перераспределении азота в организме, дезаминировании и синтезе природныхаминокислот (реакции трансде-заминирования и трансреаминирования), в образовании конечных продуктов белкового обмена – синтезе мочевины.
Основные катаболические пути превращения дикарбоновых аминокислот и их амидов могут быть представлены в виде следующих реакций:
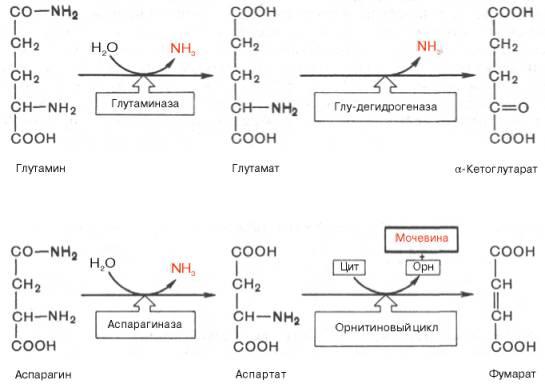
Аспарагиновая кислота принимает непосредственное участие в орни-тиновом цикле мочевинообразования, вреакциях трансаминирования и биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содержащейся в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена.
Глутаминовая кислота, являющаяся гликогенной и заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо участия в транспорте аммиака и регуляции кислотно-щелочного равновесия, глутамин – это незаменимый источник азота в ряде синтезов, в частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, амино-сахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетил-глутамина) у человека и человекообразных обезьян, а также в синтезе
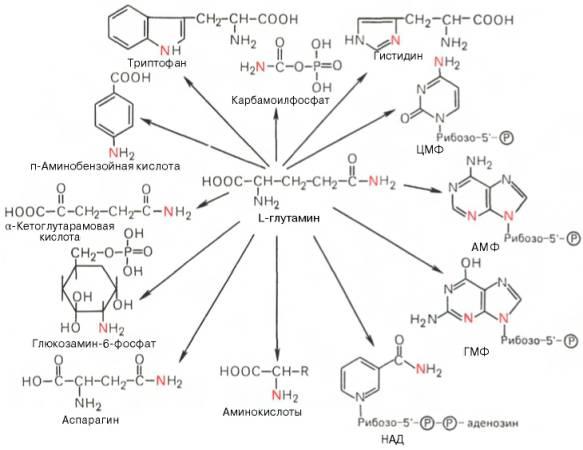
Рис. 12.8. Использование амидного азота глутамина для синтеза различных соединений в живых организмах.
витамина фолиевой кислоты (птероилглутаминовая кислота). На рис. 12.8 суммированы реакции синтеза рядавеществ, в которых амидный азот глутамина выполняет специфическую роль, незаменимую азотом другихаминокислот.
Глутамин и аспарагин оказались, кроме того, эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани; они не могут быть заменены ни друг другом, ни соответствующими дикарбоновыми аминокислотами. Это свидетельствует о том, что в условиях выращивания клеток в культуре тканинекоторые клетки теряют способность синтезировать эти амиды синтетазным или трансаминазным путем.
В лаборатории Майстера получены доказательства, что глутамин и аспарагин в животных тканях подвергаютсясочетанному трансаминиро-ванию и дезамидированию под влиянием специфических трансаминаз амидов (глутаминтрансаминазы и аспарагинтрансаминазы) и неспецифической ω-амидазы:

Таким образом, в реакции переноса участвует α-аминогруппа аспа-рагина, а не амидная группа, как предполагали раньше; в то же время амидная группа промежуточного соединения α-кетосукцинамовой кислоты в дальнейшем освобождается в процессе гидролиза в виде аммиака. Трансаминирование – обратимый процесс, поэтому лимитирующими факторами в синтезе аспарагина (и глутамина) являются ω-амиды оксалоаце-тата и α-кетоглутаровой кислоты, синтез которых в животных тканях пока не доказан.
Глутаминовая кислота является одним из немногих соединений, помимо глюкозы, которые служат энергетическим материалом для ткани мозга. Ранее была отмечена высокая активность в ткани мозга глутаматдекар-боксилазы, катализирующей превращение глутамата в γ-аминомасляную кислоту (ГАМК). Дальнейшее последовательноеокисление ГАМК включает трансаминирование с образованием полуальдегида янтарной кислоты, окисление вянтарную кислоту и, наконец, окисление через ЦТК.
В обеих реакциях (декарбоксилирование глутамата и трансаминиро-вание ГАМК) участвует пиридоксальфосфат, который оказался более прочно связанным с ГАМК-трансаминазой. ГАМК оказывает тормозящий эффект на синаптическую передачу в ЦНС, поэтому судорожные явления, наблюдаемые при недостаточности витамина В6, могут быть связаны со снижением образования ГАМК в глутаматдекарбоксилазной реакции. У животных судороги могут быть вызваны также введением изониазида, который связывает альдегидную группу кофермента илиантивитаминов В6 , в частности метоксипиридоксина. ГАМК – естественно встречающийся «транквилизатор», поэтому одним из путей повышения ее концентрации в ЦНС является введение веществ, оказывающих тормозящее действие на ГАМК-трансаминазу, которая эффективно устраняет ГАМК.
В последние годы у бактерий и растений (но не в животных тканях) открыт совершенно новый путь синтезаглутаминовой кислоты из α-кето-глутаровой кислоты и глутамина. Этот путь, получивший название глута-матсинтазного цикла, включает две сопряженные с распадом АТФ необратимые реакции, ведущие к усвоению (ассимиляции) аммиака:

Первую стадию (а) катализирует глутаминсинтетаза, которая имеется в клетках животных, вторую (б) –глутаматсинтаза, открытая только у растений, грибов и микроорганизмов. Обе стадии могут быть представлены вместе с обратимо действующей глутаматдегидрогеназной реакцией (в) в виде следующей схемы:

Оказалось, что при низких концентрациях аммиака, характерных для растений и микроорганизмов, реакциипротекают преимущественно по глутаматсинтазному циклу, а при высоких его концентрациях, свойственных тканямживотных,– по глутаматдегидрогеназному пути; в обоих случаях синтезируется глутамат.
