
- •Методические рекомендации для студентов к лабораторному практикуму
- •Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
- •1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
- •Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •Тема: Тепловые эффекты химических реакций. Термодинамические характеристики химических и биохимических процессов
- •Практическая часть
- •Экспериментальная часть Лабораторная работа. Определение стандартной теплоты (энтальпии) реакции нейтрализации
- •Экспериментальные данные и результаты измерений
- •Тема: Кинетика химических и биохимических реакций. Химическое равновесие
- •1. Основные понятия химической кинетики:
- •Практическая часть
- •Экспериментальная часть
- •Зависимость скорости разложения от ее концентрации //
- •Тема: Коллигативные свойства растворов неэлектролитов и электролитов
- •1. Вода как универсальный биологический растворитель.
- •2. Коллигативные свойства растворов (определение, виды).
- •2. Экспериментальная часть
- •Криоскопическим методом
- •Экспериментальные данные и результаты измерений
- •Тема: Протолитические равновесия и процессы. Водородный показатель. Гидролиз
- •1. Электролиты сильные и слабые.
- •3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
- •Экспериментальная часть
- •Реакция среды при гидролизе солей
- •Тема: Буферные системы, классификация и механизм действия
- •2. Экспериментальная часть
- •Ацетатного буферного раствора по кислоте и щелочи
- •Экспериментальные данные и результаты измерений
- •Тема: Физикохимия дисперсных систем. Растворы вмс
- •Практическая часть
- •Экспериментальная часть
Тема: Буферные системы, классификация и механизм действия
Цель темы: Приобретение системных знаний по кислотно-основным буферным растворам. Освоение методов приготовления и расчета рН растворов с буферными свойствами, а также экспериментального определения буферной ёмкости. Овладения навыками прогнозирования свойств буферных растворов на основе их параметров и химического состава.
Исходный уровень. Студент должен знать из довузовского курса химии: «Теорию электролитической диссоциации Аррениуса (ТЭД)» и из курса биологии: «Химическая организация клетки».
Основные учебно-целевые вопросы:
Буферные системы (определение).
1.1. Классификация (кислотные, основные, амфотерные) и основные компоненты буферных растворов.
1.2.Уравнения Гендерсона-Гассельбаха (вывод формул). Влияние разведения и концентрирование на величину рН буферов.
1.3. Механизм действия ацетатного и аммонийного буферных систем.
1.4. Буферная ёмкость и факторы, определяющие данную характеристику, методы определения.
2.Буферные системы крови и ротовой жидкости, механизм их действия.
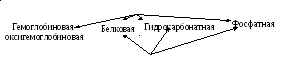
Буферная ёмкость системы организма.
Кислотно-основное состояние (КОС) крови и ротовой жидкости (понятие о щелочном резерве, ацидозе и алкалозе).
Практическая часть
Ситуационные задачи
Вычисление рН буферного раствора
Задача №1. Три раствора содержат
уксусную кислоту /![]() /
концентрации 0,10 моль/л и ацетата натрия
концентрации 0,10 (а), 0,20 (б) и 0,50 (в) моль/л.
Вычислите рН этих растворов.
/
концентрации 0,10 моль/л и ацетата натрия
концентрации 0,10 (а), 0,20 (б) и 0,50 (в) моль/л.
Вычислите рН этих растворов.
Ответ.
а) ![]() ;
б)
;
б)![]() ;
в)
;
в)![]() .
.
Вычисление изменения рН буферных растворов, вызванных добавлением кислоты или щелочи
Задача
№2. Для экспериментального
определения содержания ионов
![]() в образце консервированной крови методом
комплексонометрии, необходимо приготовить
аммиачный буфер с рН 8-10. Однако данное
значение не должно быть выше 10,т.к. в
этом случае выпадает осадок гидроксида
металла.Вычислите рН
аммиачной буферной системы, содержащей
по 0,5 М гидроксида
аммония
в образце консервированной крови методом
комплексонометрии, необходимо приготовить
аммиачный буфер с рН 8-10. Однако данное
значение не должно быть выше 10,т.к. в
этом случае выпадает осадок гидроксида
металла.Вычислите рН
аммиачной буферной системы, содержащей
по 0,5 М гидроксида
аммония ![]() и
хлорида аммония
и
хлорида аммония ![]() .
Как изменится рН при добавлении к 1 л
этой смеси 0,1 М
.
Как изменится рН при добавлении к 1 л
этой смеси 0,1 М
![]() и при добавлении к 1 л этой смеси 0,1М
и при добавлении к 1 л этой смеси 0,1М
![]() и при разбавлении раствора водой в 10
раз, если
и при разбавлении раствора водой в 10
раз, если
![]() ?
Правильно ли приготовлен
буферный раствор?
?
Правильно ли приготовлен
буферный раствор?
Ответ.1)![]() (исходной
смеси); 2)
(исходной
смеси); 2)![]() (при добавлении
(при добавлении![]() );
3)
);
3)![]() (при
добавлении
(при
добавлении![]() );
4)
);
4)![]() (при разбавлении водой). Буферный раствор
приготовлен _______________, т.к.
оптимальная величина рН для определения
(при разбавлении водой). Буферный раствор
приготовлен _______________, т.к.
оптимальная величина рН для определения
![]() (или
(или![]() )
около __________.
)
около __________.
Вычисление соотношения объемов компонентов буферной системы с определенным рН
Задача
№3. Вычислите объем
раствора натрий формиата с
![]() 0,1
моль/л и объем муравьиной кислоты
0,1
моль/л и объем муравьиной кислоты![]() =0,1
моль/л, которые необходимы для приготовления
2 л формиатного буфера с рН=3,15 (
=0,1
моль/л, которые необходимы для приготовления
2 л формиатного буфера с рН=3,15 (![]() ).
).
Ответ.![]() мл;
мл;![]() мл.
мл.
Вычисление буферной ёмкости
Задача
№4. К 100 мл к
ротовой жидкости для изменения рН от
7,8 до 7,4 надо добавить 3,6 мл HCl
![]() ,
какова буферная ёмкость
,
какова буферная ёмкость![]() этой жидкости?
этой жидкости?
Ответ.![]() моль/л.
моль/л.
Контрольные вопросы и задачи
Что выполняет роль слабой кислоты в фосфатном буфере: гидрофосфат или дигидрофосфат?
Почему при выводе формул рН буферных растворов равновесную концентрацию слабых электролитов можно принять за исходную?
Докажите, что небольшое разбавление практически не влияет на рН буферных систем.
Почему максимальная буферная ёмкость наблюдается при соотношении компонентов 1:1?
Почему буферная ёмкость по кислоте и по щелочи не всегда совпадает?
Какая буферная система вносит максимальный вклад в буферную ёмкость ротовой жидкости и крови?
Как используется уравнение Гендерсона–Гассельбаха при оказании помощи пациентам с отравлениями?
При введении в раствор формиата аммония: ионов а)
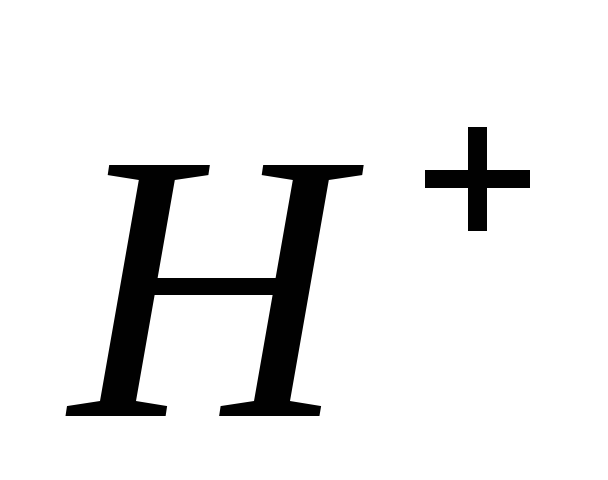 и б)
и б)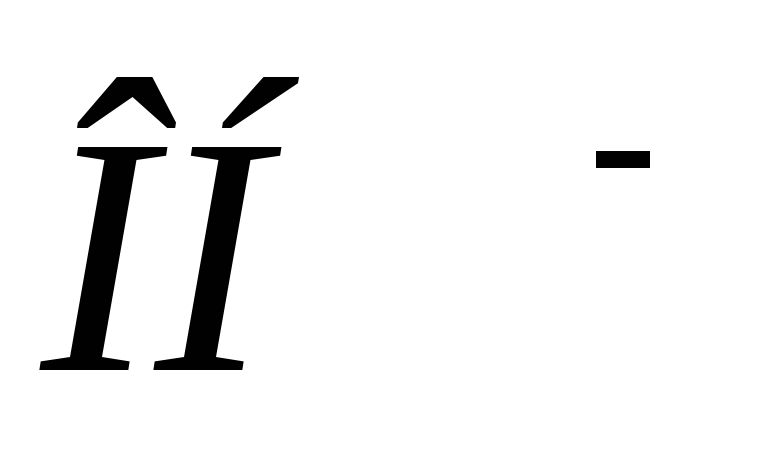 протекают следующие процессы: а)
протекают следующие процессы: а)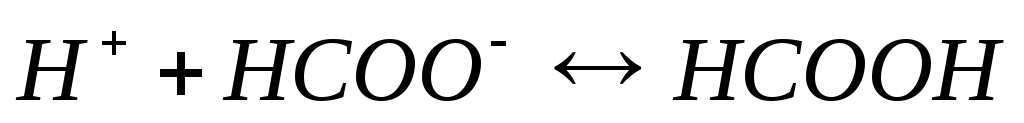 ;
б)
;
б) .
Будет ли раствор
.
Будет ли раствор
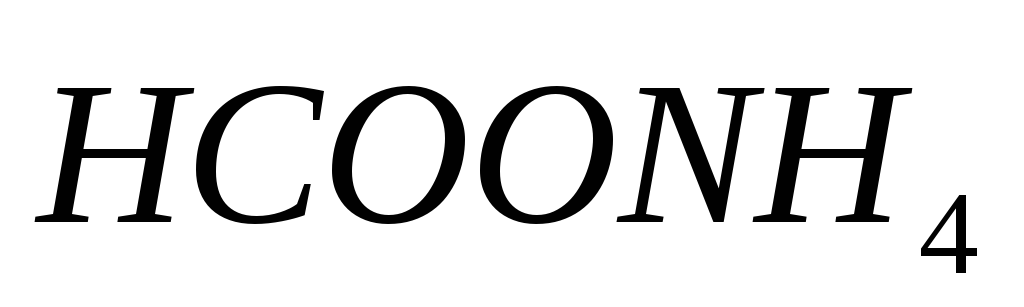 проявлять буферные свойства?
проявлять буферные свойства?Какое соотношение
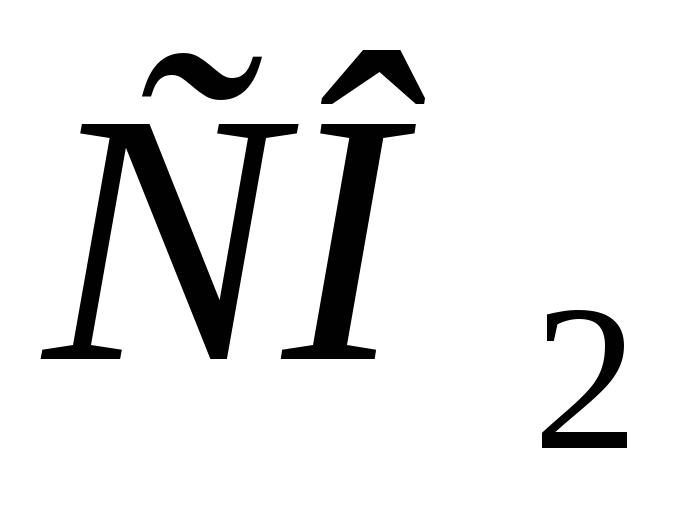 и
и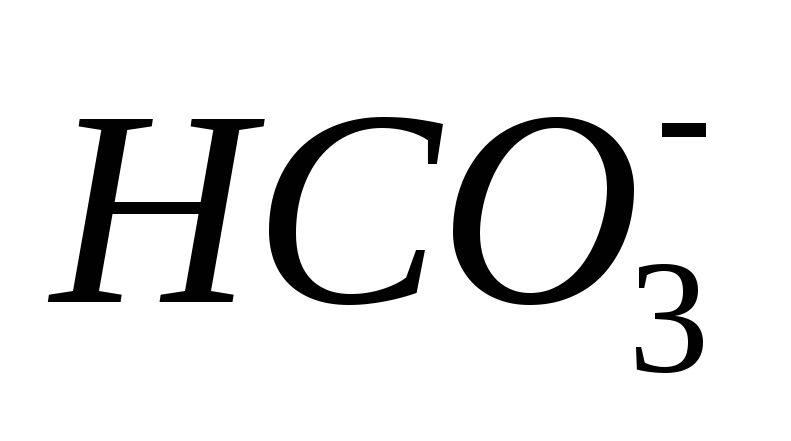 опасно для жизни и зачем в организме
создается резерв
опасно для жизни и зачем в организме
создается резерв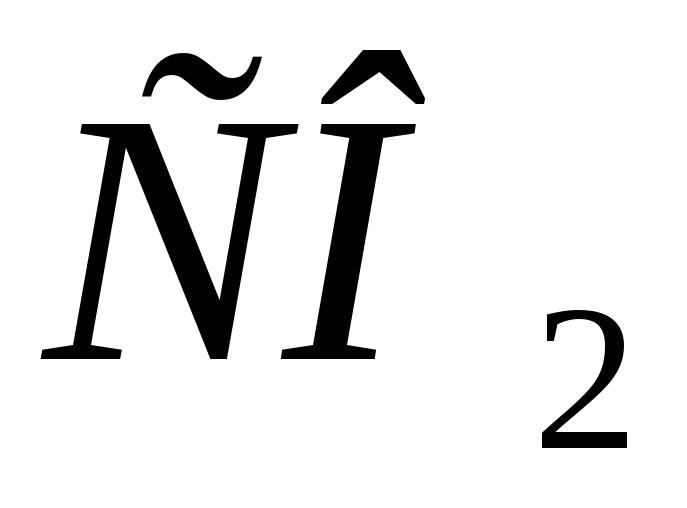 ?
?При подъеме в горы наблюдается гипервентиляция легких. Какое нарушение кислотно-основного гомеостаза при этом возможно?
Что такое алкалоз и ацидоз и как изменяется рН при выдохе?
Какова должна быть концентрация ацетата натрия в 0,01 М растворе уксусной кислоты, чтобы концентрация ионов
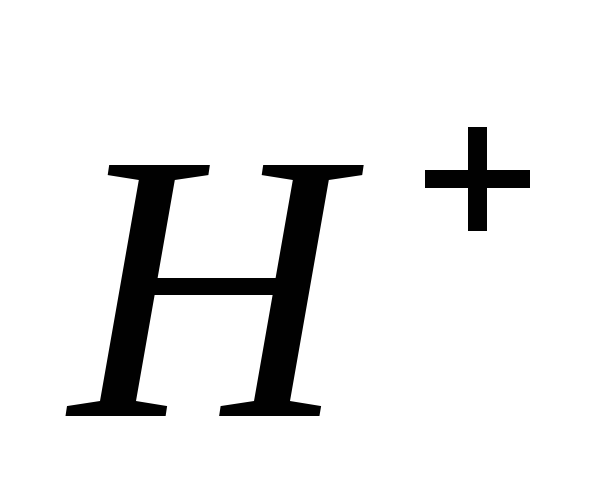 в растворе была равна
в растворе была равна моль/л?
моль/л?Какую из кислот:
 ,
,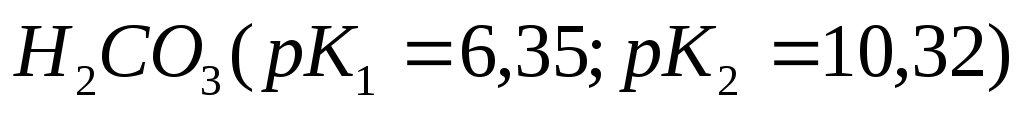 ,
,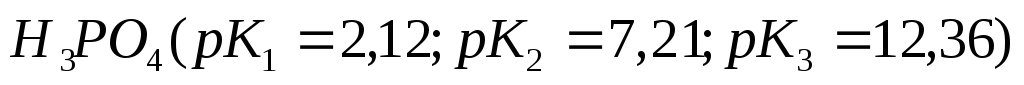 лучше
выбрать для приготовления буферного
раствора с наибольшей буферной ёмкостью
и с рН= 7,45? Как приготовить 100 мл такого
раствора из 1 М растворов компонентов?
лучше
выбрать для приготовления буферного
раствора с наибольшей буферной ёмкостью
и с рН= 7,45? Как приготовить 100 мл такого
раствора из 1 М растворов компонентов?Для приготовления трех буферных растворов использовали 1,0 М растворы гидрофосфата и дигидрофосфата натрия, смешав их в соотношениях: а) 8:2; б)5:5; в) 3:7. У какого раствора будет максимальная буферная ёмкость и наибольшее значение рН?
Рассчитайте величину буферной ёмкости фосфатного буферного раствора, если после добавления 10 мл
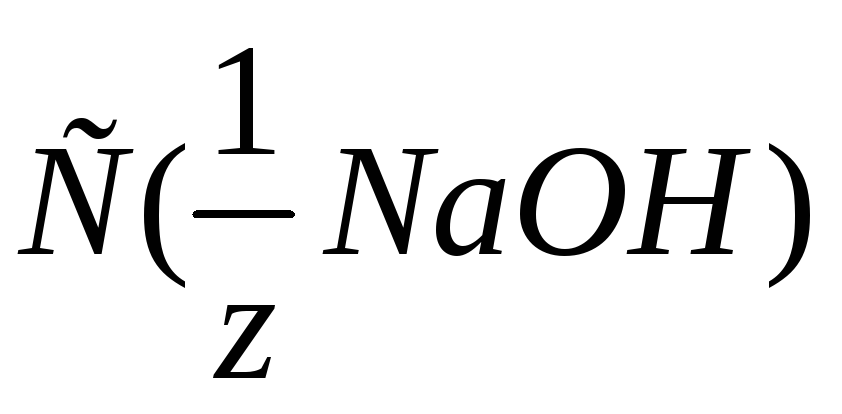 =0,5
моль/л к 20 мл этого раствора рН последнего
увеличивается с 7,2 до 8,0.
=0,5
моль/л к 20 мл этого раствора рН последнего
увеличивается с 7,2 до 8,0.Во сколько раз концентрация водородных ионов в крови (рН=7,36) больше, чем в спинномозговой жидкости (7,53)?
