
- •Синтез ланостерина
- •Холестериновые и смешанные желчные камни: механизмы образования
- •Синтез кетоновых тел (кетогенез)
- •(54) Кетоацидоз диабетический
- •Ацетонемия
- •Ругие возможные причины
- •(56) Липопротеиды и апопротеины
- •Системы транспорта липидов
- •(58) Пути транспорта холестерина
- •(59) Протеинограмма: общий белок, белковые фракции
Синтез кетоновых тел (кетогенез)
Синтез ацетоацетата происходит
только в митохондриях печени, далее он
либо восстанавливается до 3-гидроксибутирата,
либо спонтанно декарбоксилируется
до ацетона.
Далее все три соединения поступают в
кровь и разносятся по тканям. Ацетон,
как летучее вещество, легко удаляется
с выдыхаемым воздухом и потом. Все
кетоновые тела могут выделяться с мочой Регуляция синтеза кетоновых
тел. Регуляторный
фермент синтеза кетоновых тел - ГМГ-КоА
синтаза.
Регуляция синтеза кетоновых
тел. Регуляторный
фермент синтеза кетоновых тел - ГМГ-КоА
синтаза.
ГМГ-КоА-синтаза - индуцируемый фермент; его синтез увеличивается при повышении концентрации жирных кислот в крови. Концентрация жирных кислот в крови увеличивается при мобилизации жиров из жировой ткани под действием глюкагона, адреналина, т.е. при голодании или физической работе.
ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного кофермента А.
Когда поступление жирных кислот в клетки печени увеличивается, КоА связывается с ними, концентрация свободного КоА снижается, и фермент становится активным.
Если поступление жирных кислот в клетки печени уменьшается, то, соответственно, увеличивается концентрация свободного КоА, ингибирующего фермент. Следовательно, скорость синтеза кетоновых тел в печени зависит от поступления жирных кислот.
Окисление кетоновых тел в периферических тканях
При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом
408
глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе.
β-Гидроксибутират (рис. 8-34), попадая в клетки, дегидрируется NAD-зависимой дегидрогеназой и превращается в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сук-цинил-КоА - донором КоА:
Ацетоацетат + Сукцинил-КоА → Ацетоацетил- КоА + Сукцинат.
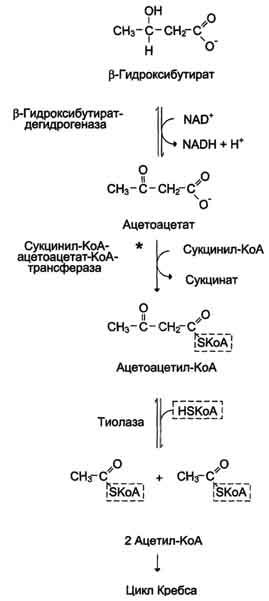 Реакцию
катализирует сукцинил-КоА-ацето-ацетат-КоА-трансфераза.
Этот фермент не синтезируется в печени,
поэтому печень не использует кетоновые
тела как источники энергии, а производит
их "на экспорт". Кетоновые тела -
хорошие топливные молекулы; окисление
одной молекулы β-гидроксибутирата до
СО2 и
Н2О
обеспечивает синтез 27 молекул АТФ.
Эквивалент одной макроэргической связи
АТФ (в молекуле сукцинил-КоА) используется
на активацию ацетоацетата, поэтому
суммарный выход АТФ при окислении одной
молекулы β-гидроксибутирата - 26 молекул.
Реакцию
катализирует сукцинил-КоА-ацето-ацетат-КоА-трансфераза.
Этот фермент не синтезируется в печени,
поэтому печень не использует кетоновые
тела как источники энергии, а производит
их "на экспорт". Кетоновые тела -
хорошие топливные молекулы; окисление
одной молекулы β-гидроксибутирата до
СО2 и
Н2О
обеспечивает синтез 27 молекул АТФ.
Эквивалент одной макроэргической связи
АТФ (в молекуле сукцинил-КоА) используется
на активацию ацетоацетата, поэтому
суммарный выход АТФ при окислении одной
молекулы β-гидроксибутирата - 26 молекул.
Реакцию катализирует сукцинил-КоА-ацето-ацетат-КоА-трансфераза. Этот фермент не синтезируется в печени, поэтому печень не использует кетоновые тела как источники энергии, а производит их "на экспорт". Кетоновые тела - хорошие топливные молекулы; окисление одной молекулы β-гидроксибутирата до СО2 и Н2О обеспечивает синтез 27 молекул АТФ. Эквивалент одной макроэргической связи АТФ (в молекуле сукцинил-КоА) используется на активацию ацетоацетата, поэтому суммарный выход АТФ при окислении одной молекулы β-гидроксибутирата - 26 молекул.
(54) Кетоацидоз диабетический
ДКА возникает из-за абсолютного или относителтьного дефицита инсулина , который развивается за несколько часов или дней.
При диабетическом кетоацидозе в крови накапливаются кетокислоты : ацетоацетат и бета-гидроксибутират . Это состояние обычно возникает у больных инсулинозависимым сахарным диабетом при перерыве в инсулинотерапии или на фоне сопутствующих заболеваний, приводящих к резкому повышению потребности в инсулине, - гастроэнтерита , панкреатита ,инфаркта миокарда , инфекционных заболеваний .
