
Вьюник. Лекция № 15
.pdf
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Вплив концентрацiї
Для реакцiй, що вiдбуваються у газовi фазi, у виразi для константи рiвноваги замiсть рiвноважних концентрацiй користуються пропорцiйними їм парцiальними тисками. У
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2 |
||
цьому випадку для реакцiї |
N |
|
+ 3H |
|
−−− |
2NH |
|
|
|
= |
NH3 |
|
|||||||
2 |
2 |
3 |
Kp |
3 . |
|||||||||||||||
|
|
|
−−− |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PN2PH2 |
||
Взагалi для хiмiчно зворотної реакцiї: |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
Cd |
· Cc |
|
|
|
|
||||
AA + BB + |
−−− CC + DD + |
··· |
|
Kc |
= |
|
D |
|
|
|
C |
; |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
··· −−− |
|
|
|
|
|
|
Ca |
· Cb |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
ad |
|
· ac |
|
|
|
|
|
|
|
|
|
для термодинамiчної константи: Ka = |
D |
|
C |
. |
|
|
|
|
|
||||||||||
aa |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
· ab |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
A |
|
B |
|
|
|
|
|
|
|||
11/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Молекулярнiсть i порядок реакцiї
Молекулярнiсть i порядок реакцiї. За числом молекул, якi приймають участь в елементарному актi хiмiчного перетворення (взаємодiї) розрiзняють одно-, двох-, трьох- i т. iншi молекулярнi реакцiї.
Ймовiрнiсть одночасного зiткнення багатьох частинок дуже мала. Тому навiть 3-х молекулярнi реакцiї зустрiчаються дуже рiдко, а 4-х молекулярнi невiдомi. Реакцiї:
H2 (г) + I2 (г) −−−−−− 2 HI(г) (2-х молекулярна)
2 NO(г) + Cl2 (г) −−−−−− 2 NOCl(г) (3-х молекулярна)
Сума показникiв степенiв в кiнетичному рiвняннi, якi вiдносяться до змiнюваних концентрацiй, визначає загальний порядок реакцiї, а самi показники степенi визначають порядок реакцiї за кожним компонентом.
12/33
Умови протiкання реакцiй Швидкiсть хiмiчної реакцiї Хiмiчна рiвновага
Швидкiсть хiмiчної реакцiї
Молекулярнiсть i порядок реакцiї
Наприклад, для реакцiї в загальному видi:
AA + BB + |
−−− CC + DD + |
···, |
|
··· −−− |
для прямої реакцiї величина a+b = n називається загальним (сумарним) порядком реакцiї. Порядок реакцiї визначає характер залежностi швидкостi реакцiї вiд концентрацiї.
1-го порядку: А = продукти реакцiї;
→ →
CaCO3 = CaO + CO2; v = kCA;
→ →
2-го порядку: A + B = продукти реакцiї. v = kCA · CB. Кiнетичнi дослiдження показали, що хiмiчнi реакцiї у бiльшостi випадкiв мають складний механiзм. Вони представляють собою послiдовнiсть елементарних процесiв або реакцiй, так що продукти однiєї реакцiї є реагентами для слiдуючої.
13/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Молекулярнiсть i порядок реакцiї
Порядок складається iз порядкiв елементарних реакцiй. Якщо швидкiсть однiєї iз елементарних стадiй сумарної реакцiї набагато менша швидкостi iнших стадiй, ця стадiя називається визначаючою (лiмiтуючою) швидкiсть.
Якщо 2-i стадiї сумарної реакцiї мають швидкостi одного порядку, то порядок буде дробним.
Iснують реакцiї нульового порядку, наприклад , розкладання деяких речовин на поверхнi роздiлу фаз, коли швидкiсть розкладання не залежить вiд концентрацiї в об‘ємi фази (каталiтичне розкладання NH3).
14/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Молекулярнiсть i порядок реакцiї
Для простих гомогенних реакцiй, протiкаючих в одну стадiю, цi поняття спiвпадають (порядок i молекулярнiсть). Однак, часто порядок i молекулярнiсть реакцiй не спiвпадають. Нi нульової, нi дробної молекулярностi не може бути.
Молекулярнiсть - молекулярно-кiнетична характеристика, а порядок застосовується для формально кiнетичного опису.
15/33

Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Вплив температури
Вплив температури на швидкiсть хiмiчної реакцiї i на змiщення рiвноваги.
Швидкiсть хiмiчних реакцiй у бiльшостi випадкiв iз зростанням Т збiльшується.
При пiдвищенi Т на 100C швидкiсть гомогенної реакцiї збiльшується в 2-4 рази. Цю закономiрнiсть у виглядi правила встановив у 1884р Вант-Гофф. Це правило є наближеним.
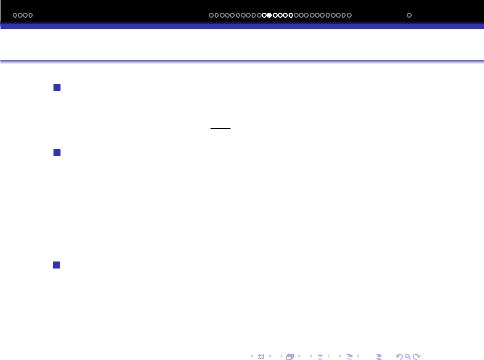
Вiдповiдно до цього правила вплив температури на швидкiсть реакцiї можна охарактеризувати за допомогою температурного коефiцiєнта γ, який показує, у скiльки разiв
зросте швидкiсть реакцiї у разi пiдвищення температури |
||
на 10◦: γ = vt+10 = kt+10; γn = vt+n10. |
||
vt |
kt |
vt |
16/33
Умови протiкання реакцiй Швидкiсть хiмiчної реакцiї Хiмiчна рiвновага
Швидкiсть хiмiчної реакцiї
Вплив температури
Температурний коефiцiєнт для 10◦ одних реакцiй дорiвнює тiльки 1.5, а для других досягає 7. В свою чергу iз пiдви-
щенням температури dTdC непостiйна (збiльшується).
На запитання чому швидкiсть хiмiчної реакцiї дуже чутлива до T? Вiдповiдь здається дуже простою: vхр пропорцiйна частотi зiткнення мiж молекулами. Iз збiльшенням T частота цих зiткнень зростає.
Однак, при нагрiванi на 10◦ швидкiсть руху частинок збiльшується всього лище на 1-2%.
З другого боку, якби необхiдною i достатньою умовою протiкання реакцiї було зiткнення частинок, то неможливо було б пояснити рiзницю в швидкостях процесiв при C = Const, була б незрозумiлою i дiя каталiзаторiв та їх вибiрковiсть.
17/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Вплив температури
Дальше, якби кожне зiткнення закiнчувалося актом взаємодiї, то всi реакцiї перебiгали б блискавично швидко (в 1 см3 газу в сек вiдбувається 1028зiткнень при Р= 1 атм, T = 500◦K). Неможливо було б вимiряти швидкiсть реакцiї.
Насправдi бiльшiсть реакцiй протiкає надзвичайно повiльно. Отже, лише невелика частка зiткнень мiж молекулами завершується взаємодiєю.
При зiткненi частинки повинi наблизитися на такi вiдстанi, щоб, переборовши сили вiдштовхування (енергетичний бар‘єр вiдштовхування електронних оболонок), став можливим перерозподiл електронної густини i виникли новi зв‘язки.
Такi реакцiйноздатнi частинки називають активними.
18/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Вплив температури
Активування молекул залежить вiд їх енергiї. Активнi молекули знаходяться в рiвновазi з неактивними. Для пояснення природи активних молекул Алєксєєв скористувався законом розподiлу енергiй Максвела-Больцмана.
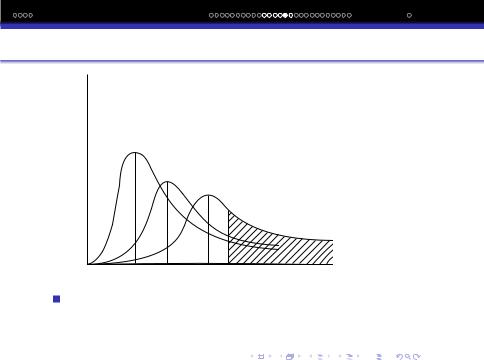
Розподiл молекул за швидкостями при заданiй температурi може бути представлений кривою розподiлу, де по осi абсцис вiдкладена швидкiсть молекул, а по осi ординат густина вiрогiдностi розподiлу молекул за швидкостями.
19/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Вплив температури
f(r)
300°
400°
500°
vE |
v |
Найбiльш вiрогiдна швидкiсть вiдповiдає максимуму, по мiрi росту температури змiщується в бiк великих значень швидкостi, а крива розподiлу стає бiльш широкою.
20/33
