Биохимия
.docxБиохимия
|
5. Белки, физические и химические свойства. Уровни структурной организации белков. Биологические функции. Классификация белков. Белки – высокомолекулярные органические вещества, которые характеризуются строго определенным элементарным составом и распадаются до аминокислот при гидролизе. Индивидуальность белков определяется набором а.к. в цепи и порядком их чередования. Функции белков проявляются на третичном уровне их организации. Если молекула содержит менее 100 а.к. то ее называют пептидом: олигопептид (менее 15 а.к.) и полипептид (от 15 до 100 а.к.). Почти любая работа в кл выполняется белками, они не способны резервироваться в организме (время жизни от неск мин у гормонов до 180 суток у белков мышечной ткани), белковый обмен человека хар-ся высокой скоростью. По степени сложности строения: - простые белки (протеины) – содержат только а.к. в составе. К ним относятся альбумины и глобулины – белки плазмы крови, проламины и глютелины – встречаются в семенах злаковых, гистоны и протамины – щелочные белки, входящие в состав хромосом, протеноиды – фибриллярные белки, такие как коллаген и кератин. - сложные белки (протеиды) – содержат в своем составе помимо белковой части небелковую группу – простетическую группу. К ним относятся нуклеопротеиды (хромосома, рибосома); гликопротеиды (антитела, иммуноглобулины, белки нервной ткани); липопротеиды – комплекс белков с липидами (ЛП крови); металлопротеиды – Ме находятся в составе гемма (гемоглобин); хромопротеиды – белки с какими-либо группами цветности (флавоноиды – в кожуре красных яблок, винограда, граната); фосфопротеиды – кислые белки, в составе которых присутствуют остатки ортофосфорной кислоты (казеин). По форме белковой молекулы: - фибриллярные – белки, образ параллел полипептидными цепями, нерастворимые (коллаген, кератин). - глобулярные – хорошо растворимы в воде за счет удаления гидрофобных радикалов внутрь молекулы (ферменты, инсулин). По пищевой ценности: - полноценные – белки, обеспечивающие требуемый баланс 8 незаменимых а.к., животного происхождения (казеин). - неполноценные – белки, в кот не хватает опред а.к. и они используются не эффективно, если употребляются отдельно (желатин). По степени растворимости (уменьш раств-ть): - альбумины - глобулины - глютелины - склеропротеины – нерастворимы в воде. Различают кислые белки – ИЭТ меньше 7, белки в составе которых больше анионогенных групп и щелочные белки – ИЭТ больше 7, в составе преобладают катионогенные группы. Мультимерные белки – состоят из четного числа протомеров, имеют четвертичную структуру (глутамат дегидрогеназа из 6 протомеров). Они выгодны для организма так как экономится генетический материал для их кодирования, сводятся к минимуму ошибки при биосинтезе, т.к. белки с одной цепью выбраковываются, а мультимерные белки лишаются 1 протомера, а остальные продолжают работать. Олигомерные белки - способны сохранять свои свойства при диссоциации на отдельные протомеры и не устрачивать своих функций (сывороточный альбумин). Функции белков: Структурная или строительная функция (фибрин, коллаген, кератин); каталитич (белки – F); двигательная и сократительная (актин, миозин, тубулин); транспортная (гемоглобин, альбумины, липопротеины); защитная (антитела); энергетическая (из 1г белка = 17,6 кДж); гормональная (адреналин, инсулин, глюкагон); сигнальная (рецепторная); токсическая (пептиды в яде змей и пчел). Уровни структурной организации белков: Первичная структура – последовательность а.к. остатков в полипептидной цепи. Пептидные связи, которые стабилизируют ее прочные, жесткие, находятся в трансконфигурации. Первичная структура на примере инсулина: 2 цепи – одна 21 а.к., другая – 30 а.к., имеется 2 межцепочечные и 1 внутрицепочечная дисульфидные связи. Первичная структура гемоглобина: 4 полипептидные цепочки, 2 цепи по 141 а.к., 2 по 146 а.к. Каждая из них содержит гемм – железосодержащая структура с порфириновыми кольцами, которые связаны с белковой частью через остаток гистидина. Нарушение первичной структуры – мутация и болезни. Н-р, одна из 100000 молекул гемоглобина явл аномальной – анемия (в 6 положении глутаминовая кислота заменяется на валин). Вторичная структура – более высокий уровень структурной организации, в которой закрепление конформации происходит за счет водородных связей между пептидными группами. Водородная связь – связь, осуществляемая между 2 электроотриц атомами, с одним из которых этот водород соединен обычной ковалентной связью. Представлена α- спиралью и β-складчатым слоем. - α – спираль – правозакрученная спираль, шаг витка 0,54 нм, расстояние между а.к. 0,15 нм, на одном шаге 3,6 а.к., она возникает за счет карбоксильной группы одной а.к. и атомами азота аминогрупп, входящих в состав пептидных групп, через 4 а.к. остатка. Образованию α – спирали способствуют ала, глу, глн, лей, лиз, мет, гис. Водородные связи внутрицепочечные. β-складчатый слой – поддерживается межцепочечными водородными связями, шаг витка 0,7 нм, 2 а.к. на шаге, расстояние 0,35 нм. Способствуют образованию складчатой структуры илей, вал, тре, тир, фен. Ограничения образования альфа структуры: присутствие пролина – изгибы в цепи; жесткость пептидной цепи; близкое расположение одноименнозаряженных а.к; близкое расположение в цепи громоздских радикалов. Третичная структура белка – способ укладки доменов и элементов вторичной структуры в пространстве. Домен – участок полипептидной цепи, способствующий быстрому и самопроизвольному формированию устойчивой пространственной структуры. Они стабилизируются следующими типами связей: гидрофобное взаимодействие – между аромат а.к. и угледородным радикалом; дисульфидные связи (цистеиновые мостики); ионные связи – между разноименно заряженными а.к.; вандерваальсовы связи. На уровне третичной стр-ры рассм 2 вида белков: глобулярные и фибриллярные. Четвертичная структура – пространственное расположение отдельных пептидных цепей относ др др. Отдельная цепь – протомер или субъединица. Характерна для мультимерных белков, состоящихиз четного кол-ва протомеров. Связи как и в третичной структуре. Физ-хим свойства: кристаллич вещ-ва, большая молекулярная масса, у всех есть ИЭТ в которой белок склонен к выпадению в осадок, для всех хар-на пространст конфигурация (нативная стр-ра). Денатурация (обратимая и необратимая) – процесс, при кот под влиянием внеш факторов происх изменение вторич, третич и четвертич структуры, т.е. нативной струк-ры. Высаливание – обратен денатурации, снимается только гидратная оболочка, белок сохраняет все виды своей структуры. Растворимость определяется природой тех групп, которые оказываются на поверхности молекулы при ее пространственной укладке в нативную конформацию. Большая часть поверхности белковой молекулы образована группами, способными гидратироваться. Под гидратацией понимается связывание диполей воды с ионными и полярными группами. Осаждению белков препятствует гидратная оболочка и наличие электрического заряда. Сущ соединения которые имеют только первичный уровень организации но выполняют в организме важные функции. К ним относятся гормоны и антибиотики. Окситоцин – гормон задней доли гипофиза, регулирует работу мускулатуры, матки, молочных желез, лактацию. Вазопрессин – водный обмен, отвечает за артериальное давление. Глутатион – обеспеч ОВР процессы в кл, его вводят при ожогах и облучениях. Грамицидин – антибиотик широкого спектра действия.
|
8. Ферменты. Общая характеристика, физико-химические свойства. Особенности строения. Биологическая роль. Классификация. F – биолог катализаторы белковой природы. F – спец класс в-в белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч химических реакций. Наука, изучающая строение и свойства F – энзимология. F подчиняются общим законам катализа: катализируют только энергетически возможные реакции; не изменяют направление реакции; не расходуются в процессе реакции; не участвуют в образ продуктов реакции. Отличие F от неорг кат: высоко эффективны в мягких условиях; чувствительны к денатурирующим агентам, термолобильны; высокая специфичность действия в отношении субстрата и типа реакции; активность F строго контролируется на генетическом уровне; облад быстродействием. Все F делят на 2 большие группы: - простые – сост только из белковой молекулы (трипсин, пепсин) - сложные – (холоферменты) – содержат белковую часть – апофермент и небелковую часть – кофактор. Небелковая часть может быть представлена простетической группой (прочно связана с белковой частью – гем, цитохром) и коферментом – легко отделить от белковой части (витамины и нуклеотиды). Витамины: пиридоксин В6 – антидермитный, отвечает за обмен белков; тиамин В1 – входит в состав F дыхат цикла и апотомического пути окисления углеводов; В9 фолиевая кислота – участвует в процессах обмена н.к. и а.к.; витамин Н – за реакции карбоксилирования в процессе биосинтеза пуриновых нуклеотидов и ВЖК; В12 кобаламин – синтез адреналина, пуриновых и пиримидиновых оснований. Коферменты нуклеотидной природы: - НАД – накотинамид-аденин-динуклеотид и НАДФ - накотинамид-аденин-динуклеотид фосфат. НАД сост из 2 нуклеотидо: 1 – никотинамид В5 + рибоза + Р и 2 – аденин + рибоза + Р, их соединяет фосфодиэфирная связь. НАДФ содержит дополнительно остаток ортофосфорной кислоты в 3 положении рибозы 2 нуклеотида. Они отвечают за перенос водорода в ОВР реакциях, участвуют в реакциях синтеза в-в. - ФМН – флавинмононуклеотид состоит из азотсодержащей группировки флавина + спирт рибит + Р. Первые 2 части – рибофлавин В2. ФАД – флавин аденин динуклеотид состоит из 2 нуклеотидов: 1 – то же что и ФМН и 2 – аденин с рибозой + Р. Входят в состав дыхательной цепи и отвечают за процесс окислительного фосфорилирования. - Кофермент А – участвует в активации жирных кислот, их окислении, синтезе холестерола, стероидных гормонов и в процессе дыхания. Составная часть F, отвеч за перенос ацильных радикалов в.т.ч ВЖК. Состоит из аденина + рибоза + 3Р + пантотеновая кислота (В3) + тиоэтаноламин. Особенности строения F (см рис тетрадь): В строении каждого F различают три центра: каталитический (здесь протекает сама хим реакция), субстратный (якорная площадка фермента) – они образуют активный центр F и аллостерический центр (регуляторный центр) – находится на расстоянии от активного центра, к ниму присоединяются активаторы и ингибиторы кот меняют активность F. Кофактор обеспечивает реакционную активность F и частично сам участвует в переносе к-л групп, а белковая часть (апофермент) придает кофактору каталитическую активность. Актив центр формир только на третичной структуре белка в организации которого принимает участие вся а.к. послед-ть белка. Разнообразие F определяется соединением коферментов с различной последовательностью апоферментов. Физико-химические свойства: - все F ускоряют течение реакций за счет образования фермент-субстратного комплекса, снижающего Е активации молекул. - наличие температурного оптимума F (для рас 45-50, для чел 36,6) - работа F контролируется активаторами и ингибиторами. Активаторы – катионы Ме с 19 по 30 в таб Менделеева (железо – в составе цитохромов, каталазы; кальций – амилаза, липаза; магний – фосфатаза;) Они облегчают формирование Ф-С комплекса, присоединяясь к аллостерическому центру изменяют третичную структру активного центра, так что реакция протекает гораздо быстрее. Ингибиторы – в-ва, которые препятствуют образованию Ф-С комплекса, уменьш скорость реакции или прекращают ее (дыхат яды – угарный газ, синильная кислота; соединения ртути и мышьяка, которые связывают сульфгидрильные группы; фосфорорганические соединения которые связывают ОН группы серина в актив центре; все ингибиторы которые вызывают денатурацию белка). Классификация F: 1.Оксидоредуктазы – F катализирующие ОВР. а)анаэробные дегидрогеназы б)аэробные дегидрогеназы в)система цитохромов – компоненты дыхательной цепи г)оксидазы – катализируют окисление веществ кислородом воздуха без включения его в молекулу субстрата д)оксигеназы – катализирующие включение в молекулу субстрата атомов кислорода 2. Трансферазы - F переноса различных группировок. а)аминотрансферазы – реакции переаминирования б)фосфотрансферазы – перенос Р на субстрат от макроэргич соединений, в частности от АТФ. в)гликозилтрансферазы – переносят гликозидные остатки с фосфорных эфиров на спирты или моносахариды. г)ацилтрансферазы – перенос ацильных радикалов карбоновых кислот или ВЖК 3. Гидролазы – F, катализирующие реакции гидролиза. а) эстеразы – гидролиз сложной эфирной связи б) гликозидазы – гидролизуют гликозидные связи в углеродах в) пептидазы – пептидные связи в белках г) амидазы – распад а.к. и их амидов 4. Лиазы – катализируют негидролитическое присоединение к субстрату или отщепление от него групп атомов. а) C-N реакции дезаминирования б) C-C реакции декарбоксилирования или альдольного расщипления в) C-O реакции дегидротации 5. Лигазы – катализируют реакции синтеза сложных органич соединений из более простых при участии макроэргических компонентов. а) C-C – карбоксилирование б) C-S – активация ВЖК в) C-O – активация а.к. в биосинтезе белков г) C-N – аминирования 6. Изомеразы – превращение изомеров друг в друга. а) собственно изомеразы – альдегиды в кетоны, альдозы в кетозы. б) стереоизомеразы в) мутазы – внутримолекулярный перенос групп атомов одного положения в другое Примеры реакций на каждый класс в тетради! Специфичность F: - абсолютная – F работает с одним в-вом (уреаза – только мочевина) - относительная – F действует на группу субстратов (липаза – жиры) - стереоспецифичность – F работает только с одним стереоизомеров (фумараза – только с трансизомером фумаровой кислоты). Механизм работы F: Генри предложил механизм действия F в 4 этапа: - образование Ф-С комплекса - активация субстрата в этом комплексе - образование фермент-продуктного комплекса - его разложение на фермент и продукт Фишер теория субстратной специфичности или теория замка и ключа: F – замок, актив ц – замочная скважина, субстрат – ключ. Как не каждый ключ подходит к замку, так и не каждый F подходит к субстрату. Кошланд теория руки и перчатки: рука – субстрат, перчатка – F. Структура F появляется в момент сближения с субстратом. Применяются в диагностике заболеваний (кислая фосфатаза – рак предстательной железы, уреаза – определение мочевины в крови, липаза определение жиров в крови), в пивоварении и хлебопекарной промышленности (амилаза).
|
9.Липиды. Общая характеристика, классификация, состав, строение. Распространение в природе. Биологическая роль. Липидами назыв. неоднородные в хим. Отнош.вещ-ва, большинство из кот. представляют собой сложные эфиры карбон.кислот и спиртов. хорошо растворимы в орган. растворителях, таких, как метанол, ацетон, хлороформ и бензол. В то же время эти вещ-ва нерастворимы или мало растворимы в воде. Слабая растворимость связана с недостат. Содерж. в молекулах липидов атомов с поляризующейся электр. оболочкой, таких, как О, N, S или P. Наиболее известны среди них жиры. Каждая молекула жира образована молекулой трехатомного спирта глицерола и присоединенными к ней эфирными связями трех молекул высших карбоновых кислот. Согласно принятой номенклатуре жиры называют триацилглицеролами. Атомы углерода в молекулах высших карбоновых кислот могут быть соедин. друг с другом как простыми, так и двойными связями. Среди предельных (насыщенных) высших карбоновых кислот наиболее часто в состав жиров входят:пальмитиновая СН3 - (СН2)14 - СООН или С15Н31СООН; стеариновая СН3 - (СН2)16 - СООН или С17Н35СООН; арахиновая СН3 - (СН2)18 - СООН или С19Н39СООН; среди непредельных:олеиновая СН3 - (СН2)7 - СН = СН — (СН2)7 - СООН или С17Н33СООН;линолевая СН3 - (СН2)4 - СН = СН — СН2 - СН — (СН2)7 - СООН или С17Н31СООН;линоленовая СН3 - СН2 - СН = СН — СН2 - СН = СН — СН2 - СН = СН — (СН2)7 - СООН или С17Н29СООН. Наибольшее распростр. получила классификация, основанная на структурных особенностях липидов. различают следующ. основные классы липидов. A. Простые липиды: сложные эфиры жирных кислот с различными спиртами. 1. Глицериды (ацилглицерины, или ацилглицеролы – по международной номенклатуре) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот. 2. Воска: сложные эфиры высших жирных кислот и одноатомных или двухатомных спиртов. Б. Сложные липиды: сложные эфиры жирных кислот со спиртами, дополнительно содержащие и другие группы. 1. Фосфолипиды: липиды, содержащие, помимо жирных кислот и спирта, остаток фосфорной кислоты. В их состав часто входят азотистые основания и другие компоненты: а) глицерофосфолипиды (в роли спирта выступает глицерол); б) сфинголипиды (в роли спирта – сфингозин). 2. Гликолипиды (гликосфинголипиды). 3. Стероиды. 4. Другие сложные липиды: сульфолипиды, аминолипиды. К этому классу можно отнести и липопротеины. B. Предшественники и производные липидов: жирные кислоты, глице-рол, стеролы и прочие спирты (помимо глицерола и стеролов), альдегиды жирных кислот, углеводороды, жирорастворимые витамины и гормоны. Немножко дополнение1)Фосфолипиды — амфифильные соединения, т. е. имеют полярные головки и неполярные хвосты. Группы, образующие полярную головку, гидрофильны (растворимы в воде), а неполярные хвостовые группы гидрофобны (нерастворимы в воде).Двойственная природа этих липидов обусловливает их ключевую роль в организации биологических мембран.2)Воска — сложные эфиры адноатомных (с одной гидроксильной группой) высокомолекулярных (имеющих длинный углеродный скелет) спиртов и высших карбоновых кислот.3) стероиды. Эти вещества построены на основе спирта холестерола. Стероиды очень плохо растворимы в воде и не содержат высших карбоновых кислот.К ним относятся желчные кислоты, холестерол, половые гормоны, витамин D и др.4)К стероидам близки терпены (ростовые вещества растений — гиббереллины; фитол, входящий в состав хлорофилла каротиноиды — фотосинтетичские пигменты; эфирные масла растений — ментол, камфора и др.).Липиды могут образовывать комплексы с другими биологическими молекулами.5)Липопротеины — сложные образования, содержащие триацилглицеролы, холестерол и белки, причем последние не имеют ковалентных связей с липидами.6)Гликолипиды — это группа липидов, построенных на основе спирта сфингозина и содержащих кроме остатка высших карбоновых кислот одну или несколько молекул сахаров (чаще всего глюкозу или галактозу).Функции липидов:Структурная. Фосфолипиды вместе с белками образуют биологические мембраны. В состав мембран входят также стеролы.Энергетическая. При окислении 1 г жиров высвобождается 38,9 кДж энергии, которая идет на образование АТФ. В форме липидов хранится значительная часть энергетических запасов организма, которые расходуются при недостатке питательных веществ. Животные, впадающие в спячку, и растения накапливают жиры и масла и расходуют их на поддержание процессов жизнедеятельности. Высокое содержание липидов в семенах обеспечивает энергией развитие зародыша и проростка, пока он не перейдет к самостоятельному питанию. Семена многих растений (кокосовая пальма, клещевина, подсолнечник, соя, рапс и др.) служат сырьем для получения масла промышленнымспособом.Защитная и теплоизоляционная. Накапливаясь в подкожной жировой клетчатке и вокруг некоторых органов (почки, кишечник), жировой слой защищает организм от механических повреждений. Кроме того, благодаря низкой теплопроводности слой подкожного жира помогает сохранить тепло, что позволяет, например, многим животным обитать в условиях холодного климата. У китов, кроме того, он играет еще и другую роль — способствует плавучести.Смазывающая и водоотталкивающая. Воска покрывают кожу, шерсть, перья, делают их более эластичными и предохраняют от влаги. Восковым налетом покрыты листья и плоды растений; воск используется пчелами в строительстве сот.Регуляторная. Многие гормоны являются производными холестерола, например половые (тестостерон у мужчин и прогестерон у женщин) и кортикостероиды (альдостерон).Метаболическая. Производные холестерола, витамин D играют ключевую роль в обмене кальция и фосфора. Желчные кислоты участвуют в процессах пищеварения (эмульгирование жиров) и всасывания высших карбоновых кислот. Липиды являются источником метаболической воды. При окислении жира образуется примерно 105 г воды. Эта вода очень важна для некоторых обитателей пустынь, в частности для верблюдов, способных обходиться без воды в течение 10-12 суток: жир, запасенный в горбе, используется именно на эти цели. Необходимую для жизнедеятельности воду медведи, сурки и другие животные в спячке получают в результате окисления жира. |
|
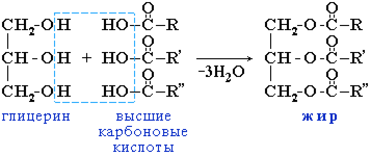
6. Жиры. Распространение в природе, классификация, строение, состав, химические свойства. Промышленное и биологическое распространение жиров. Жиры – (триглицериды) – сложные эфиры трехатомного спирта глицерина и одноосновных высших жирных кислот. Жиры относятся к нейтральным липидам. Жиры – энергетическое депо, субстраты для окисления и обеспечения организмов энергией, располагаются преимущественно в подкожной жировой ткани и выполняют функции теплоизоляционной и механической защиты. Общая формула жиров:
де R¹, R² и R³ — радикалы (одинаковых или различных) жирных кислот. Жиры гидрофобны, практически нерастворимы в воде, хорошо растворимы в органических растворителях и частично растворимы в этаноле. По составу: - простые – сложные эфиры глицерина и одной из ВЖК (трипальметилглицерол или трипальмитат)
- смешанные – сложные эфиры глицерина и остатков разных ВЖК (жир коровьего молока или пальмитилолеилбутирилглицерол).
По происхождению: - животные – твердые, кроме рыбьего жира, содержат в своем составе остатки предельных ВЖК. (C15H31COOH) и (C17H35COOH) - растительные – жидкие, кроме кокосового масла и масла какао, содержат в своем составе остатки непредельных ВЖК. (C17H33COOH, 1 двойная связь) и (C17H31COOH, 2 двойные связи). Получение жиров:
Химические свойства: 1. Гидролиз жиров – это реакция обратная реакции получения жира. Гидролиз жиров в живых организмах происходит под влиянием ферментов. Результат гидролиза — образование глицерина и соответствующих карбоновых кислот: С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH 2. Щелочной гидролиз или омыление: С3H5(COO)3-(C17H35)3 + 3NaOH → C3H5(OH)3 + 3C17H35COONa тристеарин (жир) + едкий натр → глицерин + стеарат натрия (мыло) Соли высших карбоновых кислот – мыло. Соли натрия – твердое мыло, а соли калия – жидкое мыло. 3. Гидрирование жиров. В составе растительных масел содержатся остатки ненасыщенных карбоновых кислот, поэтому они могут подвергаться гидрированию, пропускают водород, который присоединяется по месту двойных связей ненасыщенных углеводородных радикалов. В результате реакции жидкое масло превращается в твёрдый жир. Этот жир называется саломасом, или комбинированным жиром. Применение жиров: Пищевая промышленность (в частности, кондитерская), Фармацевтика, Производство мыла и косметических изделий, Производство смазочных материалов. Энергетическая ценность жира приблизительно равна 9,3 ккал на грамм, что соответствует 39 кДж/г.
|
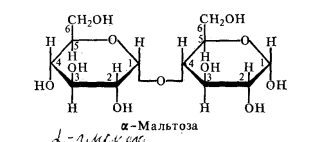
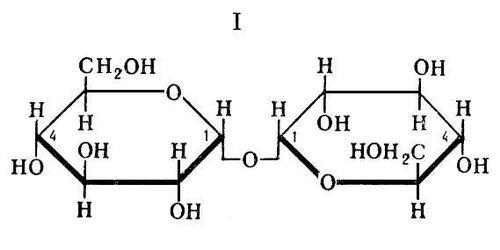
7. Дисахариды и их классификация. Химические свойства. Важнейшие представители. Углеводы – это альдегиды и кетоны многоатомных спиртов и полимеры этих соединений. Классификация углеводов: - моносахариды – состоят из 1 структурной единицы и не гидролизуются (глюкоза, фруктоза, рибоза) - олигосахариды - гидролизуются с образованием от 2 до 20 молекул моносахаридов (сахароза, лактоза, мальтоза) - полисахариды – ВМС, которые гидролизуются с образованием нескольких тысяч молекул моносахаридов (крахмал, целлюлоза). Дисахариды (биозы) – углеводы, состоящие из 2 одинаковых или разных остатков моносахаров и являющиеся О-гликозидами (полными ацеталями). Различают 2 группы дисахаридов: - восстанавливающие – образуются за счет гликозидной группы первого и любой спиртовой группы другого моносахарида. К ним относятся: лактоза (молочный сахар), мальтоза (солодовый сахар), целлобиоза (древесный сахар).
Мальтоза (α -глюкозид – α – глю, связь α 1 к 4). Используется в пищеварительной промышленности, широко распространен в раст и живот организмах, образ под влиянием F пищев тракта β-амилаз.
Лактоза (β -галактозид – α – глю, связь β 1 к 4) Применяется при производстве пенициллина. Лактулоза – препарат для лечения кишечных расстройств.
Целлобиоза – (β -глюкозид – β – глю, связь β 1 к 4) промежуточный продукт распада клетчатки. Обеспечивает усвоение жвачными целлюлозной части биомассы. Образ при гидролизе целлюлозы бактериями. - невосстанавливающие – образуются за счет гликозидных групп обоих моносахаридов. К ним относятся сахароза и трегалоза.
Трегалоза – впервые выделена из спорыньи, содержится во многих водорослях, высших грибах (2 остатка D-глю, α 1 к 1). Сахароза (свекловичный или тростниковый сахар) – (α глюкопиранозид – β – фруктофураноза, α к 1, β к 2). Промежуточный продукт фотосинтеза, в форме сахарозы транспортируются углеводы по растениям. Животные усваивают сахарозу после воздействия фермента сахаразы, инвертазы. Химические свойства: 1. Гидролиз C12H22O11 (сахароза) + H2O = C6H12O6 (глю) + C6H12O6 (фруктоза) 2. Фосфоролиз (F: мальтозофосфорилаза) Мальтоза = α-глю + α-пираноза 3. Восстановление дисахаридов. C12H22O11 + Ag2O = C6H22O12 + 2Ag C12H22O11+ Cu(OH)2 = C6H22O12 + 2H2O + Cu2O Сахароза + реактив Троммера = хелатный комплекс
|
|