
- •Тесты к модулю №1 (для итогового рубежного контроля)
- •1) Термодинамика. Химическое равновесие.
- •4) Для нахождения реакции, следует воспользоваться формулой…
- •5) Для нахождения реакции, следует воспользоваться формулой …
- •6) Если энтальпия образования so2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16г серы, равно . . . КДж
- •7) В реакции, протекающей в соответствии с термохимическим уравнением
- •12. В результате реакции, описываемой термохимическим уравнением
- •15. В результате реакции, термохимическое уравнение которой
- •23. В реакции, протекающей в соответствии с термохимическим уравнением
- •33) Будет ли влиять давление на смещение равновесия данной реакции
- •34) Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном направлении
- •37) Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направления
- •40) Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в прямом направлении
- •41) Как нужно изменить давление, чтобы сместить равновесие реакции
- •43) На состояние химического равновесия в системе
- •46) Равновесие в реакции, уравнение которой
- •48) В каком направлении идёт данная реакция
- •52) Повышение давления смещает равновесие в сторону продуктов для реакции…
- •56) Неверно, что согласно 2 началу термодинамики…
- •15) Сумма коэффициентов в уравнении реакции, соответствующая схеме , составляет …
- •25) Уравнение процесса, протекающего на инертном аноде при электролизе водного раствора хлорида натрия, имеет вид…
- •34) При электролизе водного раствора кСl на инертном аноде выделяется…
- •35) В реакции
- •36) При электролизе водного раствора СuCl2 с графитовым анодом на …
- •37) Oкислительно-восстановительная реакция в стандартных условиях возможна, если…
- •39) В системе, состоящей из луженого (покрытого оловом) железа при нарушении целостности покрытия в морской воде самопроизвольно протекает…
- •52) При нарушении оловянного покрытия на железном изделии, находящемся в кислоте, на аноде протекает реакция…
- •61) Гидроксид хрома (|||) Сr(oh)3 может проявлять в окислительно – восстановительных реакциях свойства:
- •1. Молярная масса неэлектролита, раствор 11,6 г которого в 200 г воды замерзает при -1,86°с (), равна _____ г/моль.
- •2.Массовая доля метанола в растворе, содержащем 60 г спирта и 40 г воды равна…
- •11.Молярная концентрация раствора, в 2 л которого содержится 4,25 г хлорида лития, равна______ моль/л.
23. В реакции, протекающей в соответствии с термохимическим уравнением
3H2 + N2 = 2 NH3 + 92 кДж
выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака
5,6 л 2) 11,2л 3) 22,4л 4) 44,8л
24) По термохимическому уравнению С2Н4+Н2О↔С2Н5ОН+46 кДж
вычислите объём взятого этилена (н.у.), если известно, что выделившаяся в этом процессе теплота составила 138 кДж.
44,8 л 2) 22,4л 3) 67,2л 4) 89,6л
25) В реакцию, протекающую в соответствии с термохимическим уравнением 2Al + 3S = Al2S3 +509 кДж вступило 108 г алюминия. Количество выделившейся теплоты равно
242,5 кДж 2) 509 кДж 3) 1018 кДж 4) 2036 кДж
26) В результате реакции, термохимическое уравнение которой 2Al +Fe2O3 = Al2O3 + 2 Fe +848 кДж, выделилось 169,6 кДж теплоты. Масса образовавшегося железа равна:
1) 11,2 г 2) 22,4 г 3) 56 г 4) 28 г
27) По термохимическому уравнению реакции горения ацетилена 2С2Н4 + 5О2 = 4СО2 + 2Н2О +2610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 67, 2 л ацетилена (н.у.)
870 кДж 2) 3915 кДж 3) 5220 кДж 4) 7830 кДж
28) Уравнение константы равновесия гетерогенной химической реакции 2H2S(г) + SO2(г) ↔ 2S(к) + 2Н2O (г)…
1)
 2)
2)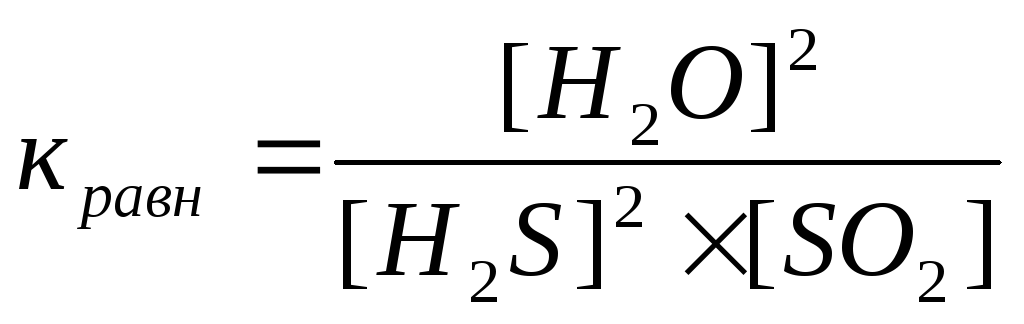
3)
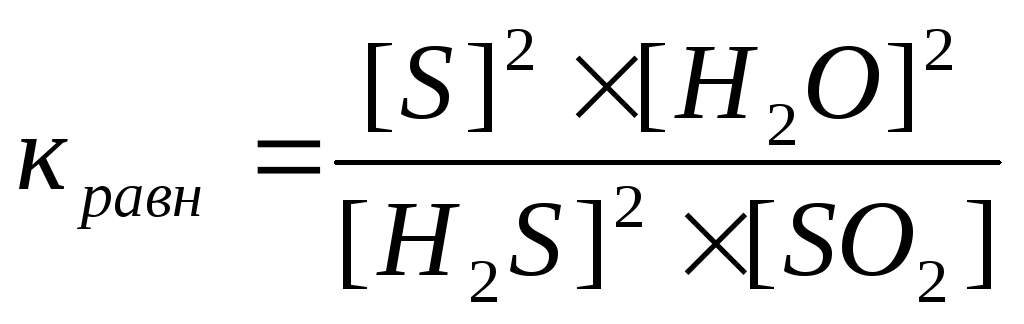 4 )
4 )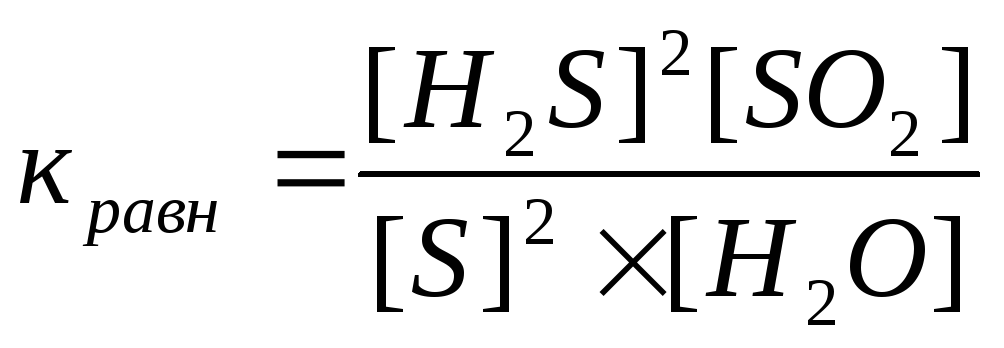
29) Уравнение константы равновесия гетерогенной химической реакции
2СО(г)↔С (графит) +СО2(г) имеет вид…
1)
![]() 2)
2)![]()
3)
![]() 4)
4)![]()
30) Как нужно изменить давление, чтобы реакция гемоглобина с кислородом Hb + O2 « HbO2 была смещена вправо
1) уменьшить давление
2) увеличить давление
3) давление не влияет
31) Какое значение константы равновесия соответствует данной реакции 2NO +O2 « 2NO2
1) Kc= [NO2]2/ [NO][O2] 2) Kc= [NO2]2 / [NO]2[O2]
3) Kc= [NO][O2]/ [NO2]2 4) Kc= [NO2]/ [NO][O2]
32) Как нужно изменить давление реакции N2+3H2 « 2 NH3, чтобы сместить равновесие вправо
1) уменьшить 2) увеличить
3) не изменять 4) увеличить давление NH3
33) Будет ли влиять давление на смещение равновесия данной реакции
H2 + Cl2 = 2 HCl
1) будет 2) нет
3) сместит равновесие вправо 4) сместит равновесие влево
34) Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном направлении
1) DG0<0 2)DG0>0 3)DG0= 0 4)DG0= 1
35) Равновесие в реакции, уравнение которой СН4(г) + 4S(ж) ↔ СS2(г) + 2Н2S(г), ΔH<0, сместиться влево при
1) понижении давления 2) понижении температуры
3) дополнительном введении серы 4) увеличении концентрации H2S
36) Будет ли проходить реакция в прямом направлении, если DG = 18 кДж/моль
1) нет 2) химическое равновесие 3) будет
37) Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направления
1) СO2(г) +C(т) ↔ 2СО(г), ΔН<0
2) J2(г) + 5 СО2(г) ↔J2O5(т) + 5СО(г), ΔН>0
3) N2(г) + О2(г) ↔ 2NO(г), ΔН>0
4) С2Н2(г) + 2Н2(г) ↔ С2Н6(г), ΔН<0
38) Как нужно изменить давление, чтобы реакция гемоглобина с кислородом была смещена влево Hb + O2 « HbO2
1) уменьшить давление
2) увеличить давление
3) давление не влияет
39) В реагирующей системе, уравнение которой NO(г) + Cl2(г) ↔ NOCl2(г) ΔH > 0, равновесие сместиться вправо при:
1) повышении давления 2) использовании катализатора
3) понижении температуры 4) повышении концентрации NOCl2
