
- •Федеральное агентство по образованию российской федерации фгоу впо «Восточно-Сибирский государственный технологический университет»
- •Лекция № 1. Введение. Питание микроорганизмов.
- •1.2. Главные и минорные биоэлементы
- •Лекция №2. Усвоение углеводов отличных от глюкозы
- •Лекция № 3. Рост микроорганизмов на с1 субстратах
- •Лекция № 4. Оптимизация процессов ферментации
- •Лекция № 5. Кинетика ферментативных реакций
- •Лекция № 6. Кинетические модели роста культур микроорганизмов
- •6.1.1. Простейшая схема взаимодействия клетки с субстратом
- •6.2. Пределы скорости роста культур микроорганизмов
- •Лекция № 7. Экспоненциальная фаза роста культур микроорганизмов
- •7.1 Определение параметров роста культуры
- •Лекция № 8. Многосубстратные микробные процессы
- •8.1. Простейшие кинетические схемы
- •Лекция № 9. Ингибирование и активация роста микроорганизмов
- •Лекция № 10. Влияние рН на кинетику роста микроорганизмов
- •Лекция №11. Интегральная форма уравнения роста микробной популяции
- •11.1. Замедление скорости роста культуры микроорганизмов при большой плотности популяции
- •11.2. Интегральная форма уравнения роста культуры микроорганизмов
- •Лекция №12. Ингибирование роста популяции микроорганизмов избытком субстрата
- •Лекция № 13. Ингибирование роста популяции микроорганизмов продуктами ферментации
- •13.1. Ингибирование продуктом на стадии взаимодействия субстрата с клеткой
- •13.2. Ингибирование продуктом на стадии деления клетки
- •13.3. Одновременное ингибирование продуктом обеих стадий
- •Лекция №14. Анализ полных кинетических кривых роста
- •14.1. Конкурентное ингибирование продуктом реакции
- •14.3. Определение механизма ингибирования из вида кинетической кривой роста популяции микроорганизмов
- •Лекция № 15. Периоды индукции на кинетических кривых роста микроорганизмов
- •15.1. Трансформация пресубстрата в субстрат
- •15.2. Адаптационный процесс
- •15.3. Расходуемый ингибитор роста
- •15.4. Дискриминация механизмов и определение кинетических параметров
- •Лекция № 16. Культивирование микроорганизмов в режиме хемостата
- •16.1. Неосложненный рост
- •16.1.1. Определение параметров роста культуры из данных по стационарным состояниям компонентов процесса
- •16.2. Ингибирование субстратом
- •16.2.1. Стационарные уровни концентрации субстрата
- •16.2.2. Стационарные уровни концентрации биомассы и продукта ферментации
- •Лекция №17. Ингибирование продуктом
- •17.1. Конкурентное ингибирование продуктом
- •17.2. Неконкурентное ингибирование продуктом
- •Лекция №18. Ингибирование ионами водорода
- •Списик использованной литературы.
Лекция № 16. Культивирование микроорганизмов в режиме хемостата
Культивирование микроорганизмов в открытых системах (проточных реакторах) — один из наиболее перспективных и развитых способов их выращивания. Преимущества этого способа культивирования состоят в стандартности условий проведения процесса, высокой производительности, возможностях тонкого управления кинетикой роста популяции. Кинетические закономерности роста и эволюции микробных популяций в открытых системах достаточно просты и наиболее изучены.
16.1. Неосложненный рост
Рассмотрим кинетические закономерности роста микроорганизмов в открытой системе при непрерывной подаче субстрата.
Представим, что в сосуд объемом V подается раствор лимитирующего субстрата с концентрацией S0 с объемной скоростью и. Под действием микроорганизма субстрат конвертируется в продукт (продукты) Р и осуществляется прирост биомассы. Поскольку система ограничена по объему, избыточный раствор непрореагировавшего субстрата, продуктов реакции и часть клеток микроорганизмов выводятся из реакционного объема с той же объемной скоростью и. Предполагается, что режим перемешивания в реакторе организован таким образом, что обеспечивает постоянные по всему объему концентрации субстрата S, продукта Р и клеток N. Эти условия так называемого безградиентного ферментера известны еще и как режим хемостата.
Через некоторое время в системе устанавливаются стационарные концентрации исходного субстрата, продуктов реакции, числа клеток (биомассы) микроорганизма. Рассмотрим, каково значение стационарных концентраций компонентов процесса, как эти стационарные концентрации зависят от параметров роста культуры, от скорости ввода в систему субстрата.
Динамика изменения в системе концентрации клеток N определяется скоростью роста культуры ц и скоростью вывода ее из ферментера:
![]() (16.1)
(16.1)
Параметр и/V, имеющий размерность обратного времени, называется скоростью разбавления D.
Экспериментально параметр D может быть найден при изучении кинетики вымывания какого-либо вещества А, присутствующего в ферментере в начальный момент времени τ = 0. Скорость вывода вещества А описывается уравнением
![]() (16.2)
(16.2)
которое приводит к экспоненциальной зависимости вида
![]() (16.3)
(16.3)
где А0—концентрация А в начальный момент времени. Линеаризация экспериментальных данных в координатах уравнения
![]() (16.4)
(16.4)
позволяет утверждать, что используемая система достаточно хорошо описывается уравнениями идеального, безградиентного, реактора с перемешиванием и позволяет определить параметр D.
Изменение концентрации исходного субстрата будет описываться дифференциальным уравнением
![]() (16.5)
(16.5)
Первое слагаемое в этом уравнении характеризует скорость ввода субстрата, второе - вывод из системы непрореагировавшего субстрата, третье - расход субстрата в результате его потребления для роста культуры.
Соответственно концентрация продукта ферментационной конверсии Р также зависит от скорости роста микроорганизма и скорости протока:
![]() (16.6)
(16.6)
Первое слагаемое характеризует скорость ферментационного накопления продукта, второе — вывод продукта из ферментера. Если принять, что удельная скорость роста микроорганизма как функция концентрации субстрата дается уравнением Моно, то все кинетические закономерности роста культуры в режиме хемостата описывает система уравнений
![]() (16.7)
(16.7)
![]() (16.8)
(16.8)
![]() (16.9)
(16.9)
Если
система функционирует при постоянной
скорости разбавления
D
достаточно
большое время, то концентрации биомассы,
субстрата и продукта становятся
постоянными, не зависящими
от времени. В этих условиях
![]() Условия
равенства нулю во времени всех компонентов
процесса соответствуют условиям
стационарности.
Условия
равенства нулю во времени всех компонентов
процесса соответствуют условиям
стационарности.
Из уравнений (16.7) — (16.9) в условиях стационарности следует ряд важных выводов.
В стационарном режиме удельная скорость роста микроорганизма соответствует скорости разбавления. При dN/dτ=0 из уравнения (16.7) следует
![]()
Таким образом, скоростью разбавления в рамках определенных ограничений можно задавать удельную скорость роста культуры.
Стационарная концентрация субстрата Sст в ферментере определяется скоростью разбавления и кинетическими параметрами роста микроорганизма и не зависит от начальной концентрации субстрата. Из уравнения (16.7) следует
![]() (16.10)
(16.10)
Стационарная концентрация субстрата в ферментере тем меньше, чем больше максимальная удельная скорость роста культуры и чем меньше значение константы сродства микроорганизма к субстрату КS. Важно подчеркнуть, что Sст не зависит от концентрации вводимого субстрата. Это позволяет говорить об аутостабилизации условия роста культуры по субстрату в режиме хемостата.
Зависимость стационарной концентрации субстрата от скорости разбавления имеет сложный характер. При низких скоростях разбавления в условиях D<<μ стационарная концентрация субстрата линейно зависит от скорости разбавления (рис. 16.1):
![]() (16.11)
(16.11)
При скоростях разбавления, приближающихся к μm (D→ μm), стационарная концентрация субстрата начинает неограниченно расти.

-
Рис.16.1. Зависимость относительной стационарной концентрации субстрата Sст/KS от скорости разбавления при различных значениях μm, ч-1(цифры на кривых); пунктирные линии - Dc
Рис.16.2. Зависимость относительной стационарной концентрации биомассы от скорости разбавления при различных значениях μm, ч-1(цифры на кривых); S0/KS=5,0; YS=0,5
Стационарная концентрация биомассы линейно зависит от концентрации вводимого в ферментер раствора субстрата. Из уравнения (16.7) следует (рис. 16.2)
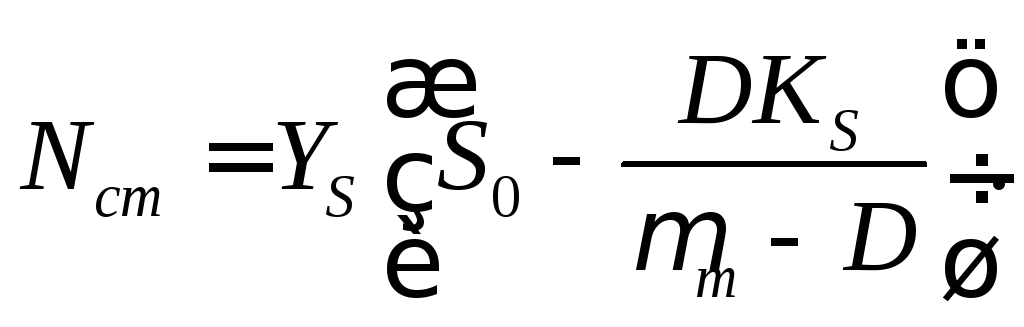 (16.12)
(16.12)
Видно, что при D→0 Nст≈S0YS .
Рост культуры в режиме хемостата характеризуется критической скоростью разбавления Dc, выше которой не наблюдается роста популяции. При скоростях разбавления, соизмеримых с максимальной скоростью роста микроорганизма, культура вымывается из ферментера. Значение критической скорости разбавления может быть найдено из уравнения (16.12) при условии, что Nст = 0 (при этом S = S0):
![]() (16.13)
(16.13)
Графически Dс может быть найдено из точки пересечения кривых с осью абсцисс (рис. 16.2).
Стационарная концентрация продукта линейно связана с концентрацией вводимого субстрата :
 (16.14)
(16.14)
Зависимость стационарной концентрации продукта от S0 и D аналогична зависимости от этих переменных стационарной концентрации клеток.
