

Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из
остатков аминокислот.
Каталитическая функция. Большинство известных в настоящее время ферментов, называемых
биологическими катализаторами, является белками.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется
молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки
крови.
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая
обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий,
токсинов, вирусов или чужеродных белков.
Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых
веществ.
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству
первое место среди других белков тела человека.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой
регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во
многих других клетках организма.
Питательная функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками
питания для плода, например белки яйца (овальбумины).
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот и, в некоторых
случаях, из модифицированных основных аминокислот.
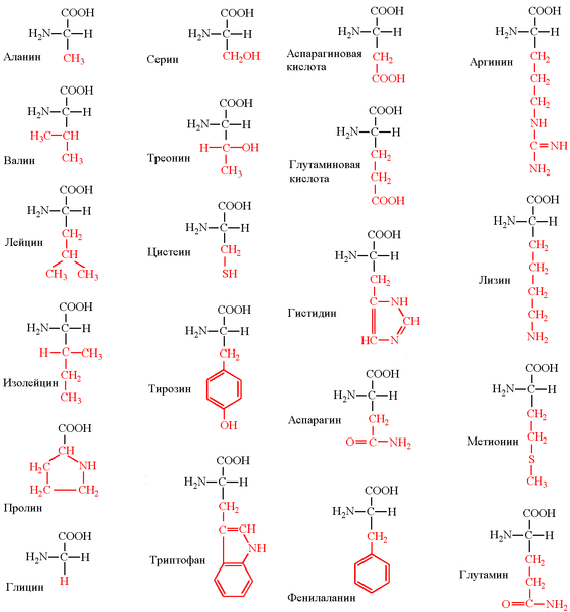
Аминокислоты — органические соединения, в молекуле которых одновременно содержатся
карбоксильные и аминные группы.
Классификация аминокислот.
I. Физико-химическая – основана на различиях в физико-химических свойствах аминокислот. 1) Гидрофобные
аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы и
ароматические кольца. К гидрофобным аминокислотам относятся ала, вал, лей, иле, фен, три, мет. 2)
Гидрофильные (полярные) незаряженные аминокислоты. Радикалы таких аминокислот содержат в своем
составе полярные группировки (-ОН, -SH, -NH2). Эти группы взаимодействуют с дипольными молекулами
воды, которые ориентируются вокруг них. К полярным незаряженным относятся гли, сер, тре, тир, цис, глн, асн.
3) Полярные отрицательно заряженные аминокислоты. К ним относятся аспарагиновая и глутаминовая
кислоты. В нейтральной среде асп и глу приобретают отрицательный заряд. 4) Полярные положительно
заряженныеаминокислоты: аргинин, лизин и гистидин. Имеют дополнительную аминогруппу (или
имидазольное кольцо, как гистидин) в радикале. В нейтральной среде лиз, арг и гис приобретают
положительный
заряд.
II. Биологическая классификация. 1)
Незаменимые аминокислоты не могут
синтезироваться в организме человека и
должны обязательно поступать с пищей (вал,
иле, лей, лиз, мет, тре, три, фен) и еще 2
аминокислоты относятся к частично
незаменимым (арг, гис). 2)Заменимые
аминокислоты могут синтезироваться в
организме человека (глутаминовая кислота,
глутамин, пролин, аланин, аспарагиновая
кислота, аспарагин, тирозин, цистеин, серин и
глицин).Строение аминокислот. Все
аминокислоты являются α-аминокислотами.
Аминогруппа общей части всех аминокислот
присоединена к α-углеродному атому.
Аминокислоты содержат карбоксильную
группу –COOH и аминогруппу -NH2. В белке
ионогенные группы общей части аминокислот
участвуют в образовании пептидной связи, и
все свойства белка определяются только
свойствами радикалов аминокислот.
Аминокислоты амфотерные соединения.
Изоэлектрической точкой аминокислоты называют значение pH, при
котором максимальная доля молекул аминокислоты обладает нулевым зарядом.
Основные углеводы пищи. Переваривание углеводов в ротовой полости и желудочно-кишечном тракте,
амилолитические ферменты слюны, поджелудочной железы, гидролиз дисахаридов. Всасывание
моносахаридов (механизм всасывания).
По количеству углеводных остатков УВ разделяются на 3 основных класса: 1. моносахариды (глюкоза, фруктоза, галактоза, манноза и др.); 2. дисахариды (мальтоза, сахароза, лактоза); 3. Полисахариды (гомополисахариды крахмал, гликоген, клетчатка). Крахмал – резервный гомополисахарид растений, построенный из остатков α-глюкозы. Крахмал представляет собой смесь двух гомополисахаридов: амилозы и амилопектина. В амилозе остатки глюкозы связаны α-1,4-гликозидными связями, в точках ветвления амилопектина - α-1,6-гликозидными связями. Молекулярная масса крахмала – 106-107. Гликоген – резервный гомополисахарид высших животных и человека, построенный из остатков α–Д-глюкозы. Гликоген содержится практически во всех органах и тканях человека и животных; наибольшее его количество находится в печени и
мышцах. Молекулярная масса гликогена 107 – 109 и выше. Гликоген по своему строению близок к амилопектину. Остатки глюкозы связаны α-1,4-гликозидными и α-1,6-гликозидными связями (в точках ветвления). В молекуле гликогена имеется большее число α-1,6-гликозидных связей по сравнению с крахмалом. Клетчатка – это единственный гомополисахарид, который не переваривается в ЖКТ человека, т.к. пищеварительные железы человека не вырабатывают β–глюкозидазу. Однако клетчатка выполняет ряд важных функций: 1. способствует
формированию кала; 2. усиливает перистальтику кишечника; 3. является адсорбентом, с которым из кишечника выводятся излишки холестерина, соли тяжелых металлов. Роль углеводов: 1. Энергетическая (глюкоза – основной источник энергии для организма. При сгорании 1 г УВ выделяется 4 ккал энергии). 2. Структурно-функциональная (УВ – обязательный компонент гликопротеинов и протеогликанов, которые выполняют разнообразные функции: гормональную, рецепторную, защитную, ферментативную и др.). 3. Метаболическая (пентозы участвуют в синтезе нуклеиновых кислот и нуклеотидных коферментов). Суточная потребность в углеводах составляет 400-500 г. Переваривание углеводов - это совокупность процессов поэтапного ферментативного гидролиза полисахаридов до моносахаридов, которые всасываются в кишечнике, разносятся током крови к печени и другим тканям организма, где подвергаются различным метаболическим превращениям. Переваривание УВ начинается в ротовой полости под действием фермента амилазы слюны (оптимум рН=6,8-7,2), которая гидролизует в крахмале α -1,4-гликозидные связи с образованием декстринов.
Всасывание УВ из просвета кишечника в энтероцит и из энтероцита в кровь происходит: 1)облегченной диффузией с участием переносчиков; 2) вторично активным транспортом (симпортом с ионами натрия) с
использованием энергии K, Na-АТФ-азы. Быстрее всех всасываются глюкоза и галактоза. От кишечника
всосавшиеся моносахариды транспортируются в печень, где происходит до 90% превращений моносахаров.
Поступление глюкозы в клетки сердечной, скелетных мышц и жировой ткани регулируется инсулином.
|
Количественное определение остаточного азота крови. |
Определение остаточного азота ведут в безбелковом фильтрате крови. При нагревании с конц. серной кислотой безбелковый фильтрат минерализуется, затем определяются колориметрически с реактивом Несслера. Сульфат аммония образует с реактивом Несслера желто-оранжевое окрашивание. Расчет ведут по количеству стандартного раствора NH4Cl, пошедшего на титрование опытной пробы: (А · 0.05)·100% = мг% 0.066 мг% = 0.714 = ммоль/л, где А – количество стандартного раствора, пошедшего на титрование. |
20 – 40 мг% 15 – 25 ммоль/л |
Подъем уровня остаточного азота (азотемия) наблюдается при ряде патологических состояний. В клинической практике азотемию подразделяют на 2 типа: ретенционную и продукционную. Ретенционная в основном зависит от недостаточной функции почек и обусловлена недостатком мочевины. Продукционная азотемия связана с поступлением в кровоток избыточного количества азотсодержащих веществ, как правило, за счет повышенного распада тканевых белков при сохраненной выделительной функции почек. Повышенное содержание остаточного азота (свыше 80 – 90 мг%) – уремия. |

1. Молекулярная масса. Белки – высокомолекулярные органические азотсодержащие полимеры,
построенные из аминокислот. Молекулярная масса белков зависит от количества аминокислот в каждой
субъединице. 2. Буферные свойства. Белки – амфотерные полиэлектролиты, т.е. они сочетают в себе кислые и
основные свойства. В зависимости от этого белки могут быть кислыми и основными. 3. Факторы
стабилизации белка в растворе. ГИДРАТНАЯ ОБОЛОЧКА – это слой молекул воды, определенным образом
ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена
отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами. 4.
Факторы, снижающие растворимость белков. Значение рН, при котором белок становится
электронейтральным, называется изоэлектрической точкой (ИЭТ) белка. Для основных белков ИЭТ находится в
щелочной среде, для кислых – в кислой среде. Денатурация – это последовательное нарушение четвертичной,
третичной, вторичной структур белка, сопровождающееся потерей биологических свойств. Денатурированный
белок выпадает в осадок. Осадить белок можно, изменяя рН среды (ИЭТ), либо высаливанием, либо действуя
каким-либо фактором денатурации. Физические факторы: 1. Высокие температуры. Часть белков подвергается
денатурации уже при 40-50 2. Ультрафиолетовое облучение 3. Рентгеновское и радиоактивное облучение 4.
Ультразвук 5. Механическое воздействие (например, вибрация). Химические факторы: 1. Концентрированные
кислоты и щелочи. 2. Соли тяжелых металлов (например, CuSO4). 3. Органические растворители (этиловый
спирт, ацетон) 4. Нейтральные соли щелочных и щелочноземельных металлов (NaCl, (NH4)2SO4)
2. Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и
одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную,
энергетическую и др. функции. Наряду с углеводами и белками, жиры — один из главных компонентов питания.
Жидкие жиры растительного происхождения обычно называют маслами.
Гидролиз жиров. Расщепление жиров на глицерин и жирные кислоты проводится обработкой их
щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс
называется омылением.
Липопротеинлипаза — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых
крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов
очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её
важное значение в атеросклерозе.
Гиперлипидемия (гиперлипопротеинемия) —аномально повышенный
уровень липидов и/или липопротеинов в крови человека. Нарушение обмена липидов и липопротеинов
встречается довольно часто в общей популяции. Гиперлипидемия является важным фактором риска
развития сердечно-сосудистых заболеваний в основном в связи со значительным влиянием холестерина на
развитие атеросклероза. Кроме этого, некоторые гиперлипидемии влияют на развитие острого панкреатита.
|
Мочевая кислота |
Метод Мюллера-Зейферта основан на способности мочевой кислоты взаимодействовать с фосфорно-вольфрамовым реактивом с образованием соединения, окрашенного в синий цвет. Интенсивность окрашивания пропорциональна количеству мочевой кислоты. По показаниям ФЭКа и по формуле рассчитывают содержание мочевой кислоты: Сст - Еоп Мг% = Ест , где Сст = 2 мг% Ест = 0,06 |
2-6 мг% 0,12-0,36 ммоль/л |
Гиперурикемия является основным симптомом подагры, а также наблюдается при синдроме Леша-Нихана – врожденном дефиците фермента гуанингипоксантинфосфорибозилтрансферазы. Подъем мочевой кислоты может быть следствием усиленного распада тканевых нуклеотидов (патологическое изменение крови, миелоз). Это явление носит название «вторичной» подагры. Некоторое нарастание мочевой кислоты наблюдается при диете, богатой пуринами. Снижение мочевой кислоты наблюдается при акромегалии, болезни Коновалова-Вильсона, ксантинурии. |

Структурная организация белковых молекул. Первичная, вторичная, третичная структуры. Связи, участвующие в стабилизации структур. Зависимость биологических свойств белков от вторичной и третичной структуры. Четвертичная структура белков. Зависимость биологической активности белков от четвертичной структуры (изменение конформации протомеров).
Существует четыре уровня пространственной организации белка: первичная, вторичная, третичная и четвертичная структура белковых молекул. Первичная структура белка- последовательность аминокислот в полипептидной цепи (ППЦ). Пептидная связь формируется только за счет альфа-аминогруппы и альфа-карбоксильной группы аминокислот.Вторичная структура- это пространственная организация стержня полипептидной цепи в виде α-спирали или β-складчатой структуры. В α-спирали на 10 витков приходится 36 аминокислотных остатков. Фиксируется α-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. β-Складчатая структура удерживается также водородными связями между С=О и NH-группами.Третичная структура- особое взаимное расположение в пространстве спиралеобразных и складчатых участков полипептидной цепи. В формировании третичной структуры участвуют прочные дисульфидные связи и все слабые типы связей (ионные, водородные, гидрофобные, Ван-дер-ваальсовые взаимодействия).Четвертичная структура– трехмерная организация в пространстве нескольких полипептидных цепей. Каждая цепь называется субъединицей (или протомером). Поэтому белки, обладающие четвертичной структурой, называют олигомерными белками.
Особенности химического состава и метаболизма нервной ткани (дыхание, обмен глюкозы и гликогена,
обмен макроэргов, липидов, белков и аминокислот). Обмен мозга при гипоксии. Пептиды и болевые реакции.
Дыхание. На долю головного мозга приходится 2–3% от массы тела. В то же времяпотребление
кислорода головным мозгом в состоянии физического покоядостигает 20–25% от общего потребления его всем
организмом, а у детейв возрасте до 4 лет мозг потребляет даже 50% кислорода, утилизируемоговсем
организмом.Во время прохождения через мозг кровь теряет около 8 об.%кислорода. В 1 мин на 100 г мозговой
ткани приходится 53–54 мл крови.Следовательно, 100 г мозга потребляет в 1 мин 3,7 мл кислорода, а
весьголовной мозг (1500 г) – 55,5 мл кислорода.
Метаболизм углеводов. Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин100 г
ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, чтоболее 90% утилизируемой глюкозы в ткани
мозга окисляется до СО2 и Н2Опри участии цикла трикарбоновых кислот. В физиологических условиях роль
пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисления глюкозы
присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная
форма НАДФ (НАДФН) используется для синтеза жирныхкислот и стероидов. Интересно отметить, что в
расчете на всю массуголовного мозга содержание глюкозы в нем составляет около 750 мг. За1 мин тканью мозга
окисляется 75 мг глюкозы. Следовательно, количествоглюкозы, имеющееся в ткани головного мозга, могло бы
быть достаточным лишь на 10 мин жизни человека.
Метаболизм макроэргов. Интенсивность обновления богатых энергией фосфорных соединений в го-
ловном мозге очень велика. Именно этим можно объяснить, что содержание АТФ и креатинфосфата в мозговой
ткани характеризуется значитель- ным постоянством. В случае прекращения доступа кислорода мозг может
≪просуществовать≫ немногим более минуты за счет резерва лабильных фосфатов.
Метаболизм аминокислот и белков Общее содержание аминокислот в ткани мозга человека в 8 раз
превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной
специфичностью. Так, концентрация свободной глутаминовой кислоты в мозге выше, чем в любом другом
органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глутамином и
трипептидом глутатионом приходится более 50% α-аминоазота головного мозга. Известно, что обмен
аминокислот в мозговой ткани протекает в разных направлениях. Прежде всего пул свободных аминокислот
используется как источник ≪сырья≫ для синтеза белков и биологически активных аминов.
Метаболизм липидов Липиды составляют около половины сухой массы головного мозга. Как
отмечалось, в нервных клетках серого вещества особенно много фосфоглицеридов, а в миелиновых оболочках
нервных стволов – сфингомиелина. Из фосфоглицеридов серого вещества мозга наиболее интенсивно
обновляются фосфатидилхолины и особенно фосфатидилинозитол. Обмен липидов миелиновых оболочек
протекает с небольшой скоростью. Холестерин, цереброзиды и сфингомиелины обновляются очень медленно.
Ткань головного мозга взрослого человека содержит много холестерина (около 25 г). У новорожденных в
головном мозге всего 2 г холестерина; количество его резко возрастает в первый год жизни (примерно в 3 раза),
при этом биосинтез холестерина происходит в самой мозговой ткани. У взрослых людей синтез холестерина в
головном мозге резко снижается. Основная часть холестерина в зрелом мозге находится в неэтерифици-
рованном состоянии, эфиры холестерина обнаруживаются в относительно высокой концентрации в участках
активной миелинизации.
|
Активность аминотрансфераз (АлАт и АсАт) в крови. |
Метод определения активности АлАт и АсАт основан на определении оптической плотности дифенилгидразона пирувата, явлвющегося продуктом дезаминирования аланина и иаспартата. |
АлАт 0.1-0.7
АсАт 0.1-0.55 |
Повышение активности аминотрансфераз в сыворотке крови отмечено при целом ряде заболеваний и особенно при поражении органов и тканейЮ, богатых данными ферментами (печень, миокард). АсАт – резкое повышение через 6-12 часов после возникновения инфаркта миокарда, достигает максимума к 24-48 часам, а затем постепенно к 5 дню приходит к норме. Если к 4-5 дню активность АсАт не снижается, то пророгноз плохой. АлАт – при заболеваниях печени, токсических поражениях печени, холепатиях, холестазе, дерматомиозите. Повышение активности АлАт наблюдается при остром инфаркте миокарда, но не столь резко по сравнению с изменением АсАт. В норме соотношение акимвности АлАт и АсАт= 1.33±0.42. У больных инфекционным гепатитом происходит снижение коэффициента, а при инфаркте миокарда – резко возрастает. |

Строение ферментов. Структура и функции активного центра. Механизм действия ферментов. Кофакторы
ферментов: ионы металлов и коферменты, их участие в работе ферментов. Активаторы ферментов: механизм
действия. Ингибиторы ферментативных реакций: конкурентные, неконкурентные, необратимые. Лекарственные
препараты – ингибиторы ферментов (примеры).
По строению ферменты могут быть:
1. однокомпонентные (простые белки),
2. двухкомпонентные (сложные белки).
К ферментам - простым белкам – относятся пищеварительные ферменты (пепсин, трипсин). К ферментам –
сложным белкам – можно отнести ферменты, катализирующие окислительно - восстановительные реакции. Для
каталитической активности двухкомпонентных ферментов необходим дополнительный химический компонент,
который называется кофактор, их могут играть как неорганические вещества (ионы железа, магния, цинка,
меди и др.), так и органические вещества – коферменты (например, активные формы витаминов). Для работы
ряда ферментов необходимы и кофермент, и ионы металлов (кофактор). Коферменты – низкомолекулярные
органические вещества небелковой природы, связанные с белковой частью фермента временно и непрочно. В
случае, когда небелковая часть фермента (кофермент) связана с белковой прочно и постоянно, то такую
небелковую часть называют простетической группой. Белковая часть сложного белка-фермента называют
апоферментом. Вместе апофермент и кофактор образуют холофермент.
В процессе ферментативного катализа, принимает участие не вся белковая молекула, а лишь
определенный участок – активный центр фермента. Активный центр ферментов представляет часть молекулы
фермента, к которой присоединяется субстрат и от которой зависят каталитические свойства молекулы
фермента. В активном центре фермента выделяют «контактный» участок – участок, притягивающий и
удерживающий субстрат на ферменте благодаря своим функциональным группам и «каталитический»
участок, функциональные группы которого непосредственно участвуют в каталитической реакции. У
некоторых ферментов, кроме активного центра, имеется еще «другой» центр – аллостерический. С
аллостерическим центром взаимодействуют различные вещества (эффекторы), чаще всего различные
метаболиты. Соединение этих веществ с аллостерическим центром приводит к изменению конформации
фермента (третичной и четвертичной структуры). Активный центр в молекуле фермента либо создается, либо он
нарушается. В первом случае реакция ускоряется, во втором случае тормозится. Поэтому аллостерический центр
называют регуляторным центром фермента. Ферменты, имеющие в своей структуре аллостерический центр,
называются регуляторными или аллостерическими.В основу теории механизма действия ферментов положено
образование фермент-субстратного комплекса. Механизм действия фермента:
1. образование фермент-субстратного комплекса, субстрат прикрепляется к активному центру
фермента.
2. на второй стадии ферментативного процесса, которая протекает медленно, происходят
электронные перестройки в фермент-субстратном комплексе. Фермент (En) и субстрат (S) начинают
сближаться, чтобы вступить в максимальный контакт и образовать единый фермент-субстратный
комплекс. Продолжительность второй стадии зависит от энергии активации субстрата или
энергетического барьера данной химической реакции. Энергия активации – энергия, необходимая для
перевода всех молекул 1 моля S в активированное состояние при данной температуре. Для каждой
химической реакции существует свой энергетический барьер. Благодаря образованию фермент-
субстратного комплекса снижается энергия активации субстрата, реакция начинает протекать на более
низком энергетическом уровне. Поэтому вторая стадия процесса лимитирует скорость всего катализа.
3. на третьей стадии происходит сама химическая реакция с образованием продуктов реакции.
Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт
реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из
ферментативной реакции. Таким образом, фермент дает возможность за счет образования фермент-
субстратного комплекса проходить химической реакции обходным путем на более низком
энергетическом уровне.
Кофактор - небелковое вещество, которое обязательно должно присутствовать в организме в
небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав
кофактора входят коферменты и ионы металлов (например, ионы натрия и калия).
Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию,
связанную с присущей ему глобулярной структурой. Однако активность многих ферментов зависит от
небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и
кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+,
Cu2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют
коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и
коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время
протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными
ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой.
Роль кофактора в основном сводится к следующему:
изменение третичной структуры белка и создание комплементарности между ферментом и субстратом;
непосредственное участие в реакции в качестве еще одного субстрата.
Активаторами могут быть:
1) кофакторы, т.к. они важные участники ферментативного процесса. Например, металлы, входящие
в состав каталитического центра фермента: амилаза слюны активна в присутствии ионов Са,
лактатдегидрогеназа (ЛДГ) – Zn, аргиназа – Mn, пептидаза – Mg и коферменты: витамин С, производные
различных витаминов (НАД, НАДФ, ФМН, ФАД, КоАSH и др.). Они обеспечивают связывание активного
центра фермента с субстратом.
2) анионы также могут оказывать активирующее влияние на активность фермента, например, анионы
Сl- активируют слюнную амилазу;
3) активаторами могут служить также вещества, создающие оптимальное значение рН среды для проявления
ферментативной активности, например, НСl для создания оптимальной среды желудочного содержимого для
активации пепсиногена в пепсин;
4) активаторами являются также вещества, переводящие проферменты в активный фермент, например,
энтерокиназа кишечного сока активирует превращение трипсиногена в трипсин;
5) активаторами могут быть разнообразные метаболиты, которые связываются с аллостерическим центром
фермента и способствуют формированию активного центра фермента.
Ингибиторы - это вещества, которые тормозят активность ферментов. Различают два основных типа
ингибирования: необратимое и обратимое. При необратимом ингибировании - ингибитор прочно (необратимо)
связывается с активным центром фермента ковалентными связями, изменяет конформацию фермента. Таким
образом, могут действовать на ферменты соли тяжелых металлов (ртути, свинца, кадмия и др.). Обратимое
ингибирование - это такой тип ингибирования, когда активность ферментов может восстанавливаться.
Обратимое ингибирование бывает 2-х типов: конкурентное и неконкурентное. При конкурентном
ингибировании обычно субстрат и ингибитор очень похож по химическому строению. При этом виде
ингибирования субстрат (S) и ингибитор (I) одинаково могут связываться с активным центром фермента. Они
конкурируют друг с другом за место в активном центре
фермента. Классический пример, конкурентного
ингибирование – торможение действия
сукцинатдегидрогеназы малоновой кислотой.
Неконкурентные ингибиторы связываются с
аллостерическим центром фермента. Вследствие этого
происходят изменения конформации аллостерического
центра, которые приводят к деформации
каталитического центра фермента и снижению
ферментативной активности. Часто аллостерическими
8
неконкурентными ингибиторами выступают продукты метаболизма. Лекарственные свойства ингибиторов
ферментов (Контрикал, Трасилол, Аминокапроновая кислота, Памба). Контрикал (апротинин) применяют для
лечения острого панкреатита и обострения хронического панкреатита, острого панкреонекроза, острых
кровотечений.
Понятие о белках крови. Белки крови как гетерогенная система. Отдельные функции белков, их
функциональная роль. Физиологические и патологические белки. Качественные и количественные изменения
белков крови. Понятие о гипер-, гипо-, парапротеинемии. Белковый коэффициент.
Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод
высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины,
глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов
– 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой. Синтез
белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы.
Физиологическая роль белков плазмы крови многогранна. 1. Белки поддерживают коллоидно-осмотическое
(онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше,
чем в тканевой жидкости. Белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить
из кровяного русла. Несмотря на то что онкотическое давление составляет лишь небольшую часть (около 0,5%)
от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над
осмотическим давлением тканевой жидкости. 2. Белки плазмы принимают активное участие в свертывании
крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови. 3.
Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4– раз выше вязкости
воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе.
крови.
|
Количественное определение витамина С в моче. |
Количество аскорбиновой кислоты определяется титриметрически по количеству 2,6-дихлорфенолиндо-фенола, пошедшего на титрование, и рассчитывается на суточное количество мочи. 2,6-дихлорфенолиндофе-нол (синего цвета) восстанавливается и обесцвечивается витамином С. |
20 – 30 мг аскорбиновой кислоты за сутки |
Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей. ДИАГНОСТИКА ГИПОВИТАМИНОЗА С: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается. |

Углеводсодержащие белки (гликопротеины и протеогликаны). Простетическая группа
гликопротеинов может быть представлена моносахаридами (глюкозой, галактозой, маннозой, фруктозой, 6-
дезоксигалактозой), их аминами и ацетилированными производными аминосахаров (ацетилглюкоза,
ацетилгалактоза. На долю углеводов в молекулах гликопротеинов приходится до 35%. Гликопротеины
преимущественно глобулярные белки. Углеводный компонент протеогликанов может быть представлен
несколькими цепями гетерополисахаридов. Биологические функции гликопротеинов: 1. транспортная (белки
крови глобулины транспортируют ионы железа, меди, стероидные гормоны); 2. защитная: фибриноген
осуществляет свертывание крови; б. иммуноглобулины обеспечивают иммунную защиту; 3. рецепторная (на
поверхности клеточной мембраны расположены рецепторы, которые обеспечивают специфическое
взаимодействие).4. ферментативная (холинэстераза, рибонуклеаза); 5.гормональная (гормоны передней доли
гипофиза – гонадотропин, тиреотропин). Биологические функции протеогликанов: гиалуроновая и
хондроитинсерная кислоты, кератинсульфат выполняют структурную, связующую, поверхностно-механическую
функции.
Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови,условно можно разделить
на 3 группы: секреторные, индикаторные и экскреторные.
Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют
определенную физиологическую роль. Типичными представителями данной группы являются ферменты,
участвующие в процессе свертывания крови, и сывороточная холинэстераза.
Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные
внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие
– в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза) и т.д.
Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах.
При поражении тех или иных тканей ферменты из клеток ≪вымываются≫в кровь; их активность в сыворотке
резко возрастает, являясь индикатором степени и глубины повреждения этих тканей.
Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза,
щелочная фосфатаза и др.). В физиологических
условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы,
регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах
выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается.
Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны
ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности,
относится γ-глутамилтранспептидаза, или γ-глутамилтрансфераза (ГГТ). Данный фермент –
высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром
инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке
желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении
печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко –
после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы.
Органоспецифическими ферментами для печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа
и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствуето
поражении печеночной ткани. В настоящее время особо важным лабораторным тестом стало исследование
активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце
наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5.
|
Определение холестеринового индекса атерогенности. |
К=Х – Х ЛВП ХЛВП |
Здоровые 20 – 30 лет 2 – 2.5 Старше 30 лет 3 – 3.5 Больные атеросклерозом 4 - 7 |
Индекс атерогенности является прогностическим показателем развития атеросклероза. |

Половые гормоны: андрогены, эстрогены. Химическая природа. Механизм действия на молекулярном
уровне, влияние на обмен веществ. Нарушения обмена при недостатке и избытке этих гормонов в организме.
Женские половые гормоны. Основным местом синтеза женских половых гормонов – эстрогенов –
являются яичники и желтое тело. В настоящее время открыты 2 группы женских половых гормонов,
различающихся своей химической структурой и биологической функцией: эстрогены (главный представитель –
эстрадиол) и прогестины (главный представитель – прогестерон). Наиболее активный эстроген – эстрадиол,
синтезируется преимущественно в фолликулах; два остальных эстрогена являются производными эстрадиола и
синтезируются также в надпочечниках и плаценте. Все эстрогены состоят из 18 атомов углерода. Секреция
эстрогенов и прогестерона яичником носит циклический характер, зависящий от фазы полового цикла: в первой
фазе цикла синтезируются в основном эстрогены, а во второй – преимущественно прогестерон. Основная
биологическая роль эстрогенов и прогестерона, синтез которых начинается после наступления половой
зрелости, заключается в обеспечении репродуктивной функции организма женщины. В этот период они
вызывают развитие вторичных половых признаков и создают оптимальные условия, обеспечивающие
возможность оплодотворения яйцеклетки после овуляции. Прогестерон выполняет в организме ряд
специфических функций: подготавливает слизистую оболочку матки к успешной имплантации яйцеклетки в
случае ее оплодотворения, а при наступлении беременности основная роль – сохранение беременности;
оказывает тормозящее влияние на овуляцию и стимулирует развитие ткани молочной железы. Эстрогены
оказывают анаболическое действие на организм, стимулируя синтез белка. Мужские половые гормоны.
Биосинтез андрогенов осуществляется главным образом в семенникахи частично в яичниках и надпочечниках
Биологическая роль андрогенов в мужском организме в основном связана с дифференцировкой и
функционированием репродуктивной системы, причем в отличие от эстрогенов андрогенные гормоны уже в
эмбриональном периоде оказывают существенное влияние на дифференцировку мужских половых желез, а
также других тканей, определяя характер секреции гонадотропных гормонов у взрослых. Во взрослом организме
андрогены регулируют развитие мужских вторичных половых признаков, сперматогенез в семенниках и т.д.
Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, гаммааминомасляная кислота,
катехоламины. Их происхождение, функции, расщепление. Образование токсических аминов в толстом
кишечнике, их обезвреживание в печени.
Процесс отщепления карбоксильной группы аминокислот в виде CO2 получил название
декарбоксилирования. В животных тканях установлено декарбоксилирование следующих аминокислот и их
производных: тирозина,триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ-
оксиглутаминовой кислот, 3,4-диоксифенилаланина, цистеина, аргинина, орнитина, S-аденозилметионина и α-
аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование ряда
других аминокислот. Биогенные амины — вещества, обычно образующиеся в организме животных или
растений из аминокислот при их декарбоксилировании (удалении карбоксильной группы)
ферментами декарбоксилазами и обладающие высокой биологической активностью. К биогенным аминам
относятся дофамин, норадреналин и адреналин (синтезируются изначально из
аминокислоты тирозина), серотонин, мелатонин и триптамин и многие другие соединения. В организме
животных многие биогенные амины выполняют роль гормонов и нейромедиаторов. Разлагаются в организме
при участии ферментов аминоксидаз. Реакции декарбоксилирования являются необратимыми. Они
катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от
декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента.
|
Количественное определение активности амилазы сыворотки крови амилокластическим методом. |
Амилаза сыворотки крови гидролизует крахмал в течение 60 минут. Остаток крахмала выявляется качественной реакцией с йодом. Активность амилазы определяется по разности окраски между контролем и опытом на ФЭКе. |
16 – 30 мг крахмала, гидролизуемого за 1 час 1 мл сыворотки крови. |
Определение активности амилазы сыворотки крови является диагностическим тестом при заболеваниях поджелудочной железы. Фермент обладает небольшой молекулярной массой и размерами, легко проникает в кровь из поджелудочной железы и кишечника, фильтруется в мочу. Увеличение активности амилазы крови наблюдается при заболеваниях поджелудочной и околоушной желез, диабетическом кетоацидозе, заболеваниях желчных путей. |

Нуклеопротеины - сложные белки, в состав которых входит белок (протамин или гистон), небелковая
часть представлена нуклеиновыми кислотами (НК): дезоксирибонуклеиновой кислотой (ДНК) и
рибонуклеиновой кислотой (РНК). Протамины и гистоны – белки с резко выраженными основными свойствами,
т.к. они содержат более 30% арг и лиз. Нуклеиновые кислоты (НК) - это длинные полимерные цепи,
состоящие из многих тысяч мономерных единиц, которые соединяются между собой 3`,5`- фосфоди-эфирными
связями. Мономером НК является мононуклеотид, который состоит из азотистого основания, пентозы и остатка
фосфорной кислоты. Азотистые основания бывают пуриновые (А и Г) и пиримидиновые (Ц, У, Т). В качестве
пентозы выступает β– Д- рибоза или β –Д- дезоксирибоза. Азотистое основание соединено с пентозой N-
гликозидной связью. Пентоза и фосфат связаны друг с другом сложноэфирной связью между –ОН группой,
расположенной у С5’-атома пентозы, и фосфатом. Виды нуклеиновых кислот: 1. ДНК содержит А, Г, Т и Ц,
дезоксирибозу и фосфорную кислоту. ДНК находится в ядре клетки и составляет основу сложного белка
хроматина. 2. РНК содержит А, Г, У и Ц, рибозу и фосфорную кислоту. Различают 3 вида РНК: а) м-РНК
(информационная или матричная) – копия участка ДНК, содержит информацию о структуре белка; б) р-РНК
образует скелет рибосомы в цитоплазме, выполняет важную роль при сборке белка на рибосоме в процессе
трансляции; в) т-РНК участвует в активации и транспорте АК к рибосоме, локализована в цитоплазме. НК
имеют первичную, вторичную и третичную структуры. Первичная структура НК одинакова для всех видов –
линейная полинуклеотидная цепь, в которой мононуклеотиды связаны 3’, 5’-фосфодиэфирными связями.
Каждая полинуклеотидная цепь имеет 3’ и 5’ , эти концы заряжены отрицательно. Вторичная структура ДНК
представляет собой двойную спираль. ДНК состоит из 2-х цепей, закрученных в спираль вправо вокруг оси.
Виток спирали = 10 нуклеотидов, что составляет в длину 3,4 нм. Обе спирали антипараллельны. Третичная
структура ДНК. Это результат дополнительного скручивания в пространстве молекулы ДНК. Это происходит
при взаимодействии ДНК с белком. При взаимодействии с октамером гистона двойная спираль накручивается на
октамер, т.е. превращается в суперспираль. Вторичная ____структура РНК – полинуклеотидная нить, изогнутая в
пространстве. Эта изогнутость обусловлена образованием водородных связей между комплементарными
азотистыми основаниями. У т-РНК вторичная структура представлена «клеверным листом», в котором
различаю комплементарные и некомплементарные участки. Вторичная структура р-РНК – спираль одиночной
изогнутой РНК, а третичная – скелет рибосомы. Поступая из ядра в ЦЗ, м-РНК образует со специфическими
белками – информомерами комплексы (третичная структура м-РНК) и называются информосомами.
Обмен галактозы, фруктозы,маннозы. Взаимопревращение моносахаров в организме. Наследственные нарушения обмена моносахаридов: галактоземия, непереносимость фруктозы.
Нарушения, связанные с недостаточностью ферментов, которые принимают участие в переваривании и
всасывании УВ.
1. Непереносимость лактозы: а) врожденная. Дефект по лактазе в просвете тонкого кишечника. Большой
осмотический эффект невсосавшейся лактозы вызывает приток жидкости в тонкий кишечник, поэтому
клиническими симптомами являются вздутие живота, тошнота, судороги, боль и водная диарея. Наследуется по
аутосомно-рецессивному типу. б) приобретенная (временная). Может быть, и у взрослых вследствие
инфекционных заболеваний или интенсивного лечения антибактериальными препаратами.
2. Нарушения обмена фруктозы: а) Фруктоземия (наследственная непереносимость фруктозы).
Недостаточность фермента кетозо-1- фосфат-альдолазы приводит к резкому увеличению концентрации
фруктозо-1-фосфата в клетках печени, вследствие чего развиваются хроническая недостаточность функций
печени и почек, гипогликемия, диарея, рвота, боли в животе. б) Эссенциальная фруктозурия. Причина:
недостаток фруктокиназы. Следствие: нарушение фосфорилирования фруктозы приводит к повышению
содержания фруктозы в крови и аномальному выведению фруктозы с мочой. Это нарушение не вызывает
патологических симптомов.
3. Нарушения обмена галактозы: а) Галактоземия. Причина: недостаток фермента гексозо-1-
фосфатуридилтрансфераза печени. Больные дети плохо растут, прием молока вызывает рвоту и понос.
Происходит увеличение печени и желтуха. При этом заболевании увеличивается концентрация галактозы и
галактозо-1-фосфата. Галактоземия сопровождается галактозурией. У детей галактоземия приводит к
умственной отсталости и катаракте хрусталика. Определяющим диагностическим критерием служит отсутствие в
эритроцитах гексозо-1-фосфатуридилтрансферазы. б) Недостаток галактокиназы. Происходит накопление
галактозы и ее превращение в галактитол. Следствие: раннее развитие катаракты.
|
Количественное определение содержания ЛПНП в сыворотке крови. |
ЛПНП способны осаждаться в присутствии хлорида кальция и гепарина. По степени помутнения раствора судят о концентрации ЛПНП в сыворотке крови. |
3 – 4.5 г/л |
Увеличение ЛПНП наблюдается при наследственном холестеринозе, сахарном диабете, нефрозах, гепатитах, хроническом алкоголизме, ксантоматозе, ожирении. |

Инсулин, получивший свое название от наименования панкреатических
островков. Молекула инсулина, содержащая 51 аминокислотный остаток,
состоит из двух полипептидных цепей, соединенных между собой в двух точках
дисульфидными мостиками. В физиологической регуляции синтеза инсулина
доминирующую роль играет концентрация глюкозы в крови. Так, повышение
содержания глюкозы в крови вызывает увеличение секреции инсулина в
панкреатических островках, а снижение ее содержания, наоборот,– замедление
секреции инсулина. Этот феномен контроля по типу обратной связи
рассматривается как один из важнейших механизмов регуляции содержания
глюкозы в крови. При недостаточной секреции инсулина развивается
специфическое заболевание – сахарный диабет. Физиологические эффекты инсулина:Инсулин — единственный
гормон, снижающий содержание глюкозы в крови, это реализуется через:
усиление поглощения клетками глюкозы и других веществ;
активацию ключевых ферментов гликолиза;
увеличение интенсивности синтеза гликогена — инсулин форсирует запасание глюкозы клетками
печени и мышц путѐм полимеризации еѐ в гликоген;
уменьшение интенсивности глюконеогенеза — снижается образование в печени глюкозы из различных
веществ
Анаболические эффекты
усиливает поглощение клетками аминокислот (особенно лейцина и валина);
усиливает транспорт в клетку ионов калия, а также магния и фосфата;
усиливает репликацию ДНК и биосинтез белка;
усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени
инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит
обратное — мобилизация жиров.
Антикатаболические эффекты
подавляет гидролиз белков — уменьшает деградацию белков;
уменьшает липолиз — снижает поступление жирных кислот в кровь.
Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению
глюкагон является пептидным гормоном. Молекула глюкагона состоит из 29 аминокислот.
Механизм действия глюкагона обусловлен его связыванием со специфическими
глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком
активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление
катаболизма депонированного в печени гликогена. Глюкагон оказывает сильное инотропное и хронотропное
действие на миокард вследствие увеличения образования. Результатом является повышение артериального
давления, увеличение частоты и силы сердечных сокращений.
Биосинтез пиримидиновых нуклеотидов, этапы этого процесса. Оротацидурия. Распад пиримидиновых
нуклеотидов. Биосинтез дезоксирибонуклеотидов. Участие УТФ и ЦТФ в обменных процессах.
Синтез пуринов и пиримидинов приводит к монофосфатам, соответственно ИМФ (IMP] и УМФ (UMP).
Из этих двух предшественников синтезируются все другие нуклеотиды. Синтез пуриновых
нуклеотидов осуществляется изинозинмонофосфата [ИМФ (IMP)]. Его основаниегипоксантин превращается
в две стадии соответственно в аденин или гуанин. Образующиеся нуклеозидмонофосфаты АМФ (AMP)
и ГМФ (GMP) переходят в дифосфатыАДФ(ADP) иГДФ (GDP) под действиемнуклеозидфосфаткиназ и,
наконец, фосфорилируютсянуклеозиддифосфаткиназами до трифосфатовАТФ (АТР) иГТФ (GTP).
Нуклеозидтрифосфаты служат строительными блоками для РНК (RNA) или функционируют в качестве
коферментов. Преобразование рибонуклеотидов в дезоксирибонуклеотиды происходит на стации дифосфатов и
катализируется нуклеозиддифосфат-редуктазой. Пути биосинтеза пиримидиновых нуклеотидов: прежде всего
исходный УМФ фосфорилируется до ди-, а затем трифосфатаУТФ. УТФ превращаетсяцитидинтрифосфат-
синтазой (CTP-синтаза) вЦТФ. 2'-Дезоксирибоза, структурный элемент ДНК, не синтезируется в виде
свободного сахара, а образуется на стадии дифосфата при восстановлении ρибонуклеозиддифосфатов. Такое
восстановление — сложный процесс, в котором участвует несколько белков. Необходимые восстановительные
эквиваленты поставляются НАДФН (NADPH). Тем не менее, они не переносятся непосредственно от
кофермента к субстрату, а проходит прежде всего через ряд окислительно-восстановительных реакций. На
первой стадии тиоредоксинредуктаза восстанавливает с помощью связанного с ферментом
флавинадениндинуклеотида небольшой белок, тиоредоксин. При этом дисульфидный мостик в тиоредоксине
расщепляется. Образующиеся SH-группы снова восстанавливают каталитически активный дисульфидный
мостик в нуклеозиддифосфат-редуктазе («рибонуклеотид-редуктаза»). Свободные SH-группы являются
действенными донорами электронов для восстановления рибонуклеотиддифосфатов. Рибонуклеотид-редуктаза
эукариот представляет собой тетрамер, состоящий из двух R1- и R2 -субъединиц. Кроме
упомянутого дисульфидного мостика, в ферменте во время реакции образуетсятирозин-радикал,
генерирующий радикал в субстрате. Последний отщепляет молекулу воды и вследствие этого переходит в
радикал-катион. При последующем восстановлении образуется остаток дезоксирибозы и регенерируется
тирозиновый радикал. Процесс регуляции рибонуклеотид-редуктазы имеет довольно сложный механизм.
Субстратная специфичность и активность фермента контролируются двумя аллостерическими центрами
связывания R1-субъединицы. АТФ и дАТФ соответственно повышают и уменьшают активность редуктазы,
связываясь с центром а. С центром б взаимодействует другой нуклеотид, изменяющий в результате связывания
субстратную специфичность фермента.
|
Количественное определение витамина С в моче. |
Количество аскорбиновой кислоты определяется титриметрически по количеству 2,6-дихлорфенолиндо-фенола, пошедшего на титрование, и рассчитывается на суточное количество мочи. 2,6-дихлорфенолиндофе-нол (синего цвета) восстанавливается и обесцвечивается витамином С. |
20 – 30 мг аскорбиновой кислоты за сутки |
Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей. ДИАГНОСТИКА ГИПОВИТАМИНОЗА С: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается. |

Гормоны щитовидной железы: трийодтиронин и тироксин. Химическая природа, биосинтез. Механизм
действия гормонов на молекулярном уровне, биологический эффект. Изменение обмена вещества при
гипертиреозе. Механизм возникновения эндемического зоба и его предупреждение.
Тироксин и трийодтиронин – основные гормоны фолликулярной части щитовидной железы. Помимо
этих гормонов (биосинтез и функции которых будут рассмотрены ниже), в особых клетках – так называемых
парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной природы,
обеспечивающий постоянную концентрацию кальция в крови. Он получил название ≪кальцитонин≫.
Биологическое действие кальцитонина прямо противоположно эффекту паратгормона: он вызывает подавление
в костной ткани резорбтивных процессов и соответственно гипокальциемию и гипофосфатемию. Из L-
тиронина легко синтезируется гормон щитовидной железы тироксин, содержащий в 4 положениях кольцевой
структуры йод Биологическое действие гормонов щитовидной железы распространяется на множество
физиологических функций организма. В частности, гормоны регулируют скорость основного обмена, рост и
дифференцировку тканей, обмен белков, углеводов и липидов, водно-электролитный обмен, деятельность ЦНС,
пищеварительного тракта, гемопоэз, функцию сердечнососудистой системы, потребность в витаминах,
сопротивляемость организма инфекциям и др. Гипофункция щитовидной железы в раннем детском возрасте
приводит к развитию болезни, известной в литературе как кретинизм. Помимо остановки роста, специфических
изменений кожи, волос, мышц, резкогоснижения скорости процессов обмена, при кретинизме отмечаются
глубокие нарушения психики; специфическое гормональное лечение в этом случае не дает положительных
результатов. Повышенная функция щитовидной железы (гиперфункция) вызывает развитие гипертиреоза.
Аэробный распад глюкозы: этапы этого процесса и его энергетика. Физиологическое значение аэробного
распада глюкозы.
Аэробный путь окисления глюкозы и его энергетика. Аэробный путь окисления глюкозы происходит в
3 этапа: 1. окисление молекулы глюкозы до 2 молекул пирувата; 2. окислительное декарбоксилирование
пирувата (с образованием 2 молекул ацетил-КоА); 3. реакции цикла Кребса, где каждая молекула ацетил-КоА
сгорает с образованием 12 АТФ.
1-ый этап. Окисление молекулы глюкозы до 2 молекул пирувата - это первые 10 реакций гликолиза.
Суммарная реакция 1 этапа:
Глюкоза + 2 НАД++ 2 АДФ → 2 пирувата + 2 НАДН + Н+ + 2 АТФ
2-ой этап. Окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетилКоА) происходит в
матриксе митохондрий и осуществляется мультиферментным комплексом пируватдегидрогеназой. В его состав
входят 3 фермента и 5 коферментов: 1. Пируватдекарбоксилаза – кофермент тиаминпирофосфат (активная
28
форма витамина В1). 2. Дегидролипоилацетилтрансфераза – кофермента: в активном центре – липоевая
кислота (витаминоподобное вещество), из матрикса митохондрий используется Коэнзим А (КоА~SH). 3.
Дигидролипоилдегидрогеназа – коферменты: в активном центре – ФАД, из матрикса митохондрий используется
– НАД. Суммарная реакция:
2 Пируват + 2 НАД+ + КоА → 2 ацетил-КоА + 2 НАДН + Н+
Каждый восстановленный НАД в митохондриях отдает протоны и электроны в полную ц.п.э., где образуется 2 х
3 АТФ = 6 АТФ. Таким образом, ценность второго этапа – 6 АТФ. Эти реакции происходят только в аэробных
условиях!
3-ий этап. Реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ.
Следовательно, энергетический выход третьего этапа (в расчете на молекулу глюкозы) – 2 х 12 АТФ = 24 АТФ .
Энергетическая ценность аэробного окисления глюкозы: 1 этап – 8 (6) АТФ 2 этап – 6 АТФ 3 этап – 24 АТФ Итого:
38 (36) АТФ (разница в 2 АТФ зависит от челнока, который переносит протоны и электроны из цитозоля от НАДН,
образованного в 6-ой реакции гликолиза в митохондрии в ц.п.э.). Аэробное окисление глюкозы является
главным источником энергии для большинства клеток организма.
|
Наличие свободной HCl в желудочном содеожимом.
Определение свободной HCl в желудочном содержимом. |
Для реакции на свободную HCl используют бумагу Конго. В сильно кислой среде Конго имеет синюю окраску, а в слабо кислой, нейтральной и щелочной – красную.
Титрование желудочного содержимого 0.1N раствором NaOH в присутствии фенолфталеина и диметиламиноазобензола. О содержании свободной HCl судят по количеству 0.1 N NaOH, пошедшего на титрование 100 мл желудочного содержимого |
20 – 40 титр. ед.
40 – 60 титр. ед. |
В клинической практике широко используется как качественный, так и количественный метод анализа желудочного содержимого. Патологические изменения содержания HCl: гиперхлоргидрия – увеличение свободной HCl характерно для гиперацидного гастрита, язвы желудка и 12-перстной кишки. Гипохлоргидрия – снижение свободной HCl наблюдается при гипоацидном гастрите. Ахлоргидрия – полное отсутствие HCl в желудочном содержимом. Повышение общей кислотности более 60 т. ед. – гиперацидитас (язва желудка, 12-перстной кишки, гиперацидный гастрит). Снижение общей кислотности (менее 40 т.ед.) – гипоацидитас наблюдается при гипоацидном гастрите, снижении секреторной функции обкладочных клеток слизичтой желудка. |

Простые и сложные белки, их классификация. Характер связей простетических групп с белком.
Биологические функции белков. Способность к специфическим взаимодействиям с лигандом.
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно
только на свободные аминокислоты. Сложные белки – это двухкомпонентные белки, которые состоят из
какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе
сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп:
протамины, гистоны, альбумины, глобулины, проламины, глютелины и др. Классификация сложных белков:
фосфопротеины (содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты),
нуклеопротеины (содержат нуклеиновые кислоты), гликопротеины (содержат углеводы), липопротеины
(содержат липиды) и металлопротеины (содержат металлы).Активный центр белковой молекулы. При
функционировании белков может происходить их связывание с лигандами – низкомолекулярными веществами.
Лиганд присоединяется к определенному участку в белковой молекуле – активному центру. Активный центр
формируется на третичном и четвертичном уровнях организации белковой молекулы и образуется благодаря
притяжению боковых радикалов определенных аминокислот (между -ОН группами сер формируются
водородные связи, ароматические радикалы связаны гидрофобными взаимодействиями, -СООН и –NH2 -
ионными связями).
Пентозофосфатный цикл - совокупность обратимых ферментативных реакций, в результате которых происходит окисление глюкозы до CO2 с образованием восстановленного никотинамидадениндинуклеотидфосфата (НАДФН) и H + , а также синтез фосфорилированных сахаров, содержащих от 3 до 7атомов С.
Пентозофосфатный цикл осуществляется в цитозоле (жидкой фазе) клеток животных, растений (особенно в темноте) и микроорганизмов.
Пентозофосфатный цикл начинается с окисления глюкозо-6-фосфата и последующего окислительного декарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла. Вторая стадия включает неокислительные превращения пентозофосфатов с образованием исходного глюкозо-6-фосфата.
Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы и кофермента НАДФ+. Образовавшийся в ходе реакции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконолактоназы с образованием 6-фос-фоглюконовой кислоты (6-фосфоглюконат).
Во второй – окислительной – реакции, катализируемой 6-фосфоглюко-натдегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 молекула НАДФН.
Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза – ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия.
При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап (стадия)пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотрио-зы), а другие – специфические для пентозофосфатного пути (седогептуло-зо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакции катализируют превращение изомерных пентозо-5-фосфатов.
Коферментом в транскетолазной реакции служит ТПФ, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат.
Транскетолазная реакция в пентозном цикле встречается дважды, второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй молекулыксилулозо-5-фосфата с эритро-зо-4-фосфатом.
Шесть молекул глюкозо-6-фосфата, вступая в пентозофосфатный цикл, образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2, после чего из 6 молекул рибулозо-5-фосфата снова регенерируется 5 молекул глюко-зо-6-фосфата (см. рис. 10.12). Однако это не означает, что молекула глюкозо-6-фосфата, вступающая в цикл, полностью окисляется. Все 6 молекулСО2 образуются из С-1-атомов 6 молекул глюкозо-6-фосфата.
Значение этого пути в обмене веществ велико. Он поставляет восстановленный НАДФН, необходимый длябиосинтеза жирных кислот, холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность организма в НАДФН.
Другая функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтеза нуклеиновых кислот и многих коферментов. При ряде патологических состояний удельный вес пенто-зофосфатного пути окисления глюкозы возрастает.
|
Белок плазмы крови А) экспресс-метод (метод «висящей» капли) |
В основу метода положена зависимость между содержанием белков в плазме и цельной крови и ее удельным весом. Определение удельного веса плазмы и цельной крови осуществляется путем погружения капли в растворы CuSO4известного веса. Тот раствор CuSO4 , в котором капля сначала повисает, а затем опускается, равен удельному весу исследуемой жидкости. |
65-85 г/л 6.5-8.5 мг% |
Гиперпротеинемия – увеличение общего содержания белков плазмы крови наблюдается при диарее у детей, рвоте, непроходимости верхнего отдела тонкой кишки, обширных ожогах. Потеря воды организмом приводит к повышению концентрации белка в крови: а) относительная гиперпротеинемия связана с потерей воды организмом (диарея, рвота, ожоговая болезнь, травмы); б) абсолютная гиперпротеинемия обусловлена резким нарастанием глобулинов при инфекциях, а также синтезом патологических белков или белков «острой фазы». Гипопротеинемия – снижение общего содержания белков плазмы может быть обусловлено с несколькими причинами: а) нарушение белок-синтезирующей функции печени (паренхиматозная желтуха, гепатиты, цирроз печени). Происходит снижение белкового коэффициента за счет снижения синтеза альбуминов; б) задержкой воды при заболеваниях сердечно-сосудистой системы; в) потерей белка с мочой при патологии почек; г) кровопотерями при травмах и операциях |
|
Б) биуретовый метод |
Метод основан на образовании биуретового комплекса Cu(OН)2с пептидными связями, имеющего розово-фиолетовое окрашивание. Интенсивность окраски пропорциональна количеству пептидных связей. |
|
|
|
В) метод Лоури. |
Метод основан на способности белков образовывать окрашенные комплексы синего цвета при осуществлении двух цветных реакций – биуретовой и реакции Фолина (восстановление белками смеси фосфорновольфрамовой и фосфорномолиюденовой кислот – реактив Фолина). Интенсивность окраски зависит от количества белка. |
|
|

На скорость химической реакции влияют различные вещества. Те из них, которые тормозят ферментативные процессы, называются ингибиторами. Те же, которые усиливают реакции – активаторами.
1. Активаторы
1. Активаторами ферментов являются их субстраты.
2. Активаторами могут быть кофакторы, т.к. они важные участники ферментативного процесса. Например, металлы, входящие в состав каталитического центра фермента: амилаза слюны активна в присутствии ионов Са, лактатдегидрогеназа (ЛДГ) – Zn, аргиназа – Mn, пептидаза – Mg и коферменты: витамин С, производные различных витаминов (НАД, НАДФ, ФМН, ФАД, КоАSH и др.). Они обеспечивают связывание активного центра фермента с субстратом.
3. Анионы также могут оказывать активирующее влияние на активность фермента (анионы Сl- активируют слюнную амилазу).
4. Активаторами могут служить также вещества, создающие оптимальную рН для проявления ферментативной активности (НСl для создания оптимальной среды желудочного содержимого для активации пепсиногена в пепсин).
5. Активаторами являются также вещества, переводящие проферменты в активный фермент (энтерокиназа кишечного сока активирует превращение трипсиногена в трипсин),
6. Активаторами могут быть разнообразные метаболиты, которые связываются с аллостерическим центром фермента и способствуют формированию активного центра фермента.
2. Ингибиторы
Ингибиторы это вещества, которые тормозят активность ферментов. Различают два основных типа ингибирования:
1. необратимое,
2. обратимое.
1. При необратимом ингибировании ингибитор прочно (необратимо) связывается с активным центром фермента ковалентными связями, изменяет конформацию фермента. Таким образом могут действовать на ферменты соли тяжелых металлов (ртути, свинца, кадмия и др.), соединения мышьяка и другие токсические вещества, способные привести к необратимой денатурации апофермента (неспецифические ингибиторы).
Специфический необратимый ингибитор может связываться с ферментом и инактивировать в его активном центре функциональную группу, которая необходима для проявления его каталитической активности.
Обратимое ингибирование - это такой тип ингибирования, когда активность ферментов может восстанавливаться. Обратимое ингибирование бывает 2-х типов:
1. конкурентное
2. неконкурентное
1. При конкурентном ингибировании обычно субстрат и ингибитор очень похожи по химическому
строению. При этом виде ингибирования субстрат (S) и ингибитор (I) одинаково могут связываться с
активным центром фермента. Они конкурируют друг с другом за место в активном центре фермента.
Классический пример, (1) конкурентного ингибирование – торможение действия сукцинатдегидрогеназы
малоновой и щавелевоуксусной кислотами:
Многие лекарственные препараты оказывают свое терапевтическое действие по механизму конкурентного
ингибирования.
Таким образом, конкурентные ингибиторы уменьшают сродство фермента к субстрату. В случае
конкурентного ингибирования судьбу фермента решает концентрация субстрата или ингибитора. При
концентрации субстрата большей, чем концентрация ингибитора, субстрат вытесняет ингибитор из
активного центра фермента и реакция происходит.
2. Неконкурентные ингибиторы, как правило, связываются с аллостерическим центром фермента.
Вследствие этого происходят изменения конформации аллостерического центра, которые приводят к
изменению каталитического центра фермента и снижению ферментативной активности.
Часто аллостерическими неконкурентными ингибиторами выступают продукты метаболизма.
3. Аллостерические ферменты
Аллостерическими ферментами называют ферменты, активность которых регулируется веществами,
называемыми эффекторами. Эффекторами часто являются различные клеточные метаболиты (например,
конечные продукты реакций синтеза и распада).
Аллостерические ферменты обычно олигомерные белки, состоящие из нескольких протомеров; они имеют
аллостерический центр, пространственно удаленный от каталитического активного центра.
Существует 4 класса регуляторных ферментов:
1. ферменты, активность которых регулируются при связывании с ними аллостерических модуляторов
(положительных – активаторов и отрицательных - ингибиторов),
2. ферменты, регулируемые путем обратимой ковалентной модификации.
3. ферменты, регулируемые частичным протеолизом неактивного предшественника (профермента).
4. ферменты, активность которых регулируются ассоциацией/диссоциацией регуляторных и каталитических субъединиц.
1. Аллостерический центр имеется у сложных ферментов. С аллостерическим центром взаимодействуют различные вещества, чаще всего метаболиты химических реакций клеток (эффекторы или модуляторы). Модуляторы могут быть положительные – активаторы или отрицательные – ингибиторы. Соединение модуляторов с аллостерическим центром приводит к изменению конформации фермента.
Под действием активаторов реакция ускоряется, под действием ингибиторов - тормозится. Поэтому аллостерический центр называют центром регуляции активности фермента. Часто аллостерическими ингибиторами выступают конечные продукты процесса – это ингибирование по принципу обратной связи или ретроингибирование:
2. Регуляция путем обратимой ковалентной модификации осуществляется через процесс фосфорилирования и дефосфорилирования за счет изменения конформации активного центра фермента. При фосфорилировании фермента образуются ковалентные эфирные связи между –ОН группой сер и фосфорной кислотой.
3. Регуляция частичным протеолизом характерна для ферментов желудочно-кишечного тракта (например, пепсина, трипсина). Неактивная форма фермента (профермент) превращается в активную форму за счет гидролиза одной или нескольких пептидных связей в молекуле профермента. В результате этого происходит конформационная перестройка и формируется активный центр фермента. Например, в результате гидролитического отщепления гексапептида с N-конца трипсиногена формируется активный центр в оставшейся части молекулы.
4. Регуляция каталитической активности ассоциацией/диссоциацией протомеров.
Например, протеинкиназа А состоит из 4 субединиц 2 типов: 2 регуляторных и 2 каталитических. Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического циклического аденозинмонофосфата (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы. Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведет к ассоциации регуляторных и каталитических субъединиц протеинкиназы А с образованием неактивного комплекса.
Биосинтез глюкозы(глюконеогенез) из молочной кислоты. Глюконеогенез – обращение реакций гликолиза. Из
11 реакций гликолиза 3 необратимы (1-ая, 3-я и 10-я):
1. глюкоза → глюкозо-6 фосфат
2. фруктозо-6-фосфат → фруктозо-1,6-дифосфат
3. фосфоенолпируват → пируват
Для этих реакций существуют обходные пути.
Первый обходной путь начинается в матриксе митохондрий. Пируват проникает сквозь мембрану митохондрий
в матрикс митохондрии, затем пируват подвергается карбоксилированию под действием фермента
пируваткарбоксилаза (с использованием биотина и энергии АТФ). В результате этой реакции образуется
оксалоацетат. Затем оксалоацетат превращается в малат, чтобы выйти из митохондрий в цитозоль клетки для
дальнейшего превращения. В цитозоле малат обратимо превращается в оксалоацетат (под действием
цитозольной малатдегидрогеназы). Образовавшийся оксалоацетат под действием фермента
фосфоенолпируваткарбоксикиназы (при участии биотина и энергии ГТФ) превращается в фосфоенолпируват. В
дальнейшем реакции глюконеогенеза идут до образования фруктозо-1,6-дифосфата (обратимые реакции
гликолиза).
Второй обходной путь: Фруктозо-1,6-дифосфат + Н2О → фруктозо-6-фосфат + Фн (реакцию катализирует
фруктозо-1,6-бифосфатаза)
Третий обходной путь: Глюкозо-6-фосфат + Н2О → глюкоза + Фн (реакцию катализирует глюкозо-6-фосфатаза)
В процессе глюконеогенеза 7-я реакция гликолиза (1,3-дифосфоглицерат + АДФ ↔ 3- фосфоглицерат + АТФ)
расходуется 2 АТФ. В ходе синтеза глюкозы используются макроэргические соединения: 4 АТФ и 2 ГТФ.
Регуляция глюконеогенеза происходит с участием гормонов и с участием метаболитов.
1. Гормональная регуляция. Глюкокортикоиды проникают в клетку, усиливают биосинтез
ферментов глюконеогенеза, способствуют повышению уровня сахара в крови.
2. Метаболическая регуляция. Ацетил-КоА стимулирует пируваткарбоксилазу, осуществляющую
реакцию превращения пирувата в ЩУК и далее в глюкозу. АТФ участвует в процессах
карбоксилирования, стимулирует глюкозо-6-фосфатазу и фруктозо-1,6-бисфосфатазу,
усиливает процессы глюконеогенеза. Витамин Н (биотин) – кофермент пируваткарбоксилазы.
Фруктозо-2,6- дифосфат ингибирует фруктозо-1,6-бисфосфатазу.
Цикл Кори. В процессе анаэробного гликолиза в скелетных мышцах образуется лактат, который выходит из
клеток в кровь, доставляется в печень, где включается в реакции глюконеогенеза с образованием глюкозы.
Глюкоза выходит в кровь, доставляется к тканям, где используется как источник энергии. Цикл Кори выполняет
две важные функции: 1) обеспечивает утилизацию лактата в реакциях глюконеогеназа; 2) предотвращает
накопление лактата и развитие лактоацидоза (смещение рН в кислую сторону).
|
Количест-венное опре-деление би-лирубина в сыворотке крови мето-дом разбав-ления по Бакальчуку |
Метод основан на цветной реакции би-лирубина с диазореак-тивом. Для появления розово-фиолетовой окраски достаточно 0,00156 мг билирубина в 1 мл, что соответствует,16 мг%. Чтобы найти наименьшее количество сыворотки, дающее с диазореактивом характерную окраску и соответствующее 0,16 мг% билирубина, сыворотку разбавляют в геометрической прогрессии пока не будет найдена граница видимой окраски. Отметить последнюю пробирку, в которой наблюдается окраска от прибавления реактива. Расчет ведут по формуле: Билирубин (мг%) = 0,00156мг•разведение •100 |
1,7-20,5 мкмоль/л |
Определение общего билирубина и его фракций в крови имеет важное значение при дифференциальной диагностике желтух |

Витамин А, структура, участие в обменных процессах. Гипо- гипер- и авитаминоз А, их причины и
особенности проявления. Пищевые источники, суточная потребность.
Витамин А (ретинол) - циклический, ненасыщенный, одноатомный спирт. Витамин А содержится
только в животных продуктах: печени крупного рогатого скота и свиней, яичном желтке, молочных продуктах;
особенно богат этим витамином рыбий жир. Суточная потребность витамина А взрослого человека составляет
от 1 до 2,5 мг витамина. Биологические функции витамина А. В организме ретинол превращается в ретиналь и
ретиноевую кислоту, участвующие в регуляции ряда функций (в росте и дифференцировке клеток); они также
составляют фотохимическую основу акта зрения. Основные клинические проявления гиповитаминоза А.
Наиболее ранний и характерный признак недостаточности витамина А у людей - нарушение сумеречного зрения
(гемералопия, или "куриная" слепота). Специфично для авитаминоза А поражение глазного яблока -
ксерофтальмия, т.е. развитие сухости роговой оболочки глаза как следствие закупорки слѐзного канала в связи с
ороговением эпителия. Это, в свою очередь, приводит к развитию конъюнктивита, отѐку, изъязвлению и
размягчению роговой оболочки, т.е. к кератомаляции. Ксерофтальмия и кератомаляция при отсутствии
соответствующего лечения могут привести к полной потере зрения.
Регуляция углеводного обмена: саморегуляция, нейрогуморальная регуляция. Механизм действия глюкозы,
адреналина, инсулина и глюкокортикоидов на обмен углеводов. Уровень глюкозы крови в норме.
Гипергликемия и гипогликемия. Нарушения обмена углеводов при сахарном диабете. Биохимическая
диагностика сахарного диабета
В регуляции постоянства концентрации сахара в крови главную роль выполняет печень. При
избыточном поступлении углеводов в организм в печени происходит накопление гликогена, а при
недостаточном поступлении, наоборот, гликоген, в ней распадается до глюкозы. Таким образом
поддерживается нормальное количество сахара. Постоянство содержания глюкозы в крови, гликогена в печени
регулируется нервной системой. На обмен углеводов оказывает влияние кора больших полушарий головного
мозга. Доказательством этого является повышение сахара в моче у студентов после трудного экзамена. Центр
углеводного обмена находится в гипотоламусе и продолговатом мозге. Влияние гипоталамуса и коры больших
полушарий на углеводный обмен осуществляется преимущественно посредством симпатической нервной
системы, которая вызывает усиленную секрецию адреналина надпочечниками. Большое значение в углеводном
обмене имеют железы внутренней секреции — поджелудочная, щитовидная, надпочечники, гипофиз и др.,
которые под действием ЦНС регулируют ассимиляцию и диссимиляцию углеводов. Гормон поджелудочной
железы инсулин переводит глюкозу в гликоген и тем самым уменьшает количество сахара в крови. Адреналин и
гликогон увеличивают расщепление гликогена в печени, в мышцах, вследствие чего увеличивается содержание
сахара в крови. Следовательно, инсулин — это сахаропонижающий гормон, гликогон — сахароповышающий.
При снижении концентрации сахара в крови возбуждается центр углеводного обмена в гипоталамусе, который
дает импульсы поджелудочной железе, и она увеличивает выработку глюкагона до тех пор, пока содержание
глюкозы за счет распада гликогена не увеличится до нормального уровня.
|
Количественное определение содержания ЛПНП в сыворотке крови. |
ЛПНП способны осаждаться в присутствии хлорида кальция и гепарина. По степени помутнения раствора судят о концентрации ЛПНП в сыворотке крови. |
3 – 4.5 г/л |
Увеличение ЛПНП наблюдается при наследственном холестеринозе, сахарном диабете, нефрозах, гепатитах, хроническом алкоголизме, ксантоматозе, ожирении. |

Микросомальное окисление. Структурные компоненты и функции оксидаз, монооксигеназ и диоксигеназ.
Значение микросомального окисления для организма: обезвреживание природных и искусственных
экотоксикантов.
Свободное окисление. Одна из задач свободного (несопряженного) окисления – превращения
природных или неприродных субстратов, называемых в этом случае ксенобиотиками (ксено – несовместимый,
биос – жизнь). Они осуществляются ферментами диоксигеназами имонооксигеназами. Окисление протекает
при участии специализированных цитохромов, локализованных чаще всего в эндоплазматическом ретикулуме,
поэтому иногда этот процесс называют микросомальным окислением. В реакциях свободного окисления
участвуют также кислород и восстановленные дыхательные переносчики (чаще всего НАДФН). Акцептором
электронов является цитохром Р-450 (иногда цитохром b5). Окисление субстрата протекает по следующей
схеме:
SH + O2 –>SOH.
Механизм действия оксигеназ включает изменение валентности входящих в их состав ионов двухвалентных
металлов (железа или меди). Диоксигеназы присоединяют к субстрату молекулярный кислород, активируя его за
счет электрона атома железа в активном центре (железо при этом становится трехвалентным). Оксигенация
протекает как атака субстрата образующимся супероксид-анионом кислорода. Одной из биологически важных
реакций такого типа является превращение β-каротина в витамин А. Монооксигеназы требуют участия в
реакции НАДФН, атомы водорода которого взаимодействуют с одним из атомов кислорода, поскольку только
один электрон связывается с субстратом. К широко распространенным монооксигеназам относятся
разнообразные гидроксилазы. Они принимают участие в окислении аминокислот, оксикислот,
полиизопреноидов. В процессе свободного окисления вследствие особенностей используемых цепей передачи
электронов не происходит образования АТФ; биологическая роль этих процессов заключается в метаболизме
ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную
функцию модификации чужеродных соединений.
Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена, мобилизация
гликогена. Регуляция обмена гликогена гормонами и аллостерическая регуляция. Особенности распада
гликогена в печени и мышцах. Гликогенозы и агликогенозы
Гликоген – высокомолекулярный полимер, построенный из остатков глюкозы, связанных α-1,4- и α-1,6-
гликозидными связями. В большом количестве содержится в печени и мышцах. Гликоген упакован в гранулы,
размер которых 100 – 400 А. В гранулах находятся ферменты синтеза и распада гликогена. Распад гликогена
происходит в интервалах между приемами пищи; этот процесс ускоряется при физических нагрузках.
Гликогенолиз происходит за счет отщепления остатков глюкозы в виде глюкозо-1-фосфата. Фермент
гликогенфосфорилаза расщепляет α-1,4-гликозидные связи в гликогене в результате остаются 4 остатка глюкозы
до места ветвления (α-1,6-гликозидная связь). Олигосахаридтрансфераза переносит фрагмент гликогена
(состоящий из трех остатков глюкозы) на неразветвленный участок цепи, остается один остаток глюкозы,
связанный α-1,6-гликозидной связью. Фермент α-1,6-глюкозидаза отщепляют мономерный остаток глюкозы.
Суммарная реакция: Глюкозо-1-фосфат изомеризуется в глюкозо-6-фосфат под действием фосфоглюкомутазы.
Образующийся глюкозо-6-фосфат вступает в реакции гликолиза (или пентозного цикла) клеток мышц и мозга, а
в клетках печени, почек и кишечника происходит дефосфорилирование глюкозо-6-фосфата с образованием
глюкозы и фосфорной кислоты (под действием фермента глюкозо-6-фосфатазы). Далее глюкоза поступает в
кровь и разносится с кровью к тканям. Гормональная регуляция обмена гликогена осуществляется
адреналином, глюкагоном и инсулином. Адреналин и глюкагон активируют распад гликогена и тормозят его
синтез. Гормональная регуляция опосредуется общими механизмами через ц-АМФ, который активирует
цитозольные ферменты протеинкиназу, киназу фосфорилазы и киназу гликогенсинтазы. Киназы при участии
АТФ фосфорилируют ферменты гликогенфосфорилазу и гликогенсинтазу. Фосфорилаза активна в
фосфорилированном состоянии, поэтому под действием адреналина и глюкагона активируется распад
гликогена, а гликогенсинтаза, напротив, в фосфорилированном состоянии становится неактивной, поэтому
синтез гликогена под действием адреналина и глюкагона тормозится. Под действием инсулина активируются
ферменты фосфодиэстераза и фосфопротеинфосфатазы. Фосфодиэстераза разрушает ц-АМФ;
фосфопротеинфосфатазы катализируют дефосфорилирование ферментов гликогенфосфорилазы и
гликогенсинтазы. Фосфорилаза в дефосфорилированном состоянии становится неактивной и процесс распада
гликогена прекращается, а гликогенсинтаза, напротив, активируется, поэтому под действием инсулина
активируется синтез гликогена.
Заболевания, связанные с обменом гликогена: гликогенозы и агликогенозы.
1. Болезнь Гирке (недостаток глюкозо-6-фосфатазы печени). Клиническая картина: увеличение печени уже в
период новорожденности, гипогликемия между приемами пищи, гипогликемия, сохраняющаяся при действии
адреналина и глюкагона, нарушение жирового обмена (усиливается отложение жира в подкожной клетчатке и
внутренних органах).
2. Болезнь Форбса-Кори (дефицит фермента амило-1,6-глюкозидазы печени): неполное расщепление
гликогена, гепатомегалия, мышечная слабость, гипогликемия. Эта болезнь не угрожает жизни ребенка, хотя
может привести к задержке физического развития и полового созревания. У некоторых больных в
подростковом возрасте отмечается умеренная миопатия, т.к. понижена мышечная утилизация гликогена.
3. Болезнь Андерсена (недостаток активности «ветвящего» фермента в печени): гепатоспленомегалия,
цирроз печени, прогрессирующая печеночная недостаточность - длинные неразветвленные цепи плохо
разрушаются; развивается цирроз печени. Эта болезнь встречается крайне редко и всегда приводит к ранней
смерти.
4. Болезнь Херса (недостаток активности печеночной фосфорилазы): гепатомегалия, умеренная
гипергликемия, ацидоз. Данная патология встречается крайне редко и только у мальчиков.
5. Болезнь Мак-Ардля (недостаток мышечной фосфорилазы): спазмы мышц при нагрузке, преходящая
миоглобинурия. Агликогенозы – наследственное заболевание, вызванное дефектом гликогенсинтазы. В печени
почти или полностью отсутствует гликоген, выражена гипогликемия (0,39 – 0,67 ммоль/л). Характерный
симптом – у детей судороги обычно по утрам. Их можно предупредить частым кормлением ночью.
Гипогликемия новорожденных. Наблюдается у всех новорожденных из-за прекращения поступления крови
через плаценту (преходящая гипогликемия). Коррекция происходит быстро и самостоятельно. У
новорожденных, матери которых страдают сахарным диабетом, может быть тяжелая гипогликемия –
проявление функционального гиперинсулинизма, устраняемое только введением глюкозы.
|
Количественное определение остаточного азота крови. |
Определение остаточного азота ведут в безбелковом фильтрате крови. При нагревании с конц. серной кислотой безбелковый фильтрат минерализуется, затем определяются колориметрически с реактивом Несслера. Сульфат аммония образует с реактивом Несслера желто-оранжевое окрашивание. Расчет ведут по количеству стандартного раствора NH4Cl, пошедшего на титрование опытной пробы: (А · 0.05)·100% = мг% 0.066 мг% = 0.714 = ммоль/л, где А – количество стандартного раствора, пошедшего на титрование. |
20 – 40 мг% 15 – 25 ммоль/л |
Подъем уровня остаточного азота (азотемия) наблюдается при ряде патологических состояний. В клинической практике азотемию подразделяют на 2 типа: ретенционную и продукционную. Ретенционная в основном зависит от недостаточной функции почек и обусловлена недостатком мочевины. Продукционная азотемия связана с поступлением в кровоток избыточного количества азотсодержащих веществ, как правило, за счет повышенного распада тканевых белков при сохраненной выделительной функции почек. Повышенное содержание остаточного азота (свыше 80 – 90 мг%) – уремия. |

Витамины - низкомолекулярные органические соединения различной химической природы и различного
строения, синтезируемые главным образом растениями, частично - микроорганизмами.
Для человека витамины - незаменимые пищевые факторы. Витамины участвуют во множестве
биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества
разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя
сигнальные функции экзогенных прогормонов и гормонов. По химическому строению и физико-химическим
свойствам (в частности, по растворимости) витамины делят на 2 группы.
А. Водорастворимые:
Витамин В1 (тиамин);
Витамин В2 (рибофлавин);
Витамин РР (никотиновая кислота, никотинамид, витамин В3);
Пантотеновая кислота (витамин В5);
Витамин В6 (пиридоксин);
Биотин (витамин Н);
Фолиевая кислота (витамин Вс, В9);
Витамин В12 (кобаламин);
Витамин С (аскорбиновая кислота);
Витамин Р (биофлавоноиды).
Б. Жирорастворимые
Витамин А (ретинол);
Витамин D (холекальциферол);
Витамин Е (токоферол);
Витамин К (филлохинон).
1. Авитаминоз – комплекс симптомов, развивающихся в результате достаточно длительного или полного отсутствия одного из витаминов в рационе питания животных или человека.
2. Полиавитаминоз – совместная недостаточность нескольких витаминов.
3. Гиповитаминоз – комплекс симптомов, характеризующих частичную недостаточность витамина.
4. Гипервитаминоз – комплекс биохимических нарушений, возникающих вследствие длительного избыточного введения в организм жирорастворимых витаминов.
Причины гиповитаминозамогут носить экзогенный и эндогенный характер:
Экзогенные причины:
1. однообразие пищи, с недостаточным содержанием витаминов,
2. изменение нормальной микрофлоры кишечника (дисбактериоз),
3. длительное лечение антибиотиками, сульфаниламидами (ряд витаминов продуцируются кишечной микрофлорой: К, Н, В3, В6, В12, Вс).
Эндогенные причины:
1. нарушение всасывания и транспорта витаминов,
2. нарушение образования из витамина кофермента,
3. применение лекарственных средств (например, изониазид – лекарство для лечения туберкулеза – является антагонистом витамина В6).
Гиповитаминоз - болезненное состояние, возникающее при нарушении соответствия между
расходованием витаминов и поступлением их в организм; то же, что витаминная недостаточность.
Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно:
появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит,
нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность,
сказывается на состоянии отдельных органов и тканей (кожа, слизистые, мышцы, костная ткань) и важнейших
функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода,
защитные силы организма.Основные причины гиповитаминозов:
Недостаток витаминов в пище;
Нарушение всасывания в ЖКТ;
Врождѐнные дефекты ферментов, участвующих в превращениях витаминов;
Действие структурных аналогов витаминов (антивитамины).
Авитаминоз — заболевание, являющееся следствием длительного неполноценного питания, в котором
отсутствуют какие-либо витамины.
Признаки авитаминоза:
шелушение кожного покрова.
ломкость ногтей.
выпадение волос.
умственная отсталость.
Причины, вызывающие авитаминоз:
Нарушение поступления витаминов с пищей
при неправильном питании, недостаточном или
некачественном питании.
Нарушение процессов пищеварения или
нарушение работы органов, связанных
непосредственно с пищеварением.
Поступление в организм антивитаминов,
например лекарственных препаратов синкумар,
дикумарол, применяющихся при лечении
повышенной свертываемости крови.
Особенности детского обмена веществ
Особенности обмена веществ у пожилых людей.
Окисление жирных кислот и глицерина. Катаболизм липидов. В организме человека (70 кг) находится около 12-
15 кг жира. Этот запас ТАГ обеспечивает поддержание основного обмена в течении нескольких недель.
Жировая ткань очень метаболически активна и реагирует на изменения в обмене веществ. Особенно тесно
связана с печенью, сердечной и скелетными мышцами (50% энергии получают при окислении липидов), т.к. в
молекуле ТАГ основная доля – высшие жирные кислоты. Окисление происходит в матриксе митохондрий.
Сначала жирная кислота активируется: 1.В цитоплазме каждой кислота активируется с использованием КоА-SH
и энергии АТФ. 2.Активная жирная кислота- ацил-КоА – из цитозоля транспортируется в матрикс митохондрий
(МХ). КоА-SH остается в цитозоле, а остаток жирной кислоты - ацил- соединяется с карнитином - карнитин
выделен из мышечной ткани) с образованием ацил-карнитина, который поступает в межмембранное
пространство МХ. Их межмембранного пространства митохондрий комплекс ацил-карнитин переносится в
матрикс МХ. При этом карнитин остается в межмембранном пространстве. В матриксе ацил соединяется с КоА-
SH.
Окисление. В матриксе МХ образуется активная жирная кислота, которая в дальнейшем подвергается реакциям
окисления до конечных продуктов. При бета- окислении окисляется группа-СН2- в бета- положении жирной
кислоты до группы-С-. При этом на двух стадиях происходит дегидрирование: при участии ацилдегидрогеназы
(флавиновый фермент, водород переносится на убихинон) и бета-оксиацилдегидрогеназа (акцептор водорода
НАД+). Затем бета кетоацил-КоА при действии фермента тиолазы, распадается на ацетил КоА и ацил-КоА,
укороченный на 2 углеродных атома по сравнению с исходным. Этот ацил-КоА вновь подвергается бета-
окислению. Многократное повторение этого процесса приводит к полному распаду жирной кислоты до ацил-
КоА.
Окисление жирных кислот. Включает 2 этапа: 1.последовательное отщепление от С-конца эжкислоты
двухуглеродного фрагмента в виде ацетил-КоА; 2.окисление ацетил-КоА в цикле Кребса до СО2 и Н2О.
Энергетическая ценность окисления жирных кислот. Стеариновая кислота(С18) проходит 8 циклов окисления с
образованием 9 ацетил-КоА.В каждом цикле окисления образуется 8*5 АТФ=40 АТФ, ацетил-КоА дает 9*12
АТФ=108 АТФ. Итого:148 АТФ, но 1 АТФ расходуется на активацию жирной кислоты в цитозоле, поэтому итог 147
АТФ. Особенности окисления ненасыщенных жирных кислот. Окисление ненасыщенных жирных кислот
происходит также по двойной связи. В случае, когда двойная связь имеет цис-конфигурацию, действует
специальный фермент цис-транс-изомераза, который переводит двойную связь в транс-форму. Транс-еноил-
КоА подвергается окислению как описано выше. Особенности окисления жирных кислот с нечетным
количеством углеродных атомов. В этом случае образуется 3-х углеродный продукт пропионил-КоА. Таким
образом, окисление высших жирных кислот - очень важный источник большого количества энергии для клетки,
но жирные кислоты становятся альтернативным энергетическим
топливом, а на первом месте – глюкоза,т.к. их окисление зависит от окисления глюкозы (1. для
активации жирной кислоты требуется АТФ, которая образуется в цитозоле в ходе гликолиза; 2.
для реакции ЦТК требуется ЩУК, которая образуется из глюкозы). Глицерин – продукт метаболизма жировой
ткани, глицерин не используется адипоцитами. Глицерин утилизируют ткани, содержащие фермент
глицеролкиназу (печень, почки, слизистая кишечника, молочная железа). Глицерол-3-фосфат в клетках этих
органов может использоваться по трем направлениям: 1. окисление до конечных продуктов; 2. глюконеогенез;
3. синтез жиров и фосфолипидов.
Билирубин
Билирубин в норме в моче практически отсутствует. Образуется при разрушении гемоглобина в клетках ретикулоэндотелиальной системы, около 250-350 мг/сут. При повышении в крови концентрации конъюгированного билирубина он начинает выделяться почками и обнаруживается в моче. Билирубинурия (bilirubinuria) выявляется при паренхиматозных поражениях печени (вирусные гепатиты), механической (подпеченочной) желтухе, циррозах, холестазе. При гемолитической желтухе моча обычно билирубин не содержит. Необходимо отметить, что с мочой выделяется только прямой (связанный) билирубин.
Когда билирубин появляется в моче?
- Повышенный распад гемоглобина (гемолитическая анемия, полицитемия, рассасывание массивных гематом).
- Механическая желтуха, инфекции билиарной системы, нарушение функции печени (вирусный гепатит, хронический гепатит, цирроз печени).
- В результате действия токсических веществ (алкоголя, органических соединений, инфекционных токсинов).
- Вторичная печеночная недостаточность (сердечная недостаточность, опухоли печени).
- Увеличение образования стеркобилиногена в желудочно-кишечном тракте (илеит, колит, обструкция кишечника).
Уробилиноген
Уробилиногеновые тела (I-уробилиноген, d-уробилиноген, третий уробилиноген, стеркобилиноген) являются производными билирубина и являются нормальными продуктами катаболизма, которые в физиологических условиях образуются с определенной скоростью, постоянно экскретируются с калом и в небольших количествах с мочой. Нормальная моча содержит следы уробилиногена. Уровень его резко возрастает при гемолитической желтухе (внутрисосудистом разрушении эритроцитов), а также при токсических и воспалительных поражениях печени, кишечных заболеваниях (энтериты, запоры). При подпеченочной (механической) желтухе, когда наблюдается полная закупорка желчного протока, уробилиноген в моче отсутствует.
Когда уровень уробилиногена повышен (уробилиногенурия)?
- При гемолитических состояниях:
- гемолитическая анемия;
- пернициозная анемия;
- пароксизмальная ночная гемоглобинурия;
- эритремия;
- внутрисосудистый гемолиз (при гемотрансфузионных реакциях, инфекциях, укусах ядовитых змей),
- рассасывание массивных гематом.
- При поражении паренхимы печени:
- вирусный гепатит;
- хронический гепатит;
- токсическое поражение печени;
- рак печени и метастазы опухолей в печень.
- При заболеваниях кишечника вследствии усиленной реабсорбции стеркобилиногена в дистальном отделе слизистой толстой кишки и дальнейшего повышения его концентрации в моче:
- энтероколиты;
- продолжительные запоры;
- кишечная непроходимость;
- инвагинация;
- усиленные гнилостные процессы в толстой кишке.

Различия ферментов состава органов и тканей. Органоспецифические ферменты, изоферменты (на примере
ЛДГ, МДГ и др.). Изменения активности ферментов при патологии. Энзимопатии, энзимодиагностика и
энзимотерапия.
Изоферменты — это различные по аминокислотной последовательности изоформы одного и того
же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности. Все
изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут
значительно различаться по степени каталитической активности, по особенностям регуляции или другим
свойствам. Примером фермента, имеющего изоферменты, является амилаза — панкреатическая амилаза
отличается по аминокислотной последовательности и свойствам от амилазы слюнных желѐз, кишечника и
других органов. Это послужило основой для разработки и применения более надѐжного метода диагностики
острого панкреатита путѐм определения не общей амилазы плазмы крови, а именно панкреатической
изоамилазы.Энзимопатии – заболевания, вызванные нарушением синтеза ферментов:
а) в полном или частичном отсутствии ферментативной активности;
б) в чрезмерном усилении ферментативной активности;
в) в продукции патологических ферментов, которые не встречаются у здорового человека.
Различают наследственные и приобретенные энзимопатии. Наследственные энзимопатии связаны с
нарушением в генетическом аппарате клетки, приводящим к отсутствию синтеза определенных ферментов. К
наследственным заболеваниям относятся энзимопатии, связанные с нарушением превращения аминокислот:
1. Фенилкетонурия – наследственное нарушение синтеза фермента фенилаланингидроксилазы, при участии
которого происходит превращение фенилаланина в тирозин. При этой патологии происходит увеличение
концентрации в крови фенилаланина. При этом заболевании у детей необходимо исключить из рациона
фенилаланин.
2. Альбинизм – заболевание, связанное с генетическим дефектом фермента тирозиназы. При потере
меланоцитами способности синтезировать этот фермент (окисляет тирозин в ДОФА и ДОФА-хинон) в коже,
волосах и сетчатке глаза не образуется меланин.
Приобретенные энзимопатии, т.е. нарушение синтеза ферментов, могут возникать в результате:
1. длительного применения лекарств (антибиотиков, сульфаниламидов);
2. перенесенных инфекционных заболеваний;
3. вследствие авитаминозов;
4. злокачественных опухолей.
Энзимодиагностика определение активности ферментов для диагностики заболеваний. Ферменты плазмы крови
делят на 3 группы: секреторные, индикаторные и экскреторные. Индикаторные – клеточные ферменты. При
заболеваниях, сопровождающихся повреждением клеточных мембран, эти ферменты в большом количестве
появляются в крови, свидетельствуя о патологии в определенных тканях. Например, активность амилазы в крови
и моче увеличивается при острых панкреатитах. Для энзимодиагностики проводят определение изоферментов.
При патологических состояниях выход фермента в кровь может усилиться в связи с изменением состояния
мембраны клетки. Исследование активности ферментов крови и других биологических жидкостях широко
применяется с целью диагностики заболеваний. Например, диастаза мочи и амилаза крови при панкреатитах
(повышение активности), понижение активности амилазы – при хроническом панкреатите.
Энзимотерапия – применение ферментов в качестве лекарственных препаратов. Например, смесь
ферментативных препаратов пепсина, трипсина, амилазы (панкреатин, фестал) используют при заболеваниях
ЖКТ с пониженной секрецией, трипсин и химотрипсин – используются в хирургическойпрактике при гнойных
заболеваниях для гидролиза бактериальных белков.
Химизм окисления жирных кислот, его связь с митохондриальным окислением. Энергетика окисления
жирных кислот. Значение этого процесса для организма. Нарушение окисления жирных кислот при
авитаминозах.
Окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой
ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником
энергии в мозговой ткани служит глюкоза. Жирные кислоты, входящие в состав естественных жиров животных
и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре
углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного β-окисления
масляная кислота становится ацетоуксусной. Последняя затем гидролизуется до двух молекул уксусной
кислоты. Доставка жирных кислот к месту их окисления – к митохондриям – происходит сложным путем: при
участии альбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков –
транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в
митохондрии. Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи
является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе
окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности
мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется
ферментом ацил-КоА- синтетазой:
R—COOH + HS-KoA + АТФ + R—CO—S-KoA + АМФ + РРi.
Жирная кислота Ацил-КоА-синтетаза
Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и
свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и
протекает их окисление. Переносчиком активированных жирных кислотс длинной цепью через внутреннюю
митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на
гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю
митохондриальную мембрану:
Нарушение переноса・ жирных кислот в митохондрии. Скорость переноса жирных кислот внутрь
митохондрий, а следовательно и скорбеть процесса р-окисления, зависит от доступности карнитина и скорости
работы фермента карнитинацилтрансферазы I. р-Окисление могут нарушать следующие факторы:
длительный гемодиализ, в ходе которого организм теряет карнитин;
длительная ацидурия, при которой карнитин выводится как основание с органическими кислотами;
лечение больных сахарным диабетом препаратами сульфонилмочевины, ингибирующими
карнитинацилтрансферазу I;
низкая активность ферментов, синтезирующих карнитин;
Невозможность использовать жирные кислоты как источники энергии приводит к увеличению скорости
окисления глюкозы. В результате у детей развивается гипогликемия - причина внезапной детской смертности
(10% от общего числа умерших новорождѐнных). Если такие дети выживают, то после голодания в течение 6-8 ч
у них развиваются гипогликемические приступы (слабость, головокружение, рвота, потеря сознания). Введение
глюкозы приводит к исчезновению симптомов. Во всех случаях, когда нарушается β-окисление, жирные
кислоты накапливаются в клетках и распадаются по пути ω-окисления, которое в норме идѐт с очень низкой
скоростью. Окисление происходит по метильному ω-атому углерода, и в результате образуются дикарбоновые
кислоты, выделяющиеся с мочой. Определение этих кислот в моче может служить диагностическим признаком
нарушения β-окисления.
|
Количественное определение пировиноградной кислоты в сыворотке крови. |
Пировиноградная кислота в щелочной среде дает с салициловым альдегидом оранжевое окрашивание, пропорциональное содержанию пирувата. Оптическая плотность раствора определяется на ФЭКе. |
0.3 – 0.9 мг% 34 – 102 ммоль/л |
Пировиноградная кислота является продуктом метаболизма углеводов, аминокислот, глицерина в клетке. Увеличение количества пирувата в крови наблюдается при тканевой гипоксии и связано с торможением ее окислительного декарбоксилирования и дальнейшего окисления в ЦТК. Увеличение: при гиповитаминозах В1, В2, В3, В5, ИБС. |

Паратгормон и кальцитонин. Химическая природа. Механизм действия на молекулярном уровне. Влияние на
обмен кальция, гиперкальциемия и гипокальциемия.
К гормонам белковой природы относится также паратиреоидный гормон (паратгормон). Они
синтезируются паращитовидными железами. Молекула паратгормона быка содержит 84аминокислотных
остатка и состоит из одной полипептидной цепи. Выяснено, что паратгормон участвует в регуляции
концентрации катионов кальция и связанных с ними анионов фосфорной кислоты в крови. Биологически
активной формой считается ионизированный кальций, концентрация его колеблется в пределах 1,1–1,3 ммоль/л.
Ионы кальция оказались эссенциальными факторами, не заменимыми другими катионами для ряда жизненно
важных физиологических процессов: мышечное сокращение, нервно-мышечное возбуждение, свертывание
крови, проницаемость клеточных мембран, активность ряда ферментов и т.д. Поэтому любые изменения этих
процессов, обусловленные длительным недостатком кальция в пище или нарушением его всасывания в
кишечнике, приводят к усилению синтеза паратгормона, который способствует вымыванию солей кальция (в
виде цитратов и фосфатов) из костной ткани и соответственно к деструкции минеральных и органических
компонентов костей. Другой орган-мишень паратгормона – это почка. Паратгормон уменьшает реабсорбцию
фосфата в дистальных канальцах почки и повышает канальцевую реабсорбцию кальция.В особых клетках – так
называемых парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной
природы, обеспечивающий постоянную концентрацию кальция в крови - кальцитонин.
Кальцитонин содержит дисульфидный мостик (между 1-м и 7-м аминокислотными остатками) и характеризуется
N-концевым цистеином и С-концевым пролинамидом. Биологическое действие кальцитонина прямо
противоположно эффекту паратгормона: он вызывает подавление в костной ткани резорбтивных процессов и
соответственно гипокальциемию и гипофосфатемию. Таким образом, постоянство уровня кальция в крови
человека и животных обеспечивается главным образом паратгормоном, кальцитриолом и кальцитонином, т.е.
гормонами как щитовидной и паращитовидных желез, так и гормоном – производным витамина D3. Это следует
учитывать при хирургических лечебных манипуляциях на данных железах.
Анаэробный распад глюкозы. Этапы этого процесса. Гликолитическая оксиредукция, субстратное
фосфорилирование. Энергетическая ценность анаэробного распада глюкозы. Регуляторные механизмы,
участвующие в этом процессе.
Гликолиз – синоним молочнокислого
брожения – сложный ферментативный
процесс превращения глюкозы до двух
молекул молочной кислоты, протекающий
в тканях человека и животных без
потребления кислорода. Гликолиз
включает 11 ферментативных реакций,
протекающих в цитоплазме клетки.
Реакции гликолиза проходят в 2 стадии. В
ходе первой стадии –
энергопотребляющей – используются 2
АТФ в 1-ой и 3-ей реакциях. В процессе 7-
ой и 10-ой реакций второй стадии –
энергодающей – образуются 4 АТФ. Из 11
реакций - 3 необратимые (1-ая, 3-я и 10-
ая).
|
Определение холестеринового индекса атерогенности. |
К=Х – Х ЛВП ХЛВП |
Здоровые 20 – 30 лет 2 – 2.5 Старше 30 лет 3 – 3.5 Больные атеросклерозом 4 - 7 |
Индекс атерогенности является прогностическим показателем развития атеросклероза. |

Витамин РР, структура коферментов, участие в обменных процессах. Гипо - и авитаминоз РР. Пищевые
источники, суточная потребность.
Витамин РР (никотиновая кислота, никотинамид, витамин B3)
Источники. Витамин РР широко распространён в растительных продуктах, высоко его
содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и
почках крупного рогатого скота и свиней. Суточная потребность в этом витамине
доставляет для взрослых 15-25 мг, для детей - 15 мг. Биологические
функции. Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов
различных дегидрогеназ. Недостаточность витамина РР приводит к заболеванию "пеллагра", для которого
характерны 3 основных признака: дерматит, диарея, деменция ("три Д"), Пеллагра проявляется в виде
симметричного дерматита на участках кожи, доступных действию солнечных лучей, расстройств ЖКТ (диарея) и
воспалительных поражений слизистых оболочек рта и языка. В далеко зашедших случаях пеллагры наблюдают
расстройства ЦНС (деменция): потеря памяти, галлюцинации и бред.
Биосинтез жиров в организме: ресинтез жира в эндотелии кишечника, синтез жиров в печени и подкожно-
жировой клетчатке. Транспорт жиров липопротеинами крови. Резервирование жиров. Физиологическое
значение жиров для организма человека. Нарушение процесса синтеза жиров: ожирение, жировое
перерождение печени.
Жировой обмен — совокупность процессов переваривания и всасывания нейтральных жиров
(триглицеридов) и продуктов их распада в желудочно-кишечном тракте, промежуточного обмена жиров и
жирных кислот и выведение жиров, а также продуктов их обмена из организма. Понятия «жировой обмен» и
«липидный обмен» часто используются как синонимы, т.к. входящие в состав тканей животных и растений
входят нейтральные жиры и жироподобные соединения, объединяются под общим
названием липиды. Нарушения Ж. о. служат причиной или являются следствием многих патологических
состояний. В организм взрослого человека с пищей ежесуточно поступает в среднем 70 г жиров животного и
растительного происхождения. В ротовой полости жиры не подвергаются никаким изменениям, т.к. слюна не
содержит расщепляющих жиры ферментов. Частичное расщепление жиров на глицерин или моно-,
диглицериды и жирные кислоты начинается в желудке. Однако оно протекает с небольшой скоростью,
поскольку в желудочном соке взрослого человека и млекопитающих активность фермента липазы,
катализирующего гидролитическое расщепление жиров, крайне невысока, а величина рН желудочного сока
далека от оптимальной для действия этого фермента (оптимальное значение рН для желудочной липазы
находится в пределах 5,5—7,5 единиц рН). Кроме того, в желудке отсутствуют условия для эмульгирования
жиров, а липаза может активно гидролизовать только жир, находящийся в форме жировой эмульсии. Поэтому у
взрослых людей жиры, составляющие основную массу пищевого жира, в желудке особых изменений не
претерпевают. Однако в целом желудочное пищеварение значительно облегчает последующее переваривание
жира в кишечнике. В желудке происходит частичное разрушение липопротеиновых комплексов мембран клеток
пищи, что делает жиры более доступными для последующего воздействия на них липазы панкреатического
сока. Кроме того, даже незначительное по объему расщепление жиров в желудке приводит к появлению
свободных жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и там
способствуют эмульгированию жира. Наиболее сильным эмульгирующим действием обладают желчные
кислоты, попадающие в двенадцатиперстную кишку с желчью. В двенадцатиперстную кишку вместе с пищевой
массой заносится некоторое количество желудочного сока, содержащего соляную кислоту, которая в
двенадцатиперстной кишке нейтрализуется в основном бикарбонатами, содержащимися в панкреатическом и
кишечном соке и желчи. Образующиеся при реакции бикарбонатов с соляной кислотой пузырьки углекислого
газа разрыхляют пищевую кашицу и способствуют более полному перемешиванию ее с пищеварительными
соками. Одновременно начинается эмульгирование жира. Соли желчных кислот адсорбируются в присутствии
небольших количеств свободных жирных кислот и моноглицеридов на поверхности капелек жира в виде
тончайшей пленки, препятствующей слиянию этих капелек.
Нарушения жирового обмена. Одной из причин недостаточного всасывания жиров в тонкой кишке
может быть их неполное расщепление вследствие либо пониженной секреции сока поджелудочной железы
(недостаток панкреатической липазы), либо вследствие пониженного выделения желчи (недостаток желчных
кислот, необходимых для эмульгирования жира и образования жировых мицелл). Другой, наиболее частой
причиной недостаточного всасывания жира в кишечнике является нарушение функции кишечного эпителия,
наблюдаемое при энтеритах, гиповитаминозах, гипокортицизме и некоторых других патологических состояниях.
В этом случае моноглицериды и жирные кислоты не могут нормально всасываться в кишечнике из-за
повреждения его эпителия. Нарушение всасывания жиров наблюдается также при панкреатитах, механической
желтухе, после субтотальной резекции тонкой кишки, а также ваготомии, приводящей к понижению тонуса
желчного пузыря и замедленному поступлению желчи в кишечник. Нарушение всасывания жира в тонкой кишке
приводит к появлению большого количества жира и жирных кислот в кале — стеаторее. При длительном
нарушении всасывания жира организм получает также недостаточное количество жирорастворимых витаминов.
|
Патологические белки плазмы крови. |
γ-глобулины, β-глобулины и некоторые липопротеины сыворотки крови выпадают в осадок в присутствии буферного раствора с рН=7.5 насыщенного тимолом. Степень развивающегося помутнения находят по калибровочному графику после измерения на ФЭКе. |
0-0.4 ед. мутности |
При некоторых злокачественных заболеваниях и иммунодефицитных состояниях в крови появляются необычные патологические белки. Такое явление называется парапротеинемией. |

Витамин В2, структура коферментов, участие в обменных процессах. Гиповитаминоз и авитаминоз В2.
Суточная потребность, пищевые источники.
Витамин В2 (рибофлавин). В основе структуры витамина В2 лежит структура изоаллоксазина,
соединённого со спиртом рибитолом. Главные источники витамина В2 - печень, почки, яйца,
молоко, дрожжи. Витамин содержится также в шпинате, пшенице, ржи. Частично человек
получает витамин В2 как продукт жизнедеятельности кишечной микрофлоры. Суточная
потребность в витамине В2 взрослого человека составляет 1,8-2,6 мг. Биологические
функции. В слизистой оболочке кишечника после всасывания витамина происходит
образование коферментов FMN и FAD. Клинические проявления недостаточности рибофлавина выражаются в
остановке роста у молодых организмов. Часто развиваются воспалительные процессы на слизистой оболочке
ротовой полости, появляются длительно незаживающие трещины в углах рта, дерматит носогубной складки.
Типично воспаление глаз: конъюнктивиты, васкуляризация роговицы, катаракта. Кроме того, при авитаминозе
В2 развиваются общая мышечная слабость и слабость сердечной мышцы.
Обмен глицерофосфолипидов. Переваривание фосфолипидов в желудочно-кишечном тракте.
Внутриклеточный гидролиз фосфолипидов. Ферменты этих процессов. Биосинтез глицерофосфолипидов. Этапы
этого процесса. Транспорт фосфолипидов липопротеинами крови. Регуляция обмена фосфолипидов:
липотропные факторы. Значение фосфолипидов для организма человека.
Обмен глицерофосфолипидов. Начальные этапы синтеза глицерофосфолипидов и жиров происходят
одинаково до образования фосфатидной кислоты. Фосфатидная кислота может синтезироваться двумя разными
путями: через глицеральдегид-3-фосфат и через дигидроксиацетонфосфат. На следующем этапе фосфатидаза
отщепляет от фосфатидной кислоты фосфатный остаток, в результате чего образуется диацилглицерол.
Дальнейшие превращения диацилглицерола также могут идти разными путями. Один из вариантов -
образование активной формы "полярной головки" фосфолипида: холин, серии или этаноламин превращаются в
ЦДФ-холин, ЦДФ-серин или ЦДФ-этаноламин. Далее диацилглицерол взаимодействует с ЦМФ-производными,
при этом выделяется ЦМФ, и образуется соответствующий фосфолигщц, например фосфатидилхолин. Между
глицерофосфолипидами возможны различные взаимопревращения. Фосфатидилхолин может образовываться и
другим путём: из фосфатидилэтаноламина, получая последовательно 3 метальные группы от SAM.
Фосфатидилсерин может превращаться в фосфа-тидилэтаноламин путём декарбоксилирования.
Фосфатидилэтаноламин может превращаться в фосфатидилсерин путём обмена этаноламина на
серии.Катаболизм глицерофосфолипидов. Различные типы фосфолипаз, локализованных в клеточных
мембранах или в лизосомах, катализируют гидролиз глицерофосфолипидов. Гидролиз некоторых
глицерофосфолипидов под действием фосфолипаз имеет значение не только как путь катаболизма, но и как
путь образования вторичных посредников или предшественников в синтезе биологически активных веществ -
эйкозаноидов. Кроме того, фосфолипазы А1 и А2 участвуют в изменении состава жирных кислот в
глицерофосфолипидах, например при синтезе в эмбриональном периоде развития
дипальмитоилфосфатидилхолина - компонента сурфактанта.
|
Мочевина крови |
Мочевина образует с диацилмонооксимом в присутствии тиосемикарбазида и ионов железа в сильно кислой среде комплекс, окрашенный в красный цвет. Интенсивность окраски пропорциональна концентрации мочевины в сыворотке крови. Развивающуюся окраску сравнивают со шкалой стандартных растворов мочевины |
2,5-8,3 ммоль/л 15-50 мг% |
Сдвиги концентрации мочевины крови зависят от соотношения процессов ее синтеза в гепатоцитах и экскреции почками. Повышение мочевины в крови в норме может наблюдаться при потреблении большого количества белка пищи. В условиях патологии ее концентрация, в основном, нарастает при почечной недостаточности, а также при усиленном распаде белков организма (диабет). Снижение уровня мочевины в крови имеет место при ослаблении ее синтеза клетками печени (печеночная недостаточность, цирроз печени и др.), а также при диете с недостаточным содержанием белка, белковом истощении. |

Витамин С, структура, участие в обменных процессах. Гипо- и авитаминоз С. Пищевые источники, суточная
потребность.
Витамин С (аскорбиновая кислота). Источники витамина С - свежие фрукты, овощи, зелень.
Суточная потребность человека в витамине С составляет 50-75 мг. Биологические функции. Образование
коллагена, серотонина из триптофана, образование катехоламинов, синтез кортикостероидов.
Аскорбиновая кислота также участвует в превращении холестерина в желчные кислоты. Витамин
С необходим для детоксикации в гепатоцитах при участии цитохрома P450. Витамин С сам
нейтрализует супероксид-анион радикал до перекиси водорода. Клинические проявления
недостаточности витамина С. Недостаточность аскорбиновой кислоты приводит к заболеванию,
называемому цингой (скорбут). Цинга, возникающая у человека при недостаточном содержании в
пищевом рационе свежих фруктов и овощей, описана более 300 лет назад, со времени проведения длительных
морских плаваний и северных экспедиций. Это заболевание связано с недостатком в пище витамина С. Болеют
цингой только человек, приматы и морские свинки. Главные проявления авитаминоза обусловлены в основном
нарушением образования коллагена в соединительной ткани. Вследствие этого наблюдают разрыхление дёсен,
расшатывание зубов, нарушение целостности капилляров (сопровождающееся подкожными кровоизлияниями).
Возникают отёки, боль в суставах, анемия.
Обмен ацетоуксусной кислоты в организме. Синтез ацетоуксусной кислоты и использование ее в тканях.
Образование кетоновых тел. Нарушение этого процесса при патологии: сахарном диабете, кахексии, острой
гипоксии. Биохимические механизмы развития диабетической комы.
В печени часть жирных кислот превращается в так называемые кетоновые тела – ацетоуксусную и β-
гидроксимасляную кислоты. Эти вещества затем поступают в кровь и используются как источники энергии в
других органах и тканях. Непосредственным предшественником кетоновых тел служит ацетил-КоА, который
может образоваться как из жирных кислот так из углеводов. Однако для синтеза кетоновых тел используется
преимущественно ацетил-КоА, образующийся из жирных кислот. Это происходит в результате действия
специальных регуляторных механизмов. Содержание кетоновых тел в крови увеличивается в таких состояниях
когда основным источником энергии для организма служат жирные кислоты –при длительной мышечной
работе, при голодании, при некоторых болезнях. Через двое суток голодания концентрация кетоновых тел в
крови достигает 5-8мг/дл через неделю 40-50мг/дл. При сахарном диабете концентрация кетоновых тел может
повышаться до 300-400мг/дл, что приводит к метаболическому ацидозу. Кетонемия и кетонурия. Вследствие
недостаточности инсулина уменьшается отношение инсулина/глюкагон, т.е. имеется относительное
избыточность глюкагона. Однако скорость синтеза кетоновых тел может превышать даже увеличенное в этих
условиях их потребление тканями (концентрация кетоновых тел в крови в норме меньше 2мг/дл, при
голодании до 30 мг/дл). При диабете кетонемия часто бывает 100 мг/дл, а может достигать и 350 мг/дл. При
такой кетонемии возникает и кетонурия - с мочой выделяется до 5г кетовых тел в сутки. В тканях происходит
декарбоксилирование ацетоуксусной кислоты: от больных исходит запах ацетона, который ощущается даже на
расстоянии). Кетовые теля, являясь кислотами, снижают буферную емкость крови, а при высоких концентрациях
снижают и рН крови - возникает ацидоз. В норме рН крови равна 7,4+0,04. При содержании кетовых тел
100мг/дл и больше рН крови может быть близко к 7,0. Ацидоз такой степени резко нарушает функции мозга,
вплоть до потери сознания.
|
Количественное определение активности амилазы (диастазы) мочи по Вольгемуту. |
Моча разводится в геометрической прогрессии. Каждое разведение инкубируют с крахмалом в течение 30 минут. Негидролизованный крахмал определяют по реакции с иодом. Активность амилазы расчитывается по наибольшему разведению, способному гидролизовать крахмал. |
16-34 мг крахмала, гидролизованного за 30 мин 1 мл мочи |
Увеличивается при острых панкреатитах (10-30 раз), обострениях хронических панкреатитах, опухолях и травмах поджелудочной железы. Гиперамилаземия наблюдается при паротитах, опухолях и травмах слюнных желез, слюнокаменной болезни. Снижение активности амилазы наблюдается при сахарном диабете. |

Витамин В1, структура кофермента, участие в обменных процессах. Гиповитаминоз и авитаминоз В1.
Пищевые источники, суточная потребность.
Витамин B1 (тиамин). Структура витамина включает пиримидиновое и тиазоловое
кольца, соединённые метановым мостиком. Источники. Он широко распространён в
продуктах растительного происхождения (оболочка семян хлебных злаков и риса, горох,
фасоль, соя и др.). Суточная потребность взрослого человека в среднем составляет 2-3
мг витамина В1. Биологическая роль витамина В, определяется тем, что в виде ТДФ он входит в
состав как минимум трёх ферментов и ферментных комплексов: в составе пируват - и
оскетоглутаратдегидрогеназных комплексов он участвует в окислительном декарбоксилировании пирувата и
оскетоглутарата; в составе транскетолазы ТДФ участвует в пентозофосфатном пути превращения углеводов.
Основной, наиболее характерный и специфический признак недостаточности витамина В1- полиневрит, в
основе которого лежат дегенеративные изменения нервов. Вначале развивается болезненность вдоль нервных
стволов, затем - потеря кожной чувствительности и наступает паралич (бери-бери). Второй важнейший признак
заболевания - нарушение сердечной деятельности, что выражается в нарушении сердечного ритма, увеличении
размеров сердца и в появлении болей в области сердца. К характерным признакам заболевания, связанного с
недостаточностью витамина В1относят также нарушения секреторной и моторной функций ЖКТ; наблюдают
снижение кислотности желудочного сока, потерю аппетита, атонию кишечника.
Холестерин, его химическое строение, роль в организме, экзогенный и эндогенный холестерин. Биосинтез
холестерина, основные этапы этого процесса. Метаболизм холестерина, его транспорт, пути выведения.
Понятие о гиперхолестеринемии. Биохимические основы формирования камней желчного пузыря.
Синтез холестерина. Многоэтапный процесс
синтеза холестерина (ХЛ) подразделяется на 3 стадии: 1.
Образование мевалоновой кислоты из ацетил-КоА, 2.
Образование «активного изопрена» и реакции
конденсации с образованием сквалена, 3. Реакции
циклизации сквалена с образованием стеранового
скелета. Начальные реакции синтеза ХЛ сходны с
начальными реакциями синтеза кетоновых тел (до
образования ОМГ-КоА). Отличием является локализации
процессов: синтез кетоновых тел происходит в МХ, а синтез ХЛ-ЦЗ. 1) 2 ацетил-КоА → ацетил-КоА → ОМГ-
КоАтиолаза ОМГ-синтаза2) ОМГ-редуктаза – регуляторный фермент, лимитирующий скорость
биосинтеза ХЛ в целом. Её активность подавляется избытком пищевого холестерина.
І стадия. Активация мевалоновой кислоты.
ІІ стадия. Мевалонат---сквален. Через образование различных эфиров с Р-кислотой(5-фосфорный
эфир,5-пирофосфорный эфир). Декарбоксилирование и дефосфорилирование активной мевалоновой кислоты
(фермент декарбоксилаза и фосфорилаза). Активный изопрен (изопентинилпирофосфат и
димитилаллилпирофосфат ) является предшественником не только ХЛ. В клетках растений и бактерий из него
образуются каротиноиды, убихинон, хлорофилл, каучук. Оба изомерных изопентилпирофосфата
конденсируются с высвобождением пирофосфата и образованием геранилпирофосфата С10. К
геранилпирофосфату вновь присоединяется изопентил пирофосфат, образуя в результате этой реакции
фарнезилпирофосфат С15 В заключительной реакции данной стадии в результате НАДФН2- зависимой
восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален С30
ІІІ стадия. Реакции конденсации изопрена: Сквален (С30) → ланостерин → холестерин. Реакции
конденсации и циклизации углеродного скелета требуют большого количества энергии в форме АТФ.
Гидроксилирование стеранового кольца предшественника ХЛ протекает с участием монооксигеназной цепи
мембран ЭПС. Эфиры ХЛ образуются путем переноса активной жирной кислоты на гидроксильную группу ХЛ.
Перенос осуществляют ферменты либо холестерол-ацил- трансфераза(ХАТ) либо лецитин-ХАТ (ЛХАТ). а сутки у
здорового человека синтезируется около 2 г ХЛ (с пищей поступает 0,4-0,5 г экзогенного ХЛ). Транспорт ХЛ от
печени и кишечника к органам. ХЛ синтезируется в печени как для собственных нужд, так и на «экспорт». Вновь
образованный ХЛ и его эфиры включаются вместе с ТАГ в ЛПОНП и поступают в плазму крови. После
освобождения ЛПОНП от ТАГ, происходящего на поверхности адипоцитов, из них образуется ЛПНП с высоким
содержанием в них ХЛ. На поверхности клеток внутренних органов ЛПНП соединяются с специфическими
рецепторами и поглощаются этими клетками. В лизосомах клеток происходит гидролитический распад ЛП.
Освободившиеся ХЛ встраивается в клеточные мембраны. Изменение соотношения в плазме фракций ЛП- одна
из причин нарушения обмена ХЛ. Пищевой (экзогенный) ХЛ транспортируется ХМ от кишечного эпителия к
печени. Избыток ХЛ с желчью выводится в кишечник, где восстанавливается ферментами микрофлоры до
копростерина и вместе с небольшим количеством не измененного ХЛ выделяется с калом. Выведению избытка
ХЛ из кишечника в значительной мере способствует клетчатка, содержащаяся в пище.
Желчнокаменная болезнь. У здорового человека ХЛ в желчи находится в определенном соотношении
с ФЛ и желчными кислотами, образую с ними растворимые мицеллы. При увеличении концентрации ХЛ в
составе мицелл или снижении содержания желчных кислот и ФЛ, ХЛ выпадает в осадок кристаллизируется и
формирует холестериновые камни. Этому способствует застой желчи.
Сахарная кривая.
Данный анализ проводится для исследования нарушений толерантности к глюкозе, обнаружение их в организме может говорить о ранних признаках развивающегося сахарного диабета. Благодаря данному исследованию выявляется концентрация сахара крови (на голодный желудок): за 5 минут необходимо выпить 1 стакан теплой воды с растворенной в нем глюкозой (75 грамм), затем через полчаса,1 час и через 2 часа следует проверить уровень сахара в крови.
Исследование необходимо осуществлять утром на голодный желудок (промежуток между последним приемом пищи и взятием крови должен составлять не менее 12 часов), за 1-2 дня до сдачи анализа следует исключить или значительно уменьшить потребление жирной пищи. За три дня до начала проведения теста в обязательном порядке следует соблюдать низкоуглеводную диету. В течение 24 часов до совершения анализа противопоказаны какие-либо физические нагрузки, прием лекарственных препаратов (необходимо проконсультироваться с лечащим врачом), а также алкогольной продукции. За 1-2 часа до сдачи крови следует отказаться от курения, употребления сока, чая, кофе (с сахаром тем более), в это время разрешается пить только чистую негазированную воду. За 15 минут до сдачи крови постарайтесь отдохнуть, расслабиться.
Сахарная кривая (глюкозотолерантный тест) норма
Норма сахарной кривой такова: натощак – показатель глюкозы в плазме менее 6,1 ммоль/ л, спустя два часа после приема внутрь глюкозы уровень должен составлять менее, чем 7,8 ммоль/ л.
Расшифровка анализа
В случае, если уровень сахара составляет 7,8-11 ммоль/л, это может свидетельствовать о нарушенной толерантности к глюкозе – состоянии, которое со временем может перерасти в диабет.
Уровень глюкозы по истечении двух часов более 11 ммоль/л свидетельствует о сахарном диабете.

Витамин В6, структура кофермента, участие в обменных процессах. Гиповитаминоз и авитаминоз В6.
Пищевые источники, суточная потребность.
ВитаминВ6 (пиридоксин, пиридоксаль, пиридоксамин) В
основе структуры витамина В6 лежит пиридиновое кольцо.
Известны 3 формы витамина В6, отличающиеся строением
замещающей группы у атома углерода в п-положении к атому азота. Все они характеризуются одинаковой
биологической активностью.Источники витамина В6 для человека - такие продукты питания, как яйца, печень,
молоко, зеленый перец, морковь, пшеница, дрожжи. Некоторое количество витамина синтезируется кишечной
флорой. Суточная потребность составляет 2-3 мг. Биологические функции. Все формы витамина В6
используются в организме для синтеза коферментов: пиридоксальфосфата и пиридоксаминфосфата.
Коферменты образуются путѐм фосфорилирования по гидроксиметильной группе в пятом положении
пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата. Клинические
проявления недостаточности витамина. Авитаминоз В6 у детей проявляется повышенной возбудимостью ЦНС,
периодическими судорогами, что связано, возможно, с недостаточным образованием тормозного медиатора
ГАМК, специфическими дерматитами. У взрослых признаки гиповитаминоза В6 наблюдают при длительном
лечении туберкулѐза изониазидом (антагонист витамина В6). При этом возникают поражения нервной системы
(полиневриты), дерматиты.
Биохимические основы развития атеросклероза. Основные фактоыр риска, гипохолестериноз, нарушение
обмена липопротеинов, состояние сосудистой стенки. Добавочные факторы – повышение уровня
триацилглицеринов, ожирение, физическая активность. Генетическая предрасположенность – одна из
предпосылок развития гиперхолестеринемии. Нормализация гиперхолестеринемии – одно из основных условий
лечения атеросклероза
Факторы риска развития атеросклероза. Основное биохимическое проявление АС – отложение ХЛ в
стенках артерий. Болезнь является результатом нарушения любого звена сложной метаболической системы,
включающей:
1. синтез ХЛ
2. транспорт и выведение ХЛ
3. рецепция ЛПНП клетками тканей, в т.ч. сосудистой стенки
4. состояние клеточных мембран эндотелия сосудов
5. соотношение ЛПНП и ЛПВП в плазме.
Следствием нарушения путей системы является гиперхолестеринемия, преобладание в плазме ЛПНП, которые
на фоне поврежденного эпителия сосудов сопровождается увеличением его проницаемости для ХЛ и
накопление последнего в сосудистой стенке. Это приводит к нарушению клеток, выведение ХЛ в межклеточное
пространство, разрастанию и кальцификации соединительной ткани и образованием атеросклеротических
бляшек. ЛПНП (бета-ЛП), вводящие ХЛ в клетки, вызываются атерогенными. ЛПВП (альфа-ЛП) удаляют ХЛ из
тканей и поэтому являются антиатерогенными. Вероятность развития атеросклероза прогнозируется «индексом
атерогенности», который представляет собой отношение ХЛ в ЛПНП к ХЛ в составе ЛПВП.
У взрослых людей до 30 лет индекс 2-2,8; у лиц старше 30 лет 3-3,5. При АС индекс 4-6 и выше. Факторы риска
развития АС:
1. Гиподинамия. Следствием её является накопление АТФ, ослабление реакции биологического окисления,
торможение реакций ЦТК, усиление свободнорадикального окисления мембранных липидов,
гиперхолестеринемия.
2. Гипоксия, следствием которой является ослабление реакций биологического окисления и ЦТК, накопление
ацетил-КоА, гиперхолестеринемия.
3. Избыточное УВ питание, способствующие интенсивному синтезу ТАГ и ХЛ.
4. Стресс, следствием которого является мобилизация гликогена, усиленный синтез ТАГ и ХЛ
5. Избыток жиров в рационе.
|
Активность аминотрансфераз (АлАт и АсАт) в крови. |
Метод определения активности АлАт и АсАт основан на определении оптической плотности дифенилгидразона пирувата, явлвющегося продуктом дезаминирования аланина и иаспартата. |
АлАт 0.1-0.7
АсАт 0.1-0.55 |
Повышение активности аминотрансфераз в сыворотке крови отмечено при целом ряде заболеваний и особенно при поражении органов и тканейЮ, богатых данными ферментами (печень, миокард). АсАт – резкое повышение через 6-12 часов после возникновения инфаркта миокарда, достигает максимума к 24-48 часам, а затем постепенно к 5 дню приходит к норме. Если к 4-5 дню активность АсАт не снижается, то пророгноз плохой. АлАт – при заболеваниях печени, токсических поражениях печени, холепатиях, холестазе, дерматомиозите. Повышение активности АлАт наблюдается при остром инфаркте миокарда, но не столь резко по сравнению с изменением АсАт. В норме соотношение акимвности АлАт и АсАт= 1.33±0.42. У больных инфекционным гепатитом происходит снижение коэффициента, а при инфаркте миокарда – резко возрастает. |

Пантотеновая кислота и биотин, их участие в обменных процессах. Гиповитаминозы и авитаминозы В3 и Н.
Суточная потребность, источник этих витаминов.
Пантотеновая кислота (лекарственная форма — пантотенат кальция, витамин B5, неверное
обозначение — витамин B3). Пантотеновая кислота требуется для обмена жиров, углеводов, аминокислот,
синтеза жизненно важных жирных кислот, холестерина, гистамина, ацетилхолина, гемоглобина. Пантотеновая
кислота чувствительна к нагреванию, при термической обработке теряется почти 50 % витамина. Суточная
потребность человека в пантотеновой кислоте (5—10 мг) удовлетворяется при нормальном смешанном питании,
так как пантотеновая кислота содержится в очень многих продуктах животного и растительного происхождения
(дрожжи, икра рыб, яичный желток, зелѐные части растений, молоко, морковь, капуста и т. д.).Симптомы
гиповитаминоза: 1.усталость 2.депрессия 3.расстройство сна 4.повышенная утомляемость 5.головные боли 6.Тошнота 7. мышечные боли
Прямое и непрямое дезаминирование аминокислот. Окислительное дезаминирование аминокислот. Роль
глутамата, глутаматдегидрогеназы. Значение дезаминирования. Пути обезвреживания аммиака в организме.
Роль глутамина в обезвреживании и транспорта аммиака. Образование и выведение солей аммония почками.
Дезаминирование АК — реакция отщепления α-аминогруппы от АК, в результате чего образуется
соответствующая α-кетокислота и выделяется молекула аммиака.
Прямое дезаминирование - это дезаминирование, которое происходит в 1 стадию с участием одного
фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис.
Окислительное дезаминирование - самый активный вид прямого дезаминирования АК.
1. Глутаматдегидрогеназа (глу-ДГ) - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД),
содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в
митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ,
НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом). Реакция идѐт
в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата,
затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего
образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как
восстановительное аминирование α-кетоглутарата).___Йй
2. Оксидаза L-аминокислот. В печени и почках есть оксидаза L-АК, способная дезаминировать
некоторые L-аминокислоты: Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0,
активность фермента очень низка и вклад ее в дезаминирование незначителен.
3. Оксидаза D-аминокислот. Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-
зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно
образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
|
Количест-венное опре-деление общего холестерина в сыворотке крови ферментатив-ным методом |
ХС и его эфиры выде-ляются из липопро-теинов крови детер-гентами. Эфиры ХС гидролизуются холес-теролэстеразой с об-разованием ХС и жир-ных кислот. ХС окис-ляется холестеролок-сидазой кислородом воздуха. Образовав-шаяся при этом пере-кись водорода (Н2О2) взаимодействует с 4-аминоантипирином при участии перокси-дазы в присутствии фенола. Образуется окрашенное в крас-ный цвет вещество хинонимин, по интен-сивности окраски ко-торого судят о коли-честве ХС в исследу-емом образце. Расчет ведут по формуле: ХС (ммоль/л) = (Асыв/Аст) х 5,17; Аст= 0,3, это степень поглощения стандар-тного раствора ХС в конц. 5,17 ммоль/л (2 г ХС в 1 л раствора). |
3,9–5,18 ммоль/л |
Увеличение концентрации холес-терина отмечается при врож-денной гиперлипопротеидемии, а также при приобретенной (вто-ричной) гиперлипопротеидемии, отмечается при ишемической бо-лезни сердца (ИБС), заболеваниях печени, почек (ХПН), злокачест-венных опухолях поджелудочной железы, гипотиреозе, сахарном диабете. Снижение концентрации холесте-рина обнаружено при злокачест-венных опухолях печени, гипертиреозе, нарушениях всасывания, нарушениях питания, при обширных ожогах, хронических обструктивных ожогах, хронических обструктивных заболеваниях легких.
|

Фолиевая кислота и кобаламин, их участие в обменных процессах, авитаминозы. Пищевые источники,
суточная потребность.
Фолиевая кислота (витамин Вc, витамин B9). Источники. Значительное количество этого витамина
содержится в дрожжах, а также в печени, почках, мясе и других продуктах животного происхождения. Суточная
потребность в фолиевой кислоте колеблется от 50 до 200 мкг; однако вследствие плохой всасываемости этого
витамина рекомендуемая суточная доза - 400 мкг. Биологическая роль фолиевой кислоты определяется тем, что
она служит субстратом для синтеза коферментов, участвующих в реакциях переноса одноуглеродных радикалов
различной степени окисленности: метальных, оксиметильных, формильных и других. Эти коферменты
участвуют в синтезе различных веществ: пуриновых нуклеотидов, превращении сУМФ в сПГМФ, в обмене
глицина и серина. Наиболее характерные признаки авитаминоза фолиевой кислоты - нарушение кроветворения
и связанные с этим различные формы малокровия (макроцитарная анемия), лейкопения и задержка роста. При
гиповитаминозе фолиевой кислоты наблюдают нарушения регенерации эпителия, особенно в ЖКТ. Витамин
В12 (кобаламин). Источники. Это единственный витамин, синтезируемый почти исключительно
микроорганизмами: бактериями, актиномицетами и сине-зелѐными водорослями. Из животных тканей наиболее
богаты витамином В12 печень и почки. Суточная потребность в витамине В12 крайне мала и составляет всего 1-
2 мкг. Биологическая роль. Витамин В12 служит источником образования двух коферментов: метилкобаламина в
цитоплазме и дезоксиаденозилкобаламина в митохондриях. Основной признак авитаминоза В12 - макроцитарная
(мегалобластная) анемия. Для этого заболевания характерны увеличение размеров эритроцитов, снижение
количества эритроцитов в кровотоке, снижение концентрации гемоглобина в крови. Нарушение кроветворения
связано в первую очередь с нарушением обмена нуклеиновых кислот, в частности синтеза ДНК в
быстроделящихся клетках кроветворной системы.
Трансаминирование: специфичность аминотрансфераз и механизм их действия. Роль глутаминовой кислоты
в этих процессах. Биологическая роль реакций трансаминирования. Диагностическое значение определения
активности трансаминаз в сыворотке крови (инфаркт миокарда).
Трансаминирование — биохимическая ферментативная реакция обратимого переноса аминогруппы
с аминокислоты на кетокислоту без промежуточного образования аммиака. Ферменты, катализирующие
процесс, назвали трансаминазами, или аминотрансферазами. Продуктами чаще всего
являются аланин, аспарагин и глутамат, так как соответствующие им кетокислоты образуются в процессе
метаболизма углеводов. Трансаминирование играет важную роль в процессах
мочевинообразования, глюконеогенеза, путях образования новых аминокислот. Трансаминирование
аминокислот с образованием глутаминовой кислоты в сочетании с ѐѐ дезаминированием НАД(Ф)-зависимой
глутаматдегидрогеназой называется непрямым дезаминированием аминокислот (трансдезаминирование).
|
В) метод Лоури. |
Метод основан на способности белков образовывать окрашенные комплексы синего цвета при осуществлении двух цветных реакций – биуретовой и реакции Фолина (восстановление белками смеси фосфорновольфрамовой и фосфорномолиюденовой кислот – реактив Фолина). Интенсивность окраски зависит от количества белка. |

Витамин Е и К, участие их в обменных процессах. Гиповитаминозы и авитаминозы этих витаминов.
Пищевые источники, суточная потребность.
Витамины группы Е (токоферолы) найдены в природных источниках. Все они - метальные производные
исходного соединения токола, по строению очень близки и обозначаются буквами греческого алфавита.
Наибольшую биологическую активность проявляет α-токоферол.Источники витамина Е для человека -
растительные масла, салат, капуста, семена злаков, сливочное масло, яичный желток. Суточная
потребность взрослого человека в витамине примерно 5 мг. Биологическая роль. По механизму действия
токоферол является биологическим антиоксидантом. Он ингибирует свободнорадикальные реакции.
Клинические проявления недостаточностивитамина Е. Дефицит витамина Е проявляется развитием
гемолитической анемии.
Витамины К (нафтохиноны) существует в нескольких формах в растениях как
филлохинон (К1), клетках кишечной флоры как менахинон (К2). Источники витамина К -
растительные (капуста, шпинат, корнеплоды и фрукты) и животные (печень) продукты.
Суточная потребность в витамине взрослого составляет 1-2 мг. Биологическая функция
витамина К связана с его участием в процессе свѐртывания крови. Он участвует в активации
факторов свѐртывания крови. Витамин К участвует в реакциях карбоксилирования в качестве
кофермента. Основное проявление авитаминоза К - сильное кровотечение, часто приводящее
к шоку и гибели организма.
Мочевина как конечный продукт азотистого обмена. Биосинтез мочевины, его этапы. Связь орнитинового
цикла с метаболизмом фумаровой и аспарагиновой кислот. Нарушения синтеза и выведения мочевины.
Гипераммониемия.
Мочевина — химическое соединение, диамид угольной
кислоты. Белые кристаллы, растворимые в полярных
растворителях (воде, этаноле, жидком аммиаке).Мочевина
является конечным продуктом метаболизма белка
у млекопитающих. Производные нитрозомочевин находят
применение в фармакологии в качестве
противоопухолевых препаратов. Анализ на мочевину
входит в биохимический анализ крови. Нормы:
дети до 14 лет — 1,8—6,4 ммоль/л
взрослые до 60 лет — 2,5—6,4 ммоль/л
взрослые старше 60 лет — 2,9—7,5 ммоль/л
Синтез мочевины — циклический процесс состоит из
пяти реакций, катализируемый пятью отдельными
ферментами. Суммарное уравнение:
СO2+NH3+2H2O+Аспарат → H2N—CO—NH2+Фумарат.
При недостаточной активности ферментов орнитинового
цикла возникают гипераммониемии — патологические
состояния сопровождающиеся повышением концентрации
аммиака в крови.
|
Количественное определение глюкозы в крови глюкозооксидазным методом. |
Глюкоза окисляется глюкозооксидазой с образованием Н2О2. Перекись водорода образует окрашенное соединение с энзимохромогенным реактивом, интенсивность которого соответствует концентрации глюкозы. Определение на ФЭКе. |
3.3 – 5.5 ммоль/л 60 - 100 мг% |
Гипергликемии наблюдаются при: сахарном диабете, с. Иценко-кушинга, акромегалии, панкреатитах, тиреотоксикозе, феохромоцитоме, шоке. Также при увеличении приема глюкозы в пище, при психическом возбуждении. Гипогликемии наблюдаются при: мальабсорбции дисахаридов и глюкозы-галактозы, галактоземии, гликогенозах I, II, VI, гипогликемии новорожденных, инсулиновом шоке, ацетономической –рвоте, квашиоркоре, болезни Аддисона, гипофункции гипофиза, щитовидной железы. |

Гормоны – регуляторы обменных процессов в организме. Общие биологические признаки гормонов.
Классификация по их химической структуре. механизм действия гормонов. Гормоны проникающего действия и
непроникающего. Циклические посредники, их роль в регуляции гормонального эффекта. Аденилатциклазная
система. Роль кальция, инозилтрифосфата в передаче гормонального сигнала.
Гормоны – вещества органической природы, вырабатывающиеся в специализированных клетках желез
внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен веществ и
физиологические функции.
В это определение необходимо внести соответствующие коррективы в связи с обнаружением типичных
гормонов млекопитающих у одноклеточных (например, инсулин у микроорганизмов) или возможностью синтеза
гормонов соматическими клетками в культуре ткани (например, лимфоцитами под действием факторов роста).
Гормоны классифицируют в зависимости от места их природного синтеза, в соответствии с которым различают
гормоны гипоталамуса, гипофиза, щитовидной железы, надпочечников, поджелудочной железы, половых желез,
зобной железы и др. Современная классификация гормонов, основанной на их химической природе. В
соответствии с этой классификацией различают три группы истинных гормонов:
1) пептидные и белковые гормоны,
2) гормоны – производные аминокислот
3) гормоны стероидной природы.
Четвертую группу составляют эйкозаноиды – гормоноподобные вещества, оказывающие местное действие.
Пептидные и белковые гормоны включают от 3 до 250 и более аминокислотных остатков. Это гормоны
гипоталамуса и гипофиза (тиролиберин, соматолиберин, соматостатин, гормон роста, кортикотропин,
тиреотропин), а также гормоны поджелудочной железы (инсулин, глюкагон). Гормоны – производные
аминокислот в основном представлены производными аминокислоты тирозина. Это низкомолекулярные
соединения адреналин и норадреналин, синтезирующиеся в мозговом веществе надпочечников, и гормоны
щитовидной железы (тироксин и его производные). Гормоны 1-й и
2-й групп хорошо растворимы в воде. Гормоны стероидной
природы представлены жирорастворимыми гормонами коркового
вещества надпочечников (кортикостероиды), половыми гормонами
(эстрогены и андрогены), а также гормональной формой витамина
D.Эйкозаноиды, являющиеся производными полиненасыщенной
жирной кислоты (арахидоновой), представлены тремя подклассами
соединений: простагландины, тромбоксаны и лейкотриены. Эти
нерастворимые в воде и нестабильные соединения оказывают свое
действие на клетки, находящиеся вблизи их места синтеза.Гормоны
первого типа связываются поверхностными рецепторами,
расположенными на плазматической мембране. Различают три
вида взаимодействия гормонов с плазматической мембраной. При взаимодействии первого вида
гормонрецепторный комплекс, находящийся на поверхности клеток, вызывает образование так называемого
второго посредника — циклического аденозин-3,5-монофосфата (цАМФ), и последующие действия гормона
опосредуются цАМФ. Этот механизм характерен для некоторых белковых гормонов и биогенных аминов. При
взаимодействии второго вида рецептор клеточной поверхности индуцирует продукцию или высвобождение
иных вторых посредников, например кальция. Этот механизм характерен для некоторых нейротрансмиттеров и
РТГ. При взаимодействии третьего вида комплекс поверхностный рецептор — гормон интернализуется внутрь
клетки. К последней категории гормонов относится инсулин.Некоторые гормоны, такие как стероидные
гормоны и гормоны щитовидной железы, по свойствам являются гидрофобными. В плазме крови для их
транспортировки используются специальные белки-транспортеры. В комплексе с этими белками они не
способны взаимодействовать с мембранными рецепторами, но способны отрываться от них и диффундировать
через клеточную мембрану внутрь клетки. После перехода в цитозоль гормоны немедленно подхватываются
другими белками, которые уже являются рецепторами. Комплекс гормон-рецептор в некоторых случаях
дополнительно модифицируется и активируется. Далее он проникает в ядро, где может связываться сядерным
рецептором. В результате гормон приобретает сродство к ДНК. Связываясь с гормон-чувствительным
элементом в ДНК, гормон влияет на транскрипцию определенных генов и изменяет концентрацию РНК в клетке
и, соответственно, количество определенных белков в клетке.
Распад гема. Билирубин как продукт распада гема. Метаболизм билирубина. Нарушение его обмена.
Желтухи и их биологическая диагностика.
Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются (состарившиеся
эритроциты фагоцитируются макрофагами, главным образом в селезенке, а также в печени и костном мозге; в
микросомальной фракции ретикуло-эндотелиальной системы клеток) и освобождается гемоглобин. В
организме человека в течение 1 ч разрушается примерно 100-200 млн эритроцитов. Гем повторно не
используется: он распадается с образованием железа и желчных пигментов; железо реутилизируется, а
желчные пигменты выводятся из организма. Распад гемоглобина в печени начинается с разрыва a-метиновой
связи между I и II кольцами порфиринового кольца, т.е окисляется один из метеновых мостиков
тетрапиррольной структуры гемма, углерод метеновой группы превращается в оксид углерода СО. Этот процесс
катализируется НАДФ-содержащей оксидазой ЭПР (гем-оксигеназой) с помощью кислорода и НАДФН и
приводит к образованию зеленого пигмента вердоглобина (холеглобина). Интенсивный цвет гема и
других порфиринов является результатом сопряжения многочисленных двойных связей, которые образуют две
резонансно стабилизированные (мезомерные) системы. Основное место образования билирубина − печень,
селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метановых связей в
протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью
попадает в желчный пузырь. Билирубин, образовавшийся в клетках системы макрофагов, называется
свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко
адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное
осаждение белков спиртом и только после этого билирубин вступает во взаимодействие с диазореактивом. Так
как билирубин нерастворим в воде, плохо растворим в плазме, его транспорт в крови осуществляется в
комплексе с альбумином. Повышенный уровень билирубина (>10 мг/л)
называется гипербилирубинемией. Билирубин диффундирует из крови в периферические ткани и окрашивает их
в желтый цвет. Это особенно легко заметить на белой конъюктиве глаза, в таком случае говорят о желтухе.
|
Количественное определение пировиноградной кислоты в сыворотке крови. |
Пировиноградная кислота в щелочной среде дает с салициловым альдегидом оранжевое окрашивание, пропорциональное содержанию пирувата. Оптическая плотность раствора определяется на ФЭКе. |
0.3 – 0.9 мг% 34 – 102 ммоль/л |
Пировиноградная кислота является продуктом метаболизма углеводов, аминокислот, глицерина в клетке. Увеличение количества пирувата в крови наблюдается при тканевой гипоксии и связано с торможением ее окислительного декарбоксилирования и дальнейшего окисления в ЦТК. Увеличение: при гиповитаминозах В1, В2, В3, В5, ИБС. |

Гормоны гипоталамуса – либерины и статины. Химическая природа. Механизм их действия на
молекулярном уровне, биологический эффект.
Гипоталамус служит местом непосредственного взаимодействия высших отделов ЦНС и эндокринной
системы. гипоталамуса были выделены первые гуморальные факторы, оказавшиеся гормональными веществами
с чрезвычайно высокой биологической активностью. Эти вещества получили наименование рилизинг-
факторов или либеринов. Вещества с противоположным действием, гипофизарных гормонов, стали называть
ингибирующими факторами, или статинами. Таким образом, гормонам гипоталамуса принадлежит ключевая
роль в физиологической системе гормональной регуляции многосторонних биологических функций отдельных
органов, тканей и целостного организма. К настоящему времени в гипоталамусе открыто 7 стимуляторов
(либерины) и 3 ингибитора (статины) секреции гормонов гипофиза, а именно: кортиколиберин, тиролиберин,
люлиберин, фоллилиберин, соматолиберин, пролактолиберин, меланолиберин, соматостатин, пролактостатин и
меланостатин. Установлено, что по химическому строению все гормоны гипоталамуса являются
низкомолекулярными пептидами, так называемыми олигопептидами необычного строения, хотя точный
аминокислотный состав и первичная структура выяснены не для всех.1.Тиролиберин (Пиро-Глу–Гис–Про–
NH2): представлен трипептидом, состоящим из пироглутаминовой(циклической) кислоты, гистидина и
пролинамида, соединенных пептидными связями. В отличие от классических пептидов он не содержит
свободных NH2- и СООН-групп у N- и С-концевых аминокислот.Ответственен за выпуск гормона,
стимулирующего работу щитовидной железы.2. Гонадолиберин является декапептидом, состоящим из 10
аминокислотв последовательности: Пиро-Глу–Гис–Трп–Сер–Тир–Гли–Лей–Арг–Про–Гли-NН2. Концевая С-
аминокислота представлена глицинамидом.ГнРГ вызывает усиление секреции передней
долей гипофиза гонадотропных гормонов —лютеинизирующего гормона и фолликулостимулирующего
гормона. 3. Соматостатин является циклическим тетрадекапептидом (состоит из14 аминокислотных остатков).
Отличается этот гормон от двух предыдущих, помимо циклической структуры, тем, что не содержит на N-конце
пироглутаминовой кислоты: дисульфидная связь образуется между двумя остатками цистеина в 3-ми в 14-м
положении. Он оказывает широкий спектрбиологического действия; в частности, показано ингибирующее
действие насинтез гормона роста в аденогипофизе, а также прямое тормозящее действие его на биосинтез
инсулина и глюкагона в β- и α-клетках островков Лангерганса.4. Соматолиберин недавно выделен из
природных источников. Он представлен 44 аминокислотными остатками с полностью раскрытой
последовательностью. Биологической активностью соматолиберина наделен, крометого, химически
синтезированный декапептид: Н-Вал–Гис–Лей–Сер–Ала–Глу–Глн–Лиз–Глу–Ала-ОН. Этот декапептид
стимулирует синтез и секрецию гормона роста гипофиза соматотропина.5. Меланолиберин, химическая
структура которого аналогична структуре открытого кольца гормона окситоцина (без трипептидной боковой
цепи), имеет следующее строение: Н-Цис–Тир–Иле–Глн Асн–Цис-ОН. Необходимо отметить, что
меланолиберин оказывает стимулирующее действие, а меланостатин, напротив, ингибирующее действие на
синтез и секрецию меланотропина в передней доле гипофиза.6. Меланостатин (меланотропинингибирующий
фактор) представлен или трипептидом: Пиро-Глу–Лей–Гли-NН2, или пентапептидом со следующей
последовательностью: Пиро-Глу–Гис–Фен–Aрг–Гли–NН2 . МСГ стимулируют синтез и секрецию меланинов
(меланогенез) клетками - меланоцитами кожи и волос, а также пигментного слоя сетчатки глаза. Наиболее
сильное влияние на пигментацию оказывает альфа-меланоцитстимулирующий гормон.
Гем, основные этапы биосинтеза. Возможные нарушения обмена порфинов, приводящие к ослаблению
синтеза гема. Гемоглобин, его структура. Гетерогенность гемоглобинов (3 типа гемоглобинов у человека).
Свойства гемоглобина: кооперативное взаимодействие субъединиц. Виды гемоглобина (P, F, A). Формы
гемоглобина: оксигемоглобин, карбгемоглобин, метгемоглобин, карбоксигемоглобин. Функции гемоглобина.
Влияние 2,3-дифосфоглицерата эритроцита на процесс оксигенации. Патологии гемоглобина – гемоглобинозы.
Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-
связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в
костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма.
Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА, промежуточного продукта
цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-
аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) является
ключевым ферментом всего пути. Экспрессия синтеза ALA-
синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся
ферментом. Это типичный случай торможения конечным продуктом,
или ингибирования по типу обратной связи. После синтеза 5-
аминолевулинат переходит из митохондрий в цитоплазму, где две
молекулы конденсируются в порфобилиноген, который уже
содержит пиррольное кольцо. Порфобилиноген-
синтаза ингибируется ионами свинца. Поэтому при острых
отравлениях свинцом в крови и моче обнаруживают повышенные
концентрации 5-аминолевулината. На последующих стадиях
образуется характерная для порфирина тетрапиррольная структура.
Связывание четырех молекул порфобилиногена с отщеплением NH2-
групп и образованиемуропорфириногена
III катализируется гидроксиметилбилан-синтазой. Для образования
этого промежуточного продукта необходим второй
фермент, уропорфириноген III-синтаза. Отсутствие этого фермента
приводит к образованию «неправильного» изомера —
уропорфириногена I. Тетрапиррольная
структура уропорфиринoгена III все еще
существенно отличается от гема. Так,
отсутствует центральный атом железа, а
кольцо содержит только 8 вместо 11
двойных связей. Кроме того, кольца
несут только заряженные боковые цепи
R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках
функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее
полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп.
Образующийся копропорфириноген IIIснова возвращается в митохондрии. Дальнейшие стадии катализируются
ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под
действием оксидазы две пропионатные группы (R2) превращаются в винильные. Модификация боковых цепей
заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле
создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом
расходуется 6 восстановительных эквивалентов. В заключение с помощью специального
фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким
образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин , где он связан
нековалентно, или в цитохром С, с которым связывается ковалентно.Гемоглобин —
сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться
с кислородом, обеспечивая его перенос в ткани. У человека содержится в эритроцитах. Нормальным
содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний
предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и
подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень
гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня
95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в
крови. Виды гемоглобина:
Гемоглобин A, или ΗbA — нормальный гемоглобин взрослого человека.
Гемоглобин С (Hemoglobin C), или ΗbC — один из мутантных гемоглобинов
Гемоглобин E (HbE, эмбриональный гемоглобин) — эмбриональный тип гемоглобина человека.
Гемоглобин S (HbS) — это особая мутантная форма гемоглобина, образующаяся у больных
с серповидно-клеточной анемией и склонная к кристаллизации вместо образования нормальной
четвертичной структуры и растворения в цитоплазме эритроцита.
Гемоглобин F (HbF) — фетальный, плодный тип гемоглобина человека.
|
Определение активности каталазы по Баху и Зубковой в крови. |
Титриметрический метод. Активность каталазы определяется по ее способности разрушать перекись водорода в течение 60 минут. |
0.7 – 1.3 ммоль/ч |
Снижение активности каталазы наблюдается при инфекционных заболеваниях (брюшной тиф, скарлатина, малярия, туберкулез легких), остром периоде вирусного гепатита, при хронических отравлениях ртутью, фосфором, мышьяком, свинцом. Увеличивается активность при бронхо-легочной патологии у детей, при оперативных вмешательствах при местной анестезии. |

Тропные гормоны гипофиза: соматотропный гормон, адренокортикотропный, тиреотропный, гонадотропные
гормоны. Химическая природа. Механизм действия, биологический эффект. Нарушение функций организма и
недостаточная или избыточная выработка соматотропина.
Адренокортикотропный гормон (АКТГ, кортикотропин) вырабатываемый базофильными
клеткамиаденогипофиза. АКТГ, помимо основного действия – стимуляции синтезаи секреции гормонов коры
надпочечников, обладает жиромобилизующейи меланоцитстимулирующей активностью. Молекула АКТГ
содержит 39 аминокислотных остатков.
Данные о механизме действия АКТГ на синтез стероидных гормонов свидетельствуют о существенной роли
аденилатциклазной системы. Предполагают, что АКТГ вступает во взаимодействие со специфическими
рецепторами на внешней поверхности
клеточной мембраны (рецепторы представлены
белками в комплексе с другими молекулами, в
частности с сиаловой кислотой). Сигнал затем
передается на фермент аденилатциклазу,
расположенную на внутренней поверхности
клеточной мембраны, которая катализирует
распад АТФ и образование цАМФ. Последний
активирует протеинкиназу, которая в свою
очередь с участием АТФ осуществляет
фосфорилирование холинэстеразы,
превращающей эфиры холестерина в
свободный холестерин, который поступает в
митохондрии надпочечников, где содержатся
все ферменты, катализирующие превращение
холестерина в
кортикостероиды.Соматотропный гормон
(СТГ, гормон роста, соматотропин)
синтезируется в ацидофильных клетках
передней доли гипофиза; концентрация его в
гипофизе составляет 5–15 мг на 1 г ткани. СТГ
человека состоит из 191 аминокислоты и содержит две дисульфидные связи; N- и С-концевые аминокислоты
представлены фенилаланином. СТГ обладает широким спектром биологического действия. Он влияет на все
клетки организма, определяя интенсивность обмена углеводов, белков, липидов и минеральных веществ. Он
усиливает биосинтез белка, ДНК, РНК и гликогена и в то же время способствует мобилизации жиров из депо и
распаду высших жирных кислот и глюкозы в тканях. Помимо активации процессов ассимиляции,
сопровождающихся увеличением размеров тела, ростом скелета, СТГ координирует и регулирует скорость
протекания обменных процессов. Многие биологические эффекты этого гормона осуществляются через особый
белковый фактор, образующийся в печени под влиянием гормона – соматомедин. По своей природе он оказался
пептидом с мол. массой 8000. Тиреотропный гормон (ТТГ, тиротропин) является сложным гликопротеином и
содержит, кроме того, по две α- и β-субъединицы,которые в отдельности биологической активностью не
обладают: мол. масса его около 30000.Тиротропин контролирует развитие и функцию щитовидной железыи
регулирует биосинтез и секрецию в кровь тиреоидных гормонов. Полностью расшифрована первичная
структура α- и β-субъединиц тиротропина: α-субъединица, содержащая 96 аминокислотныхостатков; β-
субъединица тиротропина человека, содержащая 112 аминокислотных остатков,К гонадотропным гормонам
(гонадотропины) относятся фолликулостимулирующий гормон (ФСГ,фоллитропин) и лютеинизирующий
гормон (ЛГ, лютропин). Оба гормона синтезируютсяв передней доле гипофиза и являются сложнымибелками –
гликопротеинами с мол. массой 25000. Они регулируют стероидо - и гаметогенез в половых железах.
Фоллитропин вызывает созревание фолликулов в яичниках у самок и сперматогенез – у самцов. Лютропину
самок стимулирует секрецию эстрогенов и прогестерона, как и разрыв фолликулов с образованием желтого тела,
а у самцов – секрецию тестостерона и развитие интерстициальной ткани. Биосинтез гонадотропинов,как было
отмечено, регулируется гипоталамическим гормоном гонадолиберином.Лютропин состоит из двух α- и β-
субъединиц: α-субъединица гормона содержит из 89 аминокислотных остатков с N-конца и отличается природой
22 аминокислот.
Источники и пути использования аминокислот в тканях (общая схема). Азотистый баланс. Полноценные и
неполноценные белки. Переваривание белков в полости желудка. Ферменты, расщепляющие белки. Соляная
кислота, ее роль. Гормональная регуляция сокоотделени. Состав желудочного сока, методы его исследования,
диагностическое значение. Определение уропепсина.
Источники и пути использования аминокислот в клетках. Источники свободных аминокислот в
клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Аминокислоты -
органические соединения, являющиеся основной составляющей частью белков (протеинов). Аминокислоты
определяют биологическую специфичность белков и их пищевую ценность. Нарушение обмена аминокислот
является причиной многих болезней. Аминокислоты всасываются из желудочно-кишечного тракта и с кровью
поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным изменениям.
В крови поддерживается постоянная концентрация аминокислот. В мышцах, ткани головного мозга и печени
содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Аминокислоты делятся
на незаменимые (валин, лейцин, фенилаланин, изолейцин, метионин, триптофан, треонин, лизин); частично
заменимые (аргинин и гистидин); заменимые (аланин, аспарагин, аспарагиновая кислота, глицин (гликокол),
серин, глутамин, пролин, тирозин, глутаминовая кислота, цистеин. Незаменимые аминокислоты не
синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны
поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие
организма. В желудке переваривание белков происходит при действии протеолитического фермента пепсина;
существенную роль в этом процессе играет соляная кислота желудочного сока. Соляная кислота образуется в
обкладочных клетках желудочных желез и секретируется в полость желудка, где ее концентрация достигает 0,16
М (около 0,5 %). За счет этого желудочный сок имеет низкое значение рН, в пределах 1-2. Соляная кислота,
помимо активации пепсиногена, выполняет и другие важные функции. В кислой среде желудочного сока
большинство белков денатурируется, что облегчает их
последующее переваривание пепсином. Конечно, если
употребляется пища, обработанная при высокой температуре
(например, вареное мясо), эта роль соляной кислоты не имеет
значения. Кроме того, кислый поджелудочный сок, обладая
бактерицидным действием, создает барьер для попадания
болезнетворных бактерий в кишечник. Протеолитические
ферменты — белки, пептид-гидролазы, ферменты класса
гидролаз, расщепляющие пептидные связи между аминокислотами в белках и пептидах. Протеолитические
ферменты играют важнейшую роль в переваривании белков пищи в желудке и кишечнике человека.
Большинство протеолитических ферментов органов пищеварения продуцируется в виде проферментов.
Физиологический смысл этого заключается в том, чтобы акт продукции фермента (профермента) был отделен от
акта его активации — превращения в фермент и, таким образом, белки тканей, продуцирующих ферменты, не
подвергались воздействию этих самых ферментов. Протеазы подразделяются на: экзопептидазы (пептидазы),
гидролизующие (расщепляющие), преимущественно, внешние пептидые связи в белках и пептидах
эндопептидазы (протеиназы), гидролизующие, преимущественно, внутренние пептидые связи Химический
состав желудочного сока: вода (995 г/л); хлориды (5—6 г/л); сульфаты (10 мг/л); фосфаты (10—60 мг/л);
гидрокарбонаты (0—1,2 г/л) натрия, калия, кальция, магния; аммиак (20—80 мг/л). В сутки в желудке взрослого
человека вырабатывается около 2 л желудочного сока. Уропепсин (пепсиноген мочи) выделяется почками в
повышенных количествах при язвенной болезни и гиперацидном гастрите, стероидной терапии, болезни
Иценко—Кушинга. Понижено выделение уропепсина при желудочной ахилии, гипо– и анацидном гастритах,
раке желудка, аддисоновой болезни.
|
Количественное определение глюкозы в крови глюкозооксидазным методом. |
Глюкоза окисляется глюкозооксидазой с образованием Н2О2. Перекись водорода образует окрашенное соединение с энзимохромогенным реактивом, интенсивность которого соответствует концентрации глюкозы. Определение на ФЭКе. |
3.3 – 5.5 ммоль/л 60 - 100 мг% |
Гипергликемии наблюдаются при: сахарном диабете, с. Иценко-кушинга, акромегалии, панкреатитах, тиреотоксикозе, феохромоцитоме, шоке. Также при увеличении приема глюкозы в пище, при психическом возбуждении. Гипогликемии наблюдаются при: мальабсорбции дисахаридов и глюкозы-галактозы, галактоземии, гликогенозах I, II, VI, гипогликемии новорожденных, инсулиновом шоке, ацетономической –рвоте, квашиоркоре, болезни Аддисона, гипофункции гипофиза, щитовидной железы. |

Гормоны задней доли гипофиза: вазопрессин, окситоцин. Химическая природа. Механизм их действия,
биологический эффект. Нарушения функций организма, связанные с недостатком выработки этих гормонов.
Гормоны вазопрессин и окситоцин синтезируются рибосомальным путем. Оба гормонапредставляют
собой нонапептиды следующего строения: Вазопрессин отличается от окситоцина двумя аминокислотами: он
содержит в положении 3 от N-конца фенилаланин вместо изолейцинаи в положении 8 – аргинин вместо лейцина.
Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких
мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрецию молока.
Вазопрессин стимулирует сокращение гладких мышечных волокон сосудов, оказывая сильное вазопрессорное
действие, однако основная роль его в организме сводится к регуляции водного обмена, откуда его второе
название антидиуретического гормона. В небольших концентрациях (0,2 нг на 1 кг массы тела) вазопрессин
оказывает мощное антидиуретическое действие – стимулирует обратный ток воды через мембраны почечных
канальцев. В норме он контролирует осмотическое давление плазмы крови и водный баланс организма человека.
При патологии, в частности атрофии задней доли гипофиза, развивается несахарный диабет – заболевание,
характеризующееся выделением чрезвычайно больших количеств жидкости с мочой. При этом нарушен
обратный процесс всасывания воды в канальцах почек.
Биосинтез РНК (транскрипция): РНК-полимераза, стехиометрия реакции, ДНК как матрица. Регуляция
транскрипции. Посттранскрипционная достройка РНК. Молекулярные мутации. Наследственные болезни.
Субстратами реакции служат трифосфаты рибонуклеозидов. Реакция идет только в присутствии ДНК,
выполняющей роль матрицы. Матрицей служит одна из цепей ДНК, называемая матричной (а также
кодирующей, значащей) цепью. Все синтезированные молекулы РНК имеют структуру, комплементарную
матрице, т. е. одной из цепей ДНК. Поскольку РНК
представляет собой одноцепочечную молекулу
(спирализованные участки составляют лишь часть молекулы),
стехиомет-рические коэффициенты для всех четырех
субстратов различны. Транскрипцию катализируют РНК-
полимеразы I, II и III. Первый из этих ферментов участвует в
синтезе рибосомных РНК, второй — матричных и третий —
транспортных РНК. В процессе транскрипции различают
стадии инициации, элонгации и терминации. В результате
транскрипции образуются предшественники тРНК, рРНК и
мРНК — первичные транскрипты. Затем в ядре и в цитоплазме
происходит посттранскрипционная доработка (созревание) этих
предшественников, и получаются функционально активные
рибонуклеиновые кислоты. Промотор содержит
последовательность, обогащенную нуклеотидами Т и А (ТАТА-последовательность), узнаваемую белком ТАТА-
фактором. РНК-полимера-за присоединяется к промотору, если ТАТА-последовательность связана с ТАТА-
фактором. Матрицей для синтеза РНК служит одна из цепей ДНК; промотор с ТАТА-фактором обеспечивают
узнавание РНК-полимеразой транскрибируемой цепи ДНК и первого нуклеотида транскрибируемого гена.
Связывание РНК-поли-меразы с промотором и вызванные этим конформационные изменения повышают
сродство РНК-полимеразы к факторам инициации. Присоединение этих факторов приводит к локальному
расхождению нуклеотидных цепей ДНК; расхождение включает около 10 нуклеотидных пар, т. е. примерно
один виток спирали.
Элонгация. Наращивание молекулы РНК происходит путем присоединения очередного рибонуклеотида,
комплементарного тому дезоксирибонуклеотиду ДНК, который в данный момент находится в области активного
центра РНК-полимеразы. В активном центре фермента находится З'-конец растущей цепи РНК, и к нему
присоединяется очередной нуклеотид.__
|
Количественное определение кальция в сыворотке крови. |
Метод основан на взаимодействии Са2+сыворотки крови с мурексидом, который в свободном состоянии окрашен в синий цвет, а в комплексе с Са2+в розовый. Титрование раствором трилона «Б» (Na соль ЭДТА) вытесняет катионы Са2+до образования свободного мурексида. По количеству трилона «Б» судят о количетсве Са в крови. |
9-11 мг%
|
Гиперкальциемия при: гиперпаратиреоз, нефропатия гиперкальцемическая, алкалоз респираторный, с. Иценко-Кушинга, феохромоцитома, тиреотоксикоз, гипернефрома, болезнь Бехтерева, акромегалия, пневмония плазмоклеточная. Гипокальциемия при: гипопаратиреоз, хроническая почечная недостаточность, атрезия желчных протоков, нефронофтиз, панкреатиты, рахит, кишечный токсикоз. |

Ферменты, история открытия и изучения ферментов, особенности ферментативного катализа. Специфичность
действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации
фермента и субстрата.
Ферменты – биологические катализаторы белковой природы, образуемые живой клеткой, действующие
с высокой активностью и специфичностью. Сходство ферментов с небиологическими катализаторами
заключается в том, что:
ферменты катализируют энергетически возможные реакции;
энергия химической системы остаѐтся постоянной;
в ходе катализа направление реакции не изменяется;
ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
ферменты обладают высокой специфичностью;
ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном
давлении и физиологическом значении рН;
скорость ферментативной реакции может регулироваться.
Современная классификация ферментов основана на природе катализируемых ими химических
превращений. В основу классификации берется тип реакции, катализируемой ферментом. Ферменты разделяют
на 6 классов:
1. Оксидоредуктазы - катализируют окислительно-восстановительные реакции
2. Трансферазы – перенос групп
3. Гидролазы – гидролиз
4. Лиазы – негидролитическое расщепление субстрата
5. Изомеразы – изомеризация
6. Лигазы (синтетазы)- синтез с использованием энергии (АТФ)
Номенклатура ферментов.
1. Тривиальное название (пепсин, трипсин).
2. Название фермента может складываться из названия субстрата с прибавлением окончания «аза»
(аргиназа гидролизует аминокислоту аргинин).
3. Добавление окончания «аза» к названию катализируемой реакции (гидролаза катализирует
гидролиз, дегидрогеназа – дегидрирование органической молекулы, т.е. отнятие протонов и электронов от
субстрата).
4. Рациональное название – название субстратов и характер катализируемых реакций (АТФ + гексоза
гексозо-6-фосфат + АДФ. Фермент: АТФ: D-гексоза-6-фосфотрансфераза).
5. Индексирование ферментов (каждому ферменту присваиваются 4 индекса или порядковых
номера): 1.1.1.1 – АДГ, 1.1.1.27 – ЛДГ.
Зависимость скорости ферментативной реакции от рН средыДля каждого фермента существует значение
рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит
к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией
функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию
активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации
функциональных групп молекулы белка. Например, при закислении среды происходит протонирование
свободных аминогрупп (NH3
+), а при защелачивании происходит отщепление протона от карбоксильных групп
(СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра;
следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру.
Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты),
эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако
большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с
физиологическим значением рН.
Зависимость скорости ферментативной реакции от температуры средыПовышение температуры до
определѐнных пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию
температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что
приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может
повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость
химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого
сопровождается понижением ферментативной активности, возникающим из-за термической денатурации
белковой молекулы. Для большинства ферментов человека оптимальна температура 37-38 °С. Специфичность –
очень высокая избирательность ферментов по отношению к субстрату. Специфичность фермента объясняется
совпадением пространственной конфигурации субстрата и субстратного центра (стерическое совпадение). За
специфичность фермента ответственен как активный центр фермента, так и вся его белковая молекула.
Активный центр фермента определяет тип реакции, который может осуществить данный фермент. Различают
три вида специфичности:
Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один
субстрат. Например, сахараза гидролизует только сахарозу, лактаза – лактозу, мальтаза – мальтозу, уреаза –
мочевину, аргиназа – аргинин и т.д.Относительная специфичность – это способность фермента действовать на
группу субстратов с общим типом связи, т.е. относительная специфичность проявляется только по отношению к
определенному типу связи в группе субстратов. Пример: липаза расщепляют сложноэфирную связь в жирах
животного и растительного происхождения. Амилаза гидролизует α-гликозидную связь в крахмале, декстринах
и гликогене. Алкогольдегидрогеназа окисляет спирты (метанол, этанол и др.). Стереохимическая
специфичность – это способность фермента действовать только на один стереоизомер. Например: 1) α, β-
изомерия: α – амилаза слюны и сока поджелудочной железы расщепляет только α-глюкозидные связи в
крахмале и не расщепляет β-глюкозидные связи клетчатки. Международной единицей (МЕ) активности
ферментов является количество фермента, способного превратить 1 мкмоль субстрата в продукты реакции за 1
мин при 25 °С и оптимуме рН. Катал соответствует количеству катализатора, способного превращать 1 моль
субстрата в продукт за 1 сек при 25 °С и оптимуме рН. Удельная активность фермента – число единиц
ферментативной активности фермента в расчете на 1 мг белка. Молярная активность – это отношение числа
единиц ферментативной активности каталов или МЕ к числу молей фермента.
Биосинтез ДНК (репликация): стехиометрия реакций, ДНК-полимераза, матрица. Повреждение и распад
ДНК.
Источником энергии в реакциях полимеризации мононуклеотидов является энергия, освобождаемая
всеми четырьмя типами дезоксирибонуклеозидтрифосфатов, участвующих в синтезе ДНК. Образующийся
пирофосфат под действием пирофосфатазы также
расщепляется на две молекулы ортофосфата, давая
дополнительную энергию для биосинтеза ДНК.
Помимо энергии, биогенез ДНК требует наличия
специфических ферментов, катализирующих
отдельные этапы синтеза, и множества белковых
факторов, абсолютно необходимых для
регулирования процесса репликации и проявления
каталитической активности ферментов. По
имеющимся данным, в репликации ДНК,
включающей узнавание точки начала процесса,
расплетение родительских цепей ДНК в
репликационной вилке, инициацию биосинтеза
дочерних цепей и дальнейшую их элонгацию и,
наконец, окончание (терминация) процесса,
участвует более 40 ферментов и белковых
факторов, объединенных в единую ДНК
репликазную систему, называемую реплисомой.
Основным ферментом, катализирующим
биосинтез новообразованной ДНК (точнее, стадию
элонгации репликации ДНК), является ДНК-
полимераза III, представляющая собой
мультимерный комплекс собственно ДНК-
полимеразы (мол. масса около 900000) и ряда других белков. ДНК-полимераза III катализирует сопряженный
синтез ведущей (лидирующей) и отстающей цепей ДНК при репликации. ДНК-полимераза I катализирует
отщеплениезатравочного олигорибонуклеотидного праймера и заполнение образующихся после этого пробелов
(ниш) дезоксирибонуклеотидами. Важную функцию соединения двух цепей ДНК или замыкания двух ко нцов
одной цепи ДНК в процессе репликации либо репарации ДНК выполняет особый фермент – ДНК-лигаза,
катализирующая за счет энергии АТФ образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы
одной цепи и 5'-фосфатной группой другой цепи ДНК. Функцию раскручивания (расплетения) двойной спирали
ДНК в репликационной вилке, происходящего за счет энергии гидролиза АТФ, выполняет специфический rep -
белок, названный хеликазой (мол. Масса 300000).
Этапы биосинтеза ДНК.
Этап I – инициация биосинтеза ДНК – является началом синтеза дочерних нуклеотидных цепей; в
инициации участвует минимум восемь хорошо изученных и разных ферментов и белков. Первая фаза – это
ферментативный биосинтез на матрице ДНК необычного затравочного олигорибонуклеотида (праймера) со
свободной гидроксильной группой у С-3' рибозы. При инициации к цепям ДНК последовательно
присоединяются ДНК-раскручивающие и ДНК-связывающие белки, а затем комплексы ДНК-полимераз и
праймаз.
Этап II – элонгация синтеза ДНК – включает два кажущихся одинаковыми, но резко различающихся
по механизму синтеза лидирующей и отстающей цепей на обеих материнских цепях ДНК. Синтез лидирующей
цепи начинается с синтеза праймера (при участии праймазы) у точки начала репликации, затем к праймеру
присоединяются дезоксирибонуклеотиды поддействием ДНК-полимеразы III; далее синтез протекает
непрерывно, следуя шагу репликационной вилки. Синтез отстающей цепи, напротив, протекает в направлении,
обратном движению репликационной вилки и начинается фрагментарно.
Этап III – терминация синтеза ДНК – наступает, скорее всего, когдаисчерпана ДНК-матрица и
трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка
на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов
репарации.__
|
Количест-венное опре-деление би-лирубина в сыворотке крови мето-дом разбав-ления по Бакальчуку |
Метод основан на цветной реакции би-лирубина с диазореак-тивом. Для появления розово-фиолетовой окраски достаточно 0,00156 мг билирубина в 1 мл, что соответствует,16 мг%. Чтобы найти наименьшее количество сыворотки, дающее с диазореактивом характерную окраску и соответствующее 0,16 мг% билирубина, сыворотку разбавляют в геометрической прогрессии пока не будет найдена граница видимой окраски. Отметить последнюю пробирку, в которой наблюдается окраска от прибавления реактива. Расчет ведут по формуле: Билирубин (мг%) = 0,00156мг•разведение •100 |
1,7-20,5 мкмоль/л |
Определение общего билирубина и его фракций в крови имеет важное значение при дифференциальной диагностике желтух |

Гормоны мозгового слоя надпочечников – катехоламины: адреналин и норадреналин. Химическая природа
и биосинтез. Механизм действия гормонов на молекулярном уровне, их роль в регуляции обмена углеводов,
жиров и аминокислот. Нарушения обмена при заболеваниях надпочечников.
Эти гормоны по строению напоминают аминокислоту тирозин, от которого они отличаются наличием
дополнительных ОН-групп в кольце и у β-углеродного атома боковой цепи и отсутствием карбоксильной
группы.
В мозговом веществе надпочечников человека массой 10 г содержится около 5 мг адреналина и 0,5 мг
норадреналина. Содержание их в крови составляет соответственно 1,9 и 5,2 нмоль/л. В плазме крови оба
гормона присутствуют как в свободном, так и в связанном, в частности, с альбуминами состоянии. Небольшие
количества обоих гормонов откладываются в виде соли с АТФ в нервных окончаниях, освобождаясь в ответ на
ихраздражение. Кроме того, все они оказывают мощное сосудосуживающее действие, вызывая повышение
артериального давления, и в этом отношении действие их сходно с действием симпатической нервной
системы. Известно мощное регулирующее влияние этихгормонов на обмен углеводов в организме. Так, в
частности, адреналинвызывает резкое повышение уровня глюкозы в крови, что обусловленоускорением распада
гликогена в печени под действием фермента фосфорилазы. Гипергликемическйй эффект норадреналина
значительно ниже – примерно 5% от действия адреналина. Параллельно отмечаются накопление
гексозофосфатов в тканях, в частности в мышцах, уменьшение концентрации неорганического фосфата и
повышение уровня ненасыщенных жирных кислот в плазме крови. Имеются данные о торможении окисления
глюкозы в тканях под влиянием адреналина. Это действие некоторые авторы связывают с уменьшением
скорости проникновения (транспорта) глюкозы внутрь клетки. Известно, что и адреналин, и норадреналин
быстро разрушаются в организме; с мочой выделяются неактивные продукты их обмена, главным образом в
виде 3-метокси-4-оксиминдальной кислоты, оксоадренохрома, метоксинорадреналина и метоксиадреналина. Эти
метаболиты содержатся в моче преимущественно в связанной с глюкуроновой кислотой форме. Ферменты,
катализирующие указанные превращения катехоламинов, выделены из многих тканей и достаточно хорошо
изучены, в частности моноаминоксидаза (МАО), определяющая скорость биосинтеза и распада катехоламинов, и
катехолметилтрансфераза, катализирующая главный путь превращения адреналина, т.е. о-метилирование за счет
S-аденозилметионина. Приводим структуру двух конечных продуктов распада.
Глицерин –продукт метаболизма жировой
ткани, глицерин не используется адипоцитами. Глицерин утилизируют ткани, содержащие фермент
глицеролкиназу (печень, почки, слизистая кишечника, молочная железа). Глицерол-3-фосфат в клетках этих
органов может использоваться по трем направлениям: 1. окисление до конечных продуктов; 2. глюконеогенез;
синтез жиров и фосфолипидов.
|
Количественное определение пировиноградной кислоты в моче. |
Пировиноградная кислота дает с 2,4-динитрофенилгидразином фенилгидразоны, окрашенные в коричневый цвет, интенсивность которого пропорциональна содержанию пирувата. Определение проводится на ФЭКе. |
10 – 15 мг/сут. |
Повышенное выделение пирувата с мочой наблюдается при острых гепатитах, мышечной дистрофии, пневмониях. |

Гормоны коры надпочечников: глюкокортикоиды, минералокортикоиды. Химическая природа. Механизм
действия на молекулярном уровне. Их роль в регуляции углеводного, минерального, липидного и белкового
обмена.
В зависимости от характера биологического эффекта гормоны коркового вещества надпочечников
условно делят на глюкокортикоиды (кортикостероиды, оказывающие влияние на обмен углеводов, белков,
жиров и нуклеиновых кислот) и минералокортикоиды (кортикостероиды, оказывающие преимущественное
влияние на обмен солей и воды). К первым относятся кортикостерон, кортизон, гидрокортизон (кортизол), 11-
дезоксикортизол и 11-дегидрокортикостерон, ко вторым – дезоксикортикостерон и альдостерон. В основе их
структуры, так же как и в основе строения холестерина, эргостерина, желчных кислот, витаминов группы D,
половых гормонов и ряда других веществ, лежит конденсированная кольцевая система
циклопентанпергидрофенантрена. Глюкокортикоиды оказывают разностороннее влияние на обмен веществ в
разных тканях. В мышечной, лимфатической, соединительной и жировой тканях глюкокортикоиды, проявляя
катаболическое действие, вызывают снижение проницаемости клеточных мембран и соответственно
торможение поглощения глюкозы и аминокислот; в то же время в печени они оказывают противоположное
действие. Конечным итогом воздействия глюкокортикоидов является развитие гипергликемии, обусловленной
главным образом глюконеогенезом. Минералокортикоиды (дезоксикортикостерон и альдостерон) регулируют
главным образом обмен натрия, калия, хлора и воды; они способствуют удержанию ионов натрия и хлора в
организме и выведению с мочой ионов калия. По-видимому, происходит обратное всасывание ионов натрия и
хлора в канальцах почек в обмен на выведение других продуктов обмена.
Распад нуклеиновых кислот. Нуклеазы пищеварительного тракта и тканей. Биосинтез пуриновых
нуклеотидов. Источники атомов пуринового кольца. Синтез пуриновых нуклеотидов: аденина и гуанина. Распад
пуриновых нуклеотидов, образование мочевой кислоты. Нарушения обмена пуриновых нуклеотидов, подагра,
синдром Леша-Нихана.
Нуклеазы — большая группа ферментов, гидролизующих фосфодиэфирную связь между
субъединицами нуклеиновых кислот. Различают несколько типов нуклеаз в зависимости от их специфичности:
экзонуклеазы и эндонуклеазы, рибонуклеазы и дезоксирибонуклеазы, рестриктазы и некоторые другие.
Рестриктазы занимают важное положение в прикладной молекулярной биологии.
Подагра — гетерогенное по происхождению заболевание, которое характеризуется отложением в разли
чных тканях организма кристаллов уратов в форме моноурата натрия или мочевой кислоты. В основе
возникновения лежит накопление мочевой кислоты и уменьшение еѐ выделения почками, что приводит к
повышению концентрации последней в крови (гиперурикемия). Клинически подагра
проявляется рецидивирующим острым артритом и образованием подагрических узлов — тофусов. Чаще
заболевание встречается у мужчин, однако в последнее время возрастает распространѐнность заболевания среди
женщин, с возрастом распространѐнность подагры увеличивается.
Синдром Лѐша — Нихена — наследственное заболевание, характеризующееся увеличением
синтеза мочевой кислоты (у детей) вызванное дефектом фермента гипоксантин-
гуанинфосфорибозилтрансферазы, который катализирует реутилизацию гуанина и гипоксантина — в результате
образуется большее количество ксантина и, следовательно, мочевой кислоты.
Сахарная кривая.
Данный анализ проводится для исследования нарушений толерантности к глюкозе, обнаружение их в организме может говорить о ранних признаках развивающегося сахарного диабета. Благодаря данному исследованию выявляется концентрация сахара крови (на голодный желудок): за 5 минут необходимо выпить 1 стакан теплой воды с растворенной в нем глюкозой (75 грамм), затем через полчаса,1 час и через 2 часа следует проверить уровень сахара в крови.
Исследование необходимо осуществлять утром на голодный желудок (промежуток между последним приемом пищи и взятием крови должен составлять не менее 12 часов), за 1-2 дня до сдачи анализа следует исключить или значительно уменьшить потребление жирной пищи. За три дня до начала проведения теста в обязательном порядке следует соблюдать низкоуглеводную диету. В течение 24 часов до совершения анализа противопоказаны какие-либо физические нагрузки, прием лекарственных препаратов (необходимо проконсультироваться с лечащим врачом), а также алкогольной продукции. За 1-2 часа до сдачи крови следует отказаться от курения, употребления сока, чая, кофе (с сахаром тем более), в это время разрешается пить только чистую негазированную воду. За 15 минут до сдачи крови постарайтесь отдохнуть, расслабиться.
