
Химия.2.2
.docxОксокислоты —
гетерофункциональные соединения,
содержащие карбоксильную и карбонильную (альдегидную или кетонную)
группы. В зависимости от взаимного
расположения этих групп различают a -,
b -, g — и т. д. оксокарбоновые
кислоты.
Оксокислоты в природе распространены значительно меньше, чем гидроксикислоты, они редко встречаются в свободном состоянии, не накапливаются в организмах, хотя и образуются на различных стадиях биосинтеза. По поводу последнего факта нужно отметить, что в биосинтезе они играют зачастую важнейшую роль, являясь ключевыми соединениями ряда биосинтезов.
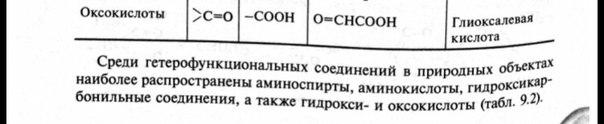
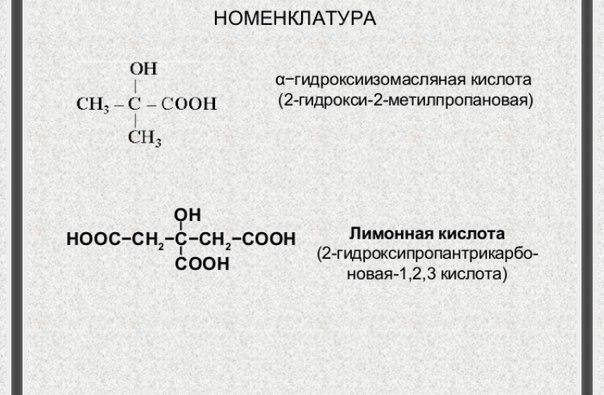
Классифицируют оксокарбоновые кислоты, как и все бифункциональные соединения, согласно взаимному расположению функциональных групп, подразделяя их при этом на альдегидо- и кетонокислоты. Многие оксокислоты носят тривиальные названия (рис.1).
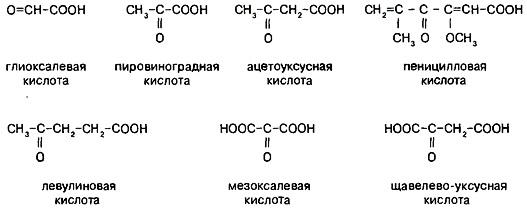 Рис.1.
Названия оксокислот
Рис.1.
Названия оксокислот
В структурном плане оксокислоты несколько более примитивны, чем оксикислоты — сказывается потеря асимметрического центра при переходе от гидроксикислот к оксокислотам. Так, при окислении любой формы молочной кислоты мы получим одну единственную пировиноградную кислоту. Но в тоже время, этот класс бифункциональных соединений отличается большим разнообразием химических реакций, химических особенностей, обязанных взаимному влиянию карбонильной и карбоксильной групп.
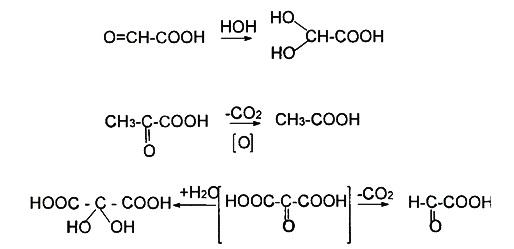 Рис.2.
Разложение мезоксолевой кислоты
Рис.2.
Разложение мезоксолевой кислоты

Пировиноградная кислота (acidum pyroracemicum) — α-кетопропионовая кислота. Существует в двух таутомерных формах — кетонной и енольной: CH3COCOOH→CH2→COHCOOH. Кетоформа (см. Кетокислоты) более стабильна. Пировиноградная кислота — бесцветная жидкость, пахнущая уксусной кислотой, d154 =1,267, t°пл 13,6°, t°кип165° (при 760 мм частично разлагается). Растворима в воде, спирте и эфире. Азотной кислотой окисляется в щавелевую, а хромовым ангидридом — в уксусную кислоту. Как кетон П. к. дает гидразон, семигидразон, оксимы, а как кислота образует сложные эфиры, амиды и соли — пируваты. Используется чаще всего в виде пируватов.

Ацетоýксусная кислота - одноосновная, первый представитель β-кетокислот, участвует в обмене веществ. Является неустойчивым соединением.
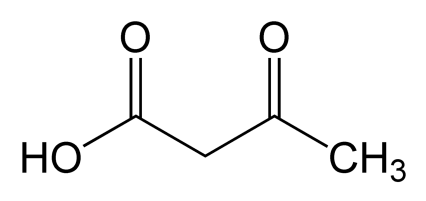
Ацетоуксусная кислота представляет собой бесцветную подвижную маслянистую жидкость, растворимую в воде во всех отношениях, а также в этаноле, диэтиловом эфире. Неустойчивая, даже при слабом нагревании (в водном растворе) распадается на ацетон и углекислый газ:
CH3C(O)CH2COOH → CH3C(O)CH3 + CO2↑.
Еще менее прочны её соли с тяжелыми металлами, разлагающиеся с образованием ацетона даже при обыкновенной температуре
Сильная кислота, pKa = 3,77.
Для ацетоуксусной кислоты характерна кето-енольная таутомерия. В результате индуктивного эффекта кетогруппы ацетоуксусная кислота является более «кислой», чем её основа - масляная кислота.
![]()
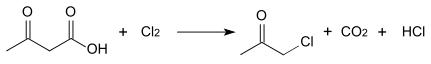
Ацетоуксусная кислота реагирует с галогенами (хлором или бромом), которые разлагают её до соответствующего галогеноводорода, углекислого газа и галоидацетона (хлор- или бромацетона):
Щаве́левая кислота (этандиовая кислота) НООССООН — двухосновная предельная карбоновая кислота. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли иэфиры щавелевой кислоты называются оксалатами. В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция. Впервые щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана. Щавелевая кислота (или оксалат-ион C2O42−) является восстановителем (обесцвечивает раствор KMnO4).
Получение
В промышленности щавелевую кислоту получают окислением углеводов, спиртов и гликолей смесью HNO3 и H2SO4 в присутствии V2O5, либо окислением этилена и ацетилена HNO3 в присутствии PdCl2 или Pd(NO3)2, а также окислением пропилена жидким NO2. Перспективен способ получения щавелевой кислоты из CO через формиат натрия:
![]()
α-кетоглутаровая (альфа-кетоглутаровая) кислота — одно из двух кетоновых производных глутаровой кислоты. Название «кетоглутаровая кислота» без дополнительных обозначений обычно означает альфа-форму. β-кетоглутаровая кислота[en]отличается только положением кетонной функциональной группы и встречается гораздо реже[1].
Анион α-кетоглутаровой кислоты, α-кетоглутарат (также называемый оксоглутарат) — важное биологическое соединение. Это кетокислота, которая образуется при дезаминировании глутамата. Альфа-кетоглутарат является одним из соединений, образущихся в цикле Кребса.
Биологическое значение
Цикл Кребса
α-кетоглутарат — ключевой продукт Кребса, образуется в результате декарбоксилирования изоцитрата и превращается всукцинил-CoA в альфа-кетоглутарат дегидрогеназном комплексе. Анаплеротические реакции могут пополнять цикл на данном этапе путём синтеза α-кетоглутарата трансаминированием глутамата, или действием глутаматдегидрогеназы на глутамат.[2]
Синтез аминокислот
Глутамин синтезируется из глутамата с помощью фермента глутаминсинтетазы, которая на первой стадии образует глутамилфосфат, используя в качестве донора фосфата АТФ; глутамин образуется в результате нуклеофильного замещения фосфата катионом аммония в глутамилфосфате, продуктами реакции являются глутамин и неорганический фосфат.[2]
Транспорт аммиака
Другой функцией альфа-кетоглутаровой кислоты является транспорт аммиака, выделяющегося в результате катаболизма аминокислот.[2]
α-кетоглутарат — один из важнейших переносчиков аммиака в метаболических путях. Аминогруппы от аминокислот прикрепляются к α-кетоглутарату в реакции трансаминирования и переносятся в печень, попадая в цикл мочевины.
В случае б-оксокислот можно отметить легкость присоединения нуклео-фильных реагентов по карбонильной группе и легкость реакций декарбоксилирования — пировиноградная кислота в условиях окислительного ферментатив-но катализируемого декарбоксилиро-вания образует уксусную кислоту. Мезоксалевая кислота сочетает в себе легкость протекания обоих этих процессов — она существует только в виде гидратированного аддукта и в водном растворе легко разлагается на глиоксалевую кислоту и двуокись углерода (рис.2).
Пировиноградную кислоту следует выделить из всех б-оксокислот еще и как источник весьма существенных биологически активных соединений, получаемых in vivo в результате реакции нуклеофильного присоединения по карбонильной группе и последующих преобразований. С таким реагентом как аммиак, она в несколько стадий, включая еще реакции дегидратации и восстановления, образует важную б-аминокислоту аланин; а при взаимодействии с тиолом ферментной природы, коферментом-А, через стадии присоединения, декарбоксили-рования и восстановления, образует ацетилированный кофермент-А — важнейший интермедиат многих биосинтетических реакций.
В случае в-кетокислот, на примере ацетоуксусного эфира, мы наблюдаем интереснейшее явление двойственной реакционной способности, называемое таутомерией. Применительно к указанному классу соединений, это явление названо кето-енольной таутомерией. Суть данного явления заключается в следующем: карбонильная и карбоксильная функции, будучи сильными электроноакцепторами, оголяют протоны метиленовой группы, расположенной между ними, что делает их кислыми. В силу этого водород в виде катиона может мигрировать к карбонильному кислороду несущему на себе избыточную электронную плотность; синхронно этому переходу электронная плотность карбонильной группы и у-связей метиленового фрагмента перераспределяется так, как это указано на рис.3, образуя систему енола.
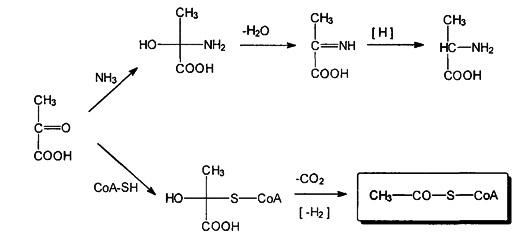 Рис.3.
Образование системы енола
Рис.3.
Образование системы енола
Процесс является обратимым, поскольку гидроксил при тригональном углероде всегда достаточно кислый и его протон может осуществлять, в свою очередь, электрофильную атаку по С=С связи. Оба эти процесса совершаются столь медленно, что тау-томеры могут быть разделены либо кристаллизацией, либо фракционной перегонкой Но через некоторое время индивидуальные изомеры при стоянии снова превращаются в равновесную смесь соединений кетонной и енольной структуры Таким образом, ацетоуксусный эфир, кроме свойств кетонов и сложных эфиров, обнаруживает еще свойства непредельных соединений, спиртов и фенолов, так как гидроксил при двойной связи ведет себя так же, как и при ароматическом кольце
Следует отметить, что кето-енольная таутомерия проявляется и в свойствах вышеописанной пировиноградной кислоты, и хотя доля енольной формы у нее незначительна, в реакциях она реализуется часто как основная (рис.4).
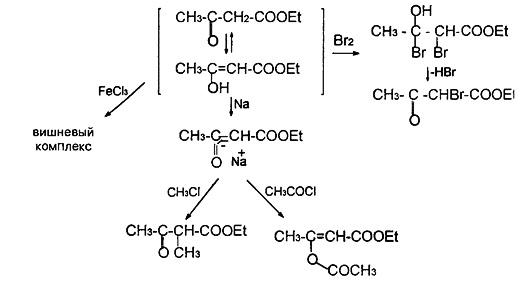 Рис.4.
Проявление кето-енольной тауметрии
Рис.4.
Проявление кето-енольной тауметрии
Для α- и β- оксокислот характерны как кето-енольная, так и кольчато-цепная таутомерия.
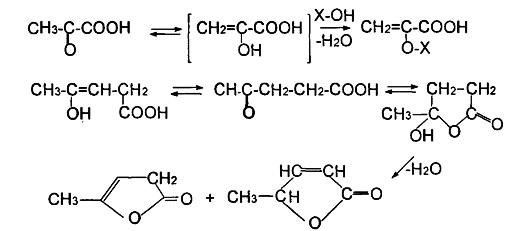 Рис.5.
Образование γ-лактонов
Рис.5.
Образование γ-лактонов
Результатом последней, в случае левулиновой кислоты, является гидроксилактон, наиболее устойчивая таутомерная форма этого соединения, которая достаточно легко отщепляет воду в присутствии водоотнимающих агентов, образуя непредельные γ-лактоны (рис.5).
