
- •Министерство образования и науки Российской Федерации
- •Редкие элементы ia подгруппы. Общая характеристика элементов
- •Свойства элементов iа подгруппы
- •2. Литий
- •2.1. Химия лития
- •2.1.1. Соединения лития с кислородом
- •Свойства гидроксидов щелочных металлов
- •2.1.2. Галогениды лития
- •Свойства галогенидов лития
- •2.1.3. Соединения лития с другими элементами
- •2.1.4. Сплавы лития с металлами
- •2.2. Важнейшие области применения лития и его соединений
- •2.3. Геохимия лития и сырьевые источники
- •2.3.1. Минералы лития
- •2.3.2. Извлечение лития из солевых растворов
- •Характеристика лгмс наиболее известных месторождений мира
- •2.4. Технология переработки литиевого сырья
- •2.4.1. Обогащение литиевого рудного сырья
- •2.4.2. Общие вопросы технологии лития
- •2.4.3. Переработка сподумена
- •2.4.4. Переработка лепидолита
- •2.4.5. Переработка карбоната лития на гидроксид и хлорид
- •2.5. Получение металлического лития
- •Рекомендуемая литература
2.1.3. Соединения лития с другими элементами
Гидрид лития, LiH, – бесцветное кристаллическое вещество с кубической гранецентрированной решеткой (ГЦК) типа NaCl (a = 4,083 Ǻ); ΔH = 181,4 кДж/моль. LiH – единственное известное соединение лития с водородом. Молекулы LiH по характеру химической связи приближаются к типу ионных соединений Li+H–. В отсутствие воздуха плавится без разложения при 680-700 ºC; интенсивное разложение LiH начинается выше температуры плавления, в вакууме сублимация начинается при 220 ºC. С водой LiH бурно реагирует, образуя LiOH и выделяя водород:
LiH + H2O → LiOH + H2↑ (14)
При разложении 1кг LiH выделяется 2,8 м3водорода. Это определило широкое применение гидрида лития в качестве источника простого и быстрого получения водорода для наполнения аэростатов и морского спасательного снаряжения (надувные лодки, спасательные пояса, воздушные шары). С жидким аммиаком при комнатной температуре (с газообразным при 440- 460 ºC) LiH образует амид:
LiH + NH3↔LiNH2+ H2O (15)
При нагревании LiH с азотом образуются нитрид лития и аммиак:
LiH + N2↔Li3N + NH3(16)
С кислородом LiH реагирует только при температуре каления. Гидрид лития обладает восстановительными свойствами, легко восстанавливает оксиды, сульфиды, хлориды, склонен к образованию двойных гидридов, наибольший интерес из которых представляют алюмогидрид (LiAlH4) и боргидрид лития (LiBH4). Для получения LiAlH4используют реакцию
4 LiH + AlCl3↔3LiCl + LiAlH4(17)
которая протекает в эфирном растворе при температуре 0 ÷ –4 ºC. Соединение используется в органическом синтезе. Как гидрирующий агент и как восстановитель боргидрид лития может быть использован в качестве аккумулятора водорода наряду с LiH, при этом количество водорода, выделяющееся при его гидролизе, больше, чем у LiH.
В промышленности LiH получают непосредственным гидрированием расплавленного лития водородом:
Li + ½ H2↔LiH (18)
Реакция начинается при 500 ºC, оптимальная температура 680-700 ºC. Используется и метод восстановления оксида лития (Li2O) или гидроксида (LiOH) алюминием или магнием под небольшим давлением водорода.
Н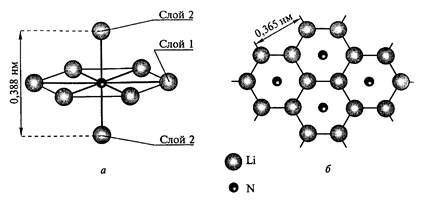 итрид
лития, Li3N, – кристаллическое
вещество, в проходящем свете имеет
рубиновую окраску, в отражающем –
зеленовато-черную и металлический
блеск. Li3N имеет гексагональную
решетку (a = 3,658; c = 3,882 kX); плотность (20 ºC)
= 1, 38 г/см3, Тпл.– 845 ºC (данные
противоречивы), энтальпия образования
ΔH = –47,5 кДж/моль. Нитрид лития имеет
сложную слоистую структуру (рис. 7).
итрид
лития, Li3N, – кристаллическое
вещество, в проходящем свете имеет
рубиновую окраску, в отражающем –
зеленовато-черную и металлический
блеск. Li3N имеет гексагональную
решетку (a = 3,658; c = 3,882 kX); плотность (20 ºC)
= 1, 38 г/см3, Тпл.– 845 ºC (данные
противоречивы), энтальпия образования
ΔH = –47,5 кДж/моль. Нитрид лития имеет
сложную слоистую структуру (рис. 7).
Рис. 7. Структура кристаллического нитрида лития. а – чередующиеся слои ионов Na+(слой 1) и Li+ (слой 2); б – строение слоя 1 (вид сверху)
Нитрид лития – соединение неустойчивое, водой энергично разлагается:
Li3N + H2O → 3LiOH + NH3 (19)
в атмосфере водорода переходит в гидрид, LiH:
Li3N+ 3H2→3LiH + NH3(20)
Нитрид лития образуется пи непосредственном взаимодействии лития с азотом во влажном воздухе при комнатной температуре, одновременно с окислением металла. При этом нитрида получается примерно в три раза больше, чем Li2O, который переходит в LiOH и далее в Li2CO3. При повышении температуры до 250 ºC реакция ускоряется. Для получения нитрида лития используют реакцию взаимодействия лития с сухим азотом при 350-450 ºC. Нитрид лития обладает высокой ионной проводимостью, что, безусловно, связано с его строением.
