
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
511
Аминокислоты обладают специфическими свойствами, обусловленными взаим-
ным влиянием карбоксильной и аминогрупп.
Отношение аминокислот к нагреванию. При нагревании - - - и -аминокис-
лот образуются разные продукты.
-Аминокислоты при нагревании претерпевают межмолекулярную дегидратацию, образуя при этом циклический диамид — дикетопиперазин:
-Аминокислоты при нагревании отщепляют молекулу аммиака, образуя
-ненасыщенные кислоты:
- и -Аминокислоты при нагревании претерпевают внутримолекулярную дегидратацию, образуя циклические амиды — лактамы:
Взаимодействие α-аминокислот с нингидрином. При действии нингидрина на
-аминокислоты образуется краситель сине-фиолетового цвета. реакция протекает в две стадии. на первой стадии под действием нингидрина происходит окислительное дезаминирование аминокислоты и ее декарбоксилирование. на второй стадии реакции образовавшийся аммиак реагирует с эквимолекулярными количествами обычного и восстановленного нингидрина, образуя краситель сине-фиолетового цвета (синий руэмана):

Глава 27
512
нингидриновая реакция используется для качественного определения -амино- кислот.
27.4.4. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
аминоуксусная кислота (аминоэтановая кислота, гликокол, H2NCH2COOH глицин). белое кристаллическое вещество (т. пл. 232—236 °с с разложением), хорошо растворяется в воде, не растворяется в большинстве органических растворителей. в составе белков встречается чаще, чем другие -ами- нокислоты.
аминоуксусная кислота (глицин, глицисед) применяется в медицине как метаболическое средство при ухудшении памяти, умственной отсталости у детей, старческом слабоумии, алкоголизме и т. д.).
γ-аминомасляная кислота (4-аминобутановая кисло- H2NCH2CH2CH2COOH та, ГаМк). белое кристаллическое вещество (т. пл.
202 °с), хорошо растворяется в воде. ГаМк образуется в живых организмах при декарбоксилировании глутаминовой кислоты. является нейромедиатором, принимающим участие в обменных процессах головного мозга.
-аминомасляная кислота (аминалон) применяется в медицине для лечения нервно-психических заболеваний, при ослаблении памяти, нарушениях мозгового кровообращения и др. ГаМк широко используют в синтезе лекарственных препаратов (пирацетам, фенибут и др.).
H2NCH2CH2CH2CH2CH2COOH |
ε-аминокапроновая кислота (6-аминогекса- |
новая кислота). белое кристаллическое вещест- |
во (т. пл. 372 °с), легко растворяется в воде.
Применяется в медицине в качестве кровоостанавливающего средства (ингибитор фибринолиза).
антраниловая кислота ( о-аминобензойная кислота). белое кристаллическое вещество (т. пл. 145 °с), практически не растворяется в воде.
антраниловую кислоту используют в производстве красителей и лекарственных средств. на основе антраниловой кислоты создан один из эффективнейших нестероидных противовоспалительных препара-
тов — мефенамовая кислота.

ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
513
п-аминобензойная кислота (Пабк). белое кристалли-
ческое вещество (т. пл. 186 °с), малорастворимо в воде. входит в состав фолиевой кислоты, выполняющей роль
ростового фактора для некоторых микроорганизмов.
сложные эфиры п-аминобензойной кислоты широко применяются в медицине в качестве местноанестезирующих средств: анестезин (этиловый эфир п-аминобензойной кислоты), новокаин -диэтиламиноэтилового эфира п-амино- бензойной кислоты гидрохлорид) и др.:
27.5. иденТиФиКациЯ геТерОФунКциОналЬныХ КарБОнОвыХ КислОТ
химические методы. химические методы идентификации замещенных карбоновых кислот сводятся к доказательству наличия соответствующих функциональных групп. так, присутствие карбоксильной группы может быть доказано по образованию солей, сложных эфиров, амидов.
атом галогена в галогенокарбоновых кислотах определяют реакцией с серебра нитратом AgNO3 после сплавления вещества с натрием.
для определения спиртовой группы в гидроксикислотах используется реакция этерификации или дегидратации при нагревании. -Гидроксикислоты при нагревании образуют труднорастворимые в воде лактиды. -Гидроксикислоты при кипячении с 10 %-ным раствором натрия гидроксида образуют непредельные кислоты, в которых наличие двойной связи определяют известными методами.-Гидроксикислоты легко образуют лактоны, которые восстанавливают лития алюмогидридом LiAlH4 до двухатомных спиртов, легко поддающихся идентификации.
Подобно фенолам, фенолокислоты дают с железа (III) хлоридом фиолетовое окрашивание.
карбонильную группу в оксокислотах определяют по ее способности образовывать нерастворимые кристаллические осадки с гидроксиламином, гидразинами, семикарбазидом и тиосемикарбазидом.
с целью идентификации -аминокислот используют нингидриновую реакцию. Физические методы. введение галогена в -положение карбоновой кислоты смещает полосу валентных колебаний карбонильной группы в ик-спектре в сто-
рону более высоких частот на 10—20 см–1.
из-за образования внутримолекулярной водородной связи поглощение карбонильной группы в -гидроксикислотах смещено в сторону низких частот.
Поскольку -аминокислоты существуют в виде внутренних солей, для них в ик-спектрах характерна широкая сильная полоса
 в области 3100—2600 см–1, а также слабая полоса
в области 3100—2600 см–1, а также слабая полоса 
 при 1550—1485 см–1. карбоксилат-анион имеет сильную полосу поглощения в области 1590 см–1 и слабую — при 1400 см–1. Эти полосы связаны с асимметричными и симметричными валентными колебаниями связи C–O.
при 1550—1485 см–1. карбоксилат-анион имеет сильную полосу поглощения в области 1590 см–1 и слабую — при 1400 см–1. Эти полосы связаны с асимметричными и симметричными валентными колебаниями связи C–O.

глава 28
ПрОиЗвОдные угОлЬнОЙ КислОТы
Угольная кислота является неустойчивым соединением, которое легко разлагается на углерода (IV) оксид и воду. формально угольную кислоту можно рассматривать как двухосновную
карбоновую кислоту.
угольная кислота как двухосновная образует два ряда функциональных про-
изводных — неполные и полные галогенангидриды, сложные эфиры, амиды, а также смешанные функциональные производные — эфиры хлоругольной кислоты, эфиры карбаминовой кислоты (уретаны) и др.
28.1. ХлОрангидриды угОлЬнОЙ КислОТы
теоретически для угольной, как двухосновной дикарбоновой кислоты, можно предположить существование двух типов хлорангидридов — неполного (монохлорангидрида) и полного (дихлорангидрида). Монохлорангидрид получил название
«хлоругольная (хлормуравьиная) кислота», а дихлорангидрид — «фосген»:

ПрОИЗВОДнЫе УГОлЬнОЙ КИСлОТЫ
515
хлоругольная кислота в свободном состоянии не существует. в момент образования она распадается на углерода (IV) оксид и хлороводород. однако эфиры хлоругольной кислоты являются довольно устойчивыми соединениями.
дихлорангидрид угольной кислоты (фосген) в обычных условиях представляет собой газообразное вещество с запахом прелого сена, тяжелее воздуха в 3—4 раза, малорастворим в воде. фосген очень ядовит. При вдыхании вызывает отек легких. в Первую мировую войну применялся как боевое отравляющее вещество.
Получают фосген взаимодействием углерода (II) оксида с хлором на свету:
в химическом отношении фосген проявляет свойства галогенангидридов карбоновых кислот. так, в присутствии воды фосген медленно гидролизуется с образованием углерода (IV) оксида и хлороводорода:
с эквимолярными количествами спиртов фосген образует эфиры хлоругольной кислоты:
Эфиры хлоругольной кислоты представляют собой жидкости с удушливым запахом, вызывают слезотечение. они содержат в своей структуре подвижный атом хлора, что позволяет широко использовать их в органическом синтезе. в химическом отношении они проявляют свойства галогенангидридов и сложных эфиров.
в присутствии избытка спирта или алкоголята фосген образует полный эфир угольной кислоты:
При действии на фосген аммиака атомы хлора замещаются на аминогруппы,
иобразуется диамид угольной кислоты — карбамид (мочевина):
впромышленности фосген используется в синтезе лекарственных средств, а также для получения красителей, пластмасс и др.

Глава 28
51
28.2. аМиды угОлЬнОЙ КислОТы
угольной кислоте соответствует два амида — неполный (моноамид) и полный (диамид). неполный амид называется карбаминовая кислота, а полный — моче-
вина, или карбамид.
карбаминовая кислота в свободном состоянии не известна, однако ее соли и эфиры являются довольно устойчивыми соединениями.
Эфиры карбаминовой кислоты называют уретанами.
уретаны получают действием аммиака на эфиры хлоругольной кислоты или диэфиры угольной кислоты:
Уретаны — бесцветные кристаллические вещества, проявляющие свойства амидов и сложных эфиров. в поисках центральных миорелаксантов был синтезирован мепротан (мепробамат), который принято считать «родоначальником малых транквилизаторов». обладает снотворным и транквилизирующим действием.
особый интерес представляет диамид угольной кислоты — мочевина. Мочевина является конечным продуктом распада белков, содержится в моче человека (около 2 %), откуда и была впервые выделена.
синтетически получена в 1828 году немецким химиком фридрихом вёлером при упаривании водного раствора аммония цианата, который в этих условиях подвергается изомеризации:

ПрОИЗВОДнЫе УГОлЬнОЙ КИСлОТЫ
517
в промышленности мочевину получают в больших количествах взаимодействием аммиака с углерода (IV) оксидом:
Мочевина — белое кристаллическое вещество (т. пл. 133 °с), хорошо растворяется в воде.
вхимическом отношении мочевина проявляет свойства амидов. однако в от-
личие от амидов алифатических и ароматических карбоновых кислот у мочевины более выражены нуклеофильные и основные свойства. Это связано с тем, что в ее молекуле при карбонильной группе расположены две аминогруппы:
врезультате сопряжения неподеленных пар электронов атомов азота аминогрупп с -электронами кратной связи (+М-эффект) основным центром в молекуле мочевины является атом кислорода.
с сильными кислотами мочевина образует соли. так, при действии на мочевину азотной кислоты образуется малорастворимый в воде мочевины нитрат:
вводных растворах кислот или щелочей при нагревании мочевина легко гидролизуется с образованием углерода (IV) оксида и аммиака:
Проявляя нуклеофильные свойства, мочевина вступает в реакции с электрофильными реагентами — галогеналканами и галогенангидридами карбоновых кислот, образуя соответственно алкилмочевины и ацилмочевины:
N-ацильные производные мочевины называют уреидами.
уреиды некоторых карбоновых кислот используются в медицине. так, уреид-бромизовалериановой кислоты (бромизовал) применяется в качестве снотворного средства:



Глава 28
520
как и мочевина, гуанидин легко вступает в реакции алкилирования с галогеналканами и ацилирования со сложными эфирами карбоновых кислот.
При конденсации с бифункциональными соединениями (диэфирами, дикетонами) гуанидин образует гетероциклические соединения:
остаток гуанидина является структурным фрагментом нуклеинового основания гуанина, содержится в структуре аминокислоты аргинина, антибиотика стреп-
томицина и др.:





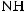

 лежит в основе ряда пре-
лежит в основе ряда пре-