
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf

Глава 26
472
сложноэфирная конденсация применяется для промышленного получения ацетоуксусного эфира. если конденсации подвергаются два разных сложных эфира, каждый из которых содержит -атом водорода, в процессе реакции образуется смесь четырех возможных продуктов.
2 .3.5. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
Этилформиат HCOOC2H5. бесцветная жидкость (т. кип. 54,3 °с), растворима в этаноле, эфире, малорастворима в воде.
используют этилформиат в производстве витамина B1, а также как отдушку для мыла и компонент фруктовых эссенций.
Этилацетат CH3COOC2H5. бесцветная жидкость с приятным запахом (т. кип. 77,1 °с), малорастворима в воде, растворяется в органических растворителях.
Применяется в качестве растворителя эфиров целлюлозы, хлоркаучука, виниловых полимеров, жиров, восков. используется для получения ацетоуксусного эфира, как отдушка для мыла в парфюмерии, входит в состав пищевых эссенций.
Бензилбензоат C6H5COOCH2C6H5. Жидкость светло-желтого цвета (т. кип. 323—324 °с), нерастворима в воде, растворяется в этаноле.
содержится во многих эфирных маслах, перуанском бальзаме. оказывает токсическое действие на чесоточных клещей и применяется для лечения чесотки.
26.4. аМиды КарБОнОвыХ КислОТ
Амидами называют производные карбоновых кислот, в которых гидроксильная группа, входящая в состав карбоксильной группы, замещена на аминогруппу.
их можно также рассматривать как ацильные производные аммиака, первичных и вторичных аминов.


Глава 26
474
Гидролиз нитрилов. При гидролизе нитрилов образуются либо амиды (частичный гидролиз), либо карбоновые кислоты (полный гидролиз). для получения амидов гидролиз осуществляют действием 96 %-ной серной кислоты или щелочных растворов водорода пероксида:
2 .4.3. ФИЗИЧеСКИе СВОЙСТВа
амиды карбоновых кислот представляют собой кристаллические вещества или жидкости, растворимые в воде и органических растворителях. соединения, содержащие в молекуле связи N—H, образуют прочные межмолекулярные водородные связи и имеют более высокие по сравнению с карбоновыми кислотами температуры плавления и кипения.
2 .4.4. хИмИЧеСКИе СВОЙСТВа
реакционная способность амидов обусловлена наличием в их структуре амид-
ной группировки |
|
. По электронному строению амидная группа сходна |
|
с карбоксильной. неподеленная пара электронов атома азота находится в сопряжении с -электронами карбонильной группы (р, -сопряжение). в результате сопряжения связь C—N становится короче, а связь C=O — несколько длиннее по сравнению с несопряженными соединениями. за счет сильного смещения неподеленной пары электронов атома азота (+M-эффект) к группе C=O частичный положительный заряд на атоме углерода карбонильной группы в амидах меньше, чем у галогенангидридов, ангидридов и сложных эфиров:
вследствие такого электронного строения амиды карбоновых кислот практически не вступают в реакции с нуклеофильными реагентами и, в отличие от аминов, являются очень слабыми основаниями. амиды, имеющие в своей структуре связь N—H, являются слабыми NH-кислотами.
Кислотно-основные свойства. как слабые основания, амиды образуют соли лишь с сильными минеральными кислотами, причем протонированию подвергаются атом кислорода карбонильной группы, так как образующийся при этом катион стабилизируется за счет сопряжения:


Глава 26
47
Гипогалогенитная реакция Гофмана. реакция амидов со щелочными раство-
рами галогенов (йода, брома или хлора) известна как реакция Гофмана, или перегруппировка Гофмана (1881 г.). реакция протекает с амидами как жирных, так и ароматических кислот. Позволяет получить первичные амины, содержащие на один атом углерода меньше, чем в исходном амиде.
Восстановление. Под действием лития алюмогидрида LiAlH4 амиды карбоновых кислот восстанавливаются до аминов:
N-замещенные амиды восстанавливают до вторичных или третичных аминов.
2 .4.5. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
Формамид HCONH2. бесцветная жидкость (т. кип. 210,5 °с), растворяется в воде и спиртах.
используют в качестве растворителя и реагента в органическом синтезе. N,N-Диметилформамид (дМфа) HCON(CH3)2. бесцветная жидкость со сла-
бым запахом (т. кип. 153 °с), смешивается с водой и спиртами. N,N-диметилформамид широко применяют в качестве апротонного рас-
творителя в производстве синтетических волокон, лакокрасочных материалов, искусственной кожи и др. используют как реакционную среду, обладающую каталитическими свойствами при галогенировании и гидрогалогенировании непредельных соединений; в качестве реагента для введения формильной группы; в фармацевтической промышленности для очистки лекарственных препаратов.
26.5. гидраЗиды КарБОнОвыХ КислОТ
Гидразидами называют функциональные производные карбоновых кислот, в которых гидроксильная группа, входящая в состав карбоксильной группы, замещена на остаток молекулы гидразина, алкилили арилгидразинов.
общая формула гидразидов карбоновых кислот:

ФУнКЦИОналЬнЫе ПрОИЗВОДнЫе КарБОнОВЫх КИСлОТ
477
2 .5.1. нОменКлаТУра
название гидразидов чаще образуют из названий соответствующих карбоновых кислот и гидразинов. По заместительной номенклатуре IUPAC названия гидразидов составляют путем замены суффикса -овая кислота на суффикс -гид-
разид:
2 .5.2. СПОСОБЫ ПОлУЧенИя
Гидразиды карбоновых кислот получают взаимодействием гидразина, алкилили арилгидразинов с галогенангидридами, ангидридами или сложными эфирами карбоновых кислот. в качестве побочных продуктов при этом могут образоваться N, N΄-диацилгидразины:
2 .5.3. хИмИЧеСКИе СВОЙСТВа
По химическим свойствам гидразиды карбоновых кислот во многом напоминают амиды. вместе с тем в молекуле гидразидов неподеленная пара электронов-атома азота не участвует в сопряжении с карбонильной группой.

Глава 26
478
за счет этого гидразиды проявляют основные и нуклеофильные свойства. они образуют соли с минеральными кислотами, вступают в реакцию ацилирования с галогенангидридами и ангидридами карбоновых кислот, реагируют с карбонильными соединениями, взаимодействуют с азотистой кислотой:
Гидразиды карбоновых кислот находят широкое применение в органическом синтезе, в том числе и синтезе лекарственных препаратов.
26.6. ниТрилы (цианиды)
Нитрилами называют органические соединения, содержащие одну или несколько цианогрупп 


 , связанных с углеводородным радикалом.
, связанных с углеводородным радикалом.
от других функциональных производных карбоновых кислот нитрилы отличаются отсутствием карбонильной группы.
общая формула нитрилов: 


 .
.
2 . .1. нОменКлаТУра
названия нитрилов образуют из тривиальных названий ацильных остатков карбоновых кислот или систематических названий карбоновых кислот с аналогичным числом атомов углерода, включая атом углерода группы 


 , к которым добавляется суффикс -нитрил:
, к которым добавляется суффикс -нитрил:

ФУнКЦИОналЬнЫе ПрОИЗВОДнЫе КарБОнОВЫх КИСлОТ
47
2 . .2. СПОСОБЫ ПОлУЧенИя Дегидратация амидов (см. с. 475):
Взаимодействие галогеналканов с цианидами щелочных металлов (см. с. 262):
так как цианид-ион является амбидентным ионом, в качестве побочного продукта реакции образуются изонитрилы, которые удаляют из реакционной среды путем добавления разведенной хлороводородной кислоты.
Дегидратация альдоксимов. При взаимодействии альдегидов с гидроксиламином образуются альдоксимы, которые в присутствии минеральных кислот подвергаются дегидратации, образуя нитрилы:
2 . .3. хИмИЧеСКИе СВОЙСТВа
реакционная способность нитрилов обусловлена наличием в их структуре цианогруппы 


 . цианогруппа имеет линейное строение, атомы углерода и азота находятся в sp-гибридизации и образуют между собой полярную тройную связь, электронная плотность которой смещена к атому азота. Проявляя отрицательный индуктивный эффект, цианогруппа смещает на себя электронную плотность с углеводородного радикала и тем самым увеличивает подвижность атомов водорода при -углеродном атоме (сн-кислотность). По месту разрыва тройной связи нитрилы вступают в реакции нуклеофильного присоединения, за счет -уг- леродных атомов для них характерны реакции конденсации:
. цианогруппа имеет линейное строение, атомы углерода и азота находятся в sp-гибридизации и образуют между собой полярную тройную связь, электронная плотность которой смещена к атому азота. Проявляя отрицательный индуктивный эффект, цианогруппа смещает на себя электронную плотность с углеводородного радикала и тем самым увеличивает подвижность атомов водорода при -углеродном атоме (сн-кислотность). По месту разрыва тройной связи нитрилы вступают в реакции нуклеофильного присоединения, за счет -уг- леродных атомов для них характерны реакции конденсации:

Глава 26
480
Гидролиз нитрилов. При нагревании с водными растворами кислот или щелочей нитрилы подвергаются гидролизу с образованием карбоновых кислот. Гидролиз идет в две стадии. вначале по месту разрыва кратной связи присоединяется одна молекула воды, в результате чего образуются амиды, которые могут быть выделены в индивидуальном состоянии. дальнейший гидролиз амидов приводит к карбоновым кислотам:
Восстановление. При восстановлении нитрилов лития алюмогидридом LiAlH4 или водородом в присутствии катализатора образуются первичные амины:
Конденсация нитрилов (реакция Торпа). в присутствии оснований, таких как алкоксиды или амиды металлов (C2H5ONa, NaNH2 и др.), нитрилы подвергаются конденсации с образованием -иминонитрилов. реакция аналогична альдольной конденсации (см. c. 402), тo есть происходит присоединение -атома углерода одной молекулы нитрила к атому углерода группы 


 другой молекулы:
другой молекулы:
2 . .4. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
ацетонитрил 


 . бесцветная жидкость (т. кип. 81,6 °с), хорошо смешивается с водой и многими органическими растворителями.
. бесцветная жидкость (т. кип. 81,6 °с), хорошо смешивается с водой и многими органическими растворителями.
ацетонитрил применяется в качестве растворителя для выделения жирных кислот из растительных и животных масел, используется в производстве витами-
на B1.
акрилонитрил 


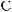

 . бесцветная жидкость (т. кип. 77,3 °с), растворяется в воде и многих органических растворителях.
. бесцветная жидкость (т. кип. 77,3 °с), растворяется в воде и многих органических растворителях.
используют в производстве синтетического волокна (нитрон), бутадиен-нит- рильного каучука и др. широко применяется в органическом синтезе.
малонодинитрил 




 . белое кристаллическое вещество (т. пл. 32 °с), малорастворим в воде, растворяется в органических растворителях. Ма-
. белое кристаллическое вещество (т. пл. 32 °с), малорастворим в воде, растворяется в органических растворителях. Ма-
