
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
алЬДеГИДЫ. КеТОнЫ
411
как карбонильные соединения непредельные альдегиды взаимодействуют с циановодородной кислотой с образованием циангидринов:
наличие сопряженной системы в молеку- |
|
|||||||||||||||||||
ле кротонового альдегида приводит к повы- |
Герман христиан ФелИнГ |
|||||||||||||||||||
шенной подвижности атомов водорода ме- |
(1812—1885) |
|||||||||||||||||||
тильной группы, благодаря чему он способен |
немецкий химик-органик и тех- |
|||||||||||||||||||
вступать в реакции кротоновой конденса- |
нолог. ученик ю. либиха. работал |
|||||||||||||||||||
ции: |
фармацевтом в любеке и бремене. |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Профессор (1839—1882) высшей тех- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нической школы в штутгарте. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
основное направление научных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
исследований — анализ и иденти- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фикация органических соединений. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изучал многоосновные органические |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислоты. впервые получил паральде- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гид (1838), бензонитрил и сукцин- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
имид (1844). синтезировал (1844) бен- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зойную кислоту в результате гидроли- |
образовавшийся сорбиновый альдегид |
за бензонитрила. Предложил (1850) |
|||||||||||||||||||
способен вступать в реакцию с новой моле- |
реактив для определения моносахари- |
|||||||||||||||||||
дов (реактив фелинга). изучал мине- |
||||||||||||||||||||
кулой уксусного альдегида, поэтому в про- |
ральные воды, дубильные вещества, |
|||||||||||||||||||
цессе реакции образуется смесь непредель- |
процесс хлебопечения. |
|||||||||||||||||||
ных альдегидов. |
|
|||||||||||||||||||
акролеин и кротоновый альдегид ис- |
|
|||||||||||||||||||
пользуются в синтезе ряда соединений, в том |
|
|||||||||||||||||||
числе и лекарственных препаратов. |
|
|||||||||||||||||||
23.3. диалЬдегиды. диКеТОны
соединения, содержащие две альдегидные группы, относят к диальдегидам, две кетогруппы — к дикетонам. Простейшим представителем диальдегидов является глиоксаль или этандиаль, а дикетонов — диацетил или бутандион:

Глава 23
412
Глиоксаль — кристаллическое вещество, диацетил — жидкость. оба вещества окрашены в желтый цвет.
и глиоксаль, и диацетил могут быть получены при осторожном окислении соответствующих двухатомных спиртов — этиленгликоля и 2,3-бутандиола. они обладают характерными для карбонильных соединений свойствами. реакции могут протекать как при участии одной, так и двух функциональных групп.
При окислении глиоксаля образуется щавелевая кислота:
вусловиях реакции канниццаро глиоксаль превращается в гликолевую кислоту, то есть происходит внутримолекулярная реакция окисления-восстановле- ния:
взависимости от соотношения реагентов глиоксаль и диацетил при взаимодействии с гидроксиламином образуют моноили диоксимы:

алЬДеГИДЫ. КеТОнЫ
413
способность диметилглиоксима образовывать внутрикомлексные соединения с рядом катионов используется в аналитической практике. с солями никеля диметилглиоксим образует красно-фиолетовый осадок хелатного комплекса.
Глиоксаль и диацетил используются в синтезе различных гетероциклов. диацетил содержится в сливочном масле и обусловливает его запах. Применяют в пищевой промышленности как ароматизирующее средство для масла, маргарина, сыра.
23.4. арОМаТиЧесКие алЬдегиды и КеТОны
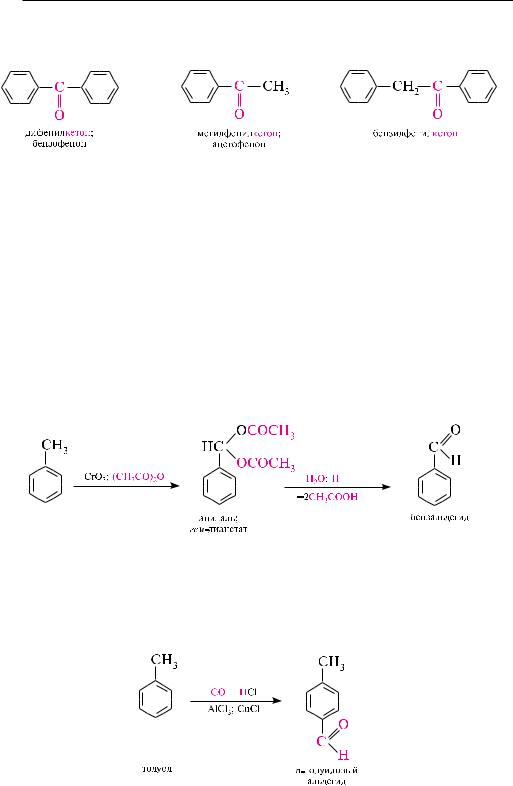
23.4.1. КлаССИФИКаЦИя. нОменКлаТУра
в ряду ароматических альдегидов выделяют альдегиды, содержащие альдегид-
ную группу в бензольном ядре (аренкарбальдегиды) и содержащие альдегидную группу в боковой цепи. Простейшим представителем первой группы является бензальдегид или бензойный альдегид, получивший название от кислоты, в которую он превращается при окислении.
альдегиды, содержащие функциональную группу в боковой цепи, называют как производные альдегидов жирного ряда. Положение фенильного радикала обычно указывают буквами греческого алфавита:
в ряду ароматических кетонов выделяют чисто ароматические и жирно-арома- тические кетоны. в молекуле чисто ароматических кетонов карбонильная группа связана с двумя ароматическими радикалами. если один из радикалов алифати-
Глава 23
414
ческий, то такие кетоны относят к жирно-ароматическим. для названий ароматических кетонов чаще используют радикало-функциональную номенклатуру (см. с. 392). широко применяют также тривиальные названия:
23.4.2. СПОСОБЫ ПОлУЧенИя
Методы синтеза ароматических и алифатических альдегидов и кетонов во многом схожи. для получения ароматических карбонилсодержащих соединений используют: окисление первичных и вторичных ароматических спиртов, омыление геминальных дигалогенопроизводных углеводородов, пиролиз кальциевых солей карбоновых кислот и другие способы. существует ряд специфических методов для синтеза ароматических альдегидов и кетонов.
Окисление ароматических углеводородов. Прямое окисление толуола или других производных, содержащих метильную группу, связанную с бензольным кольцом (метиларенов), приводит к соответствующим альдегидам. в качестве окислителей могут быть использованы хрома (VI) оксид, ванадия (V) оксид, марганца (IV) оксид и др. окисление хрома (VI) оксидом проводят в среде уксусного ангидрида. образующийся в процессе окисления ацилаль (сложный эфир гидратной формы альдегида) не подвергается дальнейшему окислению, а в результате его последующего гидролиза с хорошим выходом получают альдегид:
окисление ароматических углеводородов с целью получения альдегидов используется не только в химической лаборатории, но и в промышленности.
реакция Гаттермана — Коха. Метод основан на прямом введении альдегидной группы в бензольное ядро. данную реакцию также называют реакцией формилирования. формилирование ароматических углеводородов проводят смесью углерода (II) оксида и хлороводорода в присутствии алюминия хлорида и меди (I) хлорида:

алЬДеГИДЫ. КеТОнЫ |
|
|
|
415 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакция осуществляется только со срав- |
|
|
|
||||||||||
|
|
|
|
||||||||||
нительно активными аренами, используется |
|
|
|
|
|||||||||
для получения алкил- и галогенозамещен- |
|
|
|
|
|||||||||
ных ароматических альдегидов. бензальде- |
|
|
|
|
|||||||||
гид в условиях данной реакции образуется |
|
|
|
|
|||||||||
с незначительным практическим выходом. |
|
|
|
|
|||||||||
реакция Фриделя — Крафтса. основным |
|
|
|
|
|||||||||
методом получения ароматических кетонов |
|
|
|
|
|||||||||
является ацилирование ароматических угле- |
|
|
|
|
|||||||||
водородов по фриделю — крафтсу. в качест- |
|
|
|
|
|||||||||
ве ацилирующих реагентов чаще всего ис- |
|
|
|
|
|||||||||
пользуют галогенангидриды или ангидриды |
|
|
|
|
|||||||||
карбоновых кислот: |
людвиг ГаТТерман |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
(18 0—1 20) |
||
|
|
|
|
|
|
|
|
|
|
немецкий химик-органик. ос- |
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
новные научные |
работы относятся |
||
|
|
|
|
|
|
|
|
|
|
к синтетической органической химии. |
|||
|
|
|
|
|
|
|
|
|
|
открыл (1890) реакцию обмена диазо- |
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
группы в ароматических солях диазо- |
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
ния на атом галогена или цианогруп- |
|||
|
|
|
|
|
|
|
|
|
|
пу в присутствии металлической меди |
|||
реакция протекает по механизму S (см. |
(реакция Гаттермана). совместно со |
||||||||||||
|
|
|
|
|
|
|
|
|
E |
своим сотрудником и. а. кохом раз- |
|||
с. 212). |
работал (1897) метод получения аро- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
матических |
альдегидов, основанный |
||
23.4.3. ФИЗИЧеСКИе СВОЙСТВа |
на формилировании ароматических |
||||||||||||
ароматические альдегиды и кетоны — |
углеводородов под действием углеро- |
||||||||||||
да (ІІ) оксида и хлороводорода в при- |
|||||||||||||
жидкости или твердые вещества (табл. 23.4), |
сутствии кислот льюиса. |
||||||||||||
нерастворимые в воде. ароматические аль- |
открыл |
(1898) |
формилирование |
||||||||||
дегиды обладают запахом горького минда- |
фенолов и их эфиров. автор учебника |
||||||||||||
ля, с удалением альдегидной группы от бен- |
«Практические работы по органиче- |
||||||||||||
зольного ядра запах становится резче. кето- |
ской химии» (1894). |
||||||||||||
|
|
|
|
||||||||||
нам присущи достаточно приятные запахи.
23.4.4. хИмИЧеСКИе СВОЙСТВа
химические свойства ароматических альдегидов и кетонов во многом сходны со свойствами альдегидов и кетонов жирного ряда. ароматические альдегиды дают реакцию «серебряного зеркала», образуют ацетали, циангидрины, гидросульфитные соединения, альдоксимы, гидразоны, азометины. однако ароматические альдегиды не вступают в реакцию альдольной конденсации, очень трудно полимеризуются, в других соотношениях взаимодействуют с аммиаком.
ароматические кетоны по сравнению с кетонами жирного ряда обладают меньшей реакционной способностью. Поэтому они не образуют гидросульфитных соединений, бензофенон не реагирует с циановодородной кислотой.
Ароматические альдегиды и кетоны проявляют ряд специфических свойств.
Взаимодействие с аммиаком. ароматические альдегиды вступают во взаимо-
действие с аммиаком в соотношении 3:2 с образованием гидробензамида:

Глава 23
41
|
|
|
|
|
|
|
|
Таблица 23.4 |
|
|
Физические характеристики ароматических альдегидов и кетонов |
|
|||||
|
|
|
|
|
|
|
|
|
соединение |
название |
|
температура, °с |
Плотность, d t |
||||
|
|
|
|
|||||
|
|
|
|
плавления |
кипения |
4 |
||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
бензальдегид |
–26,0 |
179,2 |
1,0447 (d20) |
||
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
о-толуиловый |
|
– |
195,5 |
1,0386 (d19) |
|
|
|
|
альдегид |
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
м-толуиловый |
|
– |
199,0 |
1,0189 (d21) |
|
|
|
|
альдегид |
|
||||
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
п-толуиловый |
|
– |
205,0 |
1,0194 (d17) |
|
|
|
|
альдегид |
|
||||
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетофенон |
19,7 |
|
202,3 |
1,0281 (d20) |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
бензофенон |
48,1 |
|
306,0 |
1,0976 (d50) |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
образующийся в процессе реакции имин бензальдегида не способен полимеризоваться, две его молекулы вступают в реакцию с третьей молекулой бензальдегида.
реакция Канниццаро. открыта в 1853 году итальянским ученым станислао канниццаро. в присутствии сильного основания или концентрированной щелочи ароматические альдегиды вступают в реакцию диспропорционирования. При этом одна из двух молекул альдегида окисляется до соответствующей кислоты, а другая — восстанавливается до спирта:



алЬДеГИДЫ. КеТОнЫ
41
Бензоиновая конденсация. специфической реакцией альдегидов ароматического ряда является бензоиновая конденсация. сущность этой реакции заключается в конденсации двух молекул альдегида в присутствии солей циановодородной кислоты с образованием ароматических -гидроксикетонов (бензоинов, ацило-
инов):
Механизм бензоиновой конденсации:

Глава 23
420
альдегиды жирного ряда в условиях реакции бензоиновой конденсации образуют альдоли.
Галогенирование. При действии хлора на бензальдегид образуется хлорангидрид бензойной кислоты:
вслучае алифатических альдегидов реакция протекает по углеводородному радикалу (см. с. 405).
реакции электрофильного замещения в бензольном ядре. для ароматических альдегидов, наряду с реакциями, протекающими по альдегидной группе, характерны реакции электрофильного замещения с участием бензольного ядра (сульфирование, нитрование и др.). альдегидная группа направляет заместитель
вм-положение:
вреакции SE ароматические альдегиды вступают труднее, чем ароматические углеводороды, что связано с электроноакцепторным влиянием альдегидной группы на бензольное ядро.
23.4.5. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
Бензальдегид (бензойный альдегид) с6н5—сно. бесцветная жидкость с запахом горького миндаля (т. кип. 179,2 °с), образуется при гидролизе гликозида амигдалина, содержащегося в миндале, косточках персиков, абрикосов. бензальдегид растворим в спирте, практически нерастворим в воде. бензальдегид может быть получен каталитическим окислением толуола, омылением бензилиденхлорида или из бензола реакцией Гаттермана — коха.
на воздухе при стоянии бензальдегид легко окисляется до бензойной кислоты.
бензойный альдегид нашел применение как душистое вещество в парфюмерии и пищевой промышленности, как сырье для получения арилметановых красителей.
Ванилин (4-гидрокси-3-метоксибензальдегид). кристалличе-
ское вещество (т. пл. 81—83 °с), хорошо растворимо в спирте,
эфире, мало растворимо в воде.
ванилин как душистое вещество используют в пищевой и парфюмерной промышленности, является исходным веществом в синтезе противотуберкулезного препарата «фтивазида».
