
Контрольные работы по фармацевтической химии; 4 курс; ЗО;Фф / Контрольные Работы по Фармацевтич. хим. ЗО 4 КУРС
.pdf95% этанолом до метки. К 5 мл полученного раствора прибавляют 5 мл раствора натрия пикрата, выдерживают 20 мин при комнатной температуре. Оптическая плотность полученного раствора при
длине волны 495 нм и толщине слоя 10 мм равна 0,880. E – 286. Точная масса препарата 0,0200.
– 286. Точная масса препарата 0,0200.
30. В препарате «Кислота фолиевая» определяют поглощающие примеси: 0,001% раствор кислоты фолиевой в 0,1 моль/л раствора натрия гидроксида имеет максимумы поглощения при длинах волн
256, 283 и 365 нм. Отношение 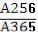 =2,8. Рассчитайте, какая должна быть оптическая плотность при длине волны 256 нм, если при
=2,8. Рассчитайте, какая должна быть оптическая плотность при длине волны 256 нм, если при
λ=365 нм она равна 0,260.
31.Рассчитайте метилтестостерона, если оптическая плотность равна 0,540 при длине волны 240 нм, концентрация исследуемого раствора 0,001% в 95% этаноле, толщина слоя 10 мм.
32.Рассчитайте количественное содержание левомицетина стеарата в субстанции.
Методика определения. Около 0,04 г (точная масса) препарата растворяют в 95% этаноле в мерной колбе вместимостью 100 мл и доводят объем раствора этанолом до метки (раствор А). 10 мл раствора А переносят в мерную колбу вместимостью 100 мл и доводят объем раствора этанолом до метки (раствор Б). определяют оптическую плотность полученного раствора Б на спектрофотометре при длине волны 272 нм в кювете с толщиной слоя 10 мм. Параллельно измеряют оптическую плотность 0,002% раствора стандартного образца левомицетина стеарата при длине волны 275 нм.
Оптические плотности испытуемого и стандартного растворов равны соответственно 0,360 и 0,400. точная масса препарата –
0,0369 г.
33.Рассчитайте концентрацию цианокобаламина в %. Методика определения. Около 0,1 г (точная масса) препарата
растворяют в воде в мерной колбе вместимостью 500 мл и доводят водой до метки. 25 мл этого раствора переносят в мерную колбу вместимостью 250 мл и доводят объем раствора водой до метки. Определяют оптическую плотность полученного раствора на спектрофотометре при длине волны 361 нм в кювете с толщиной
слоя 10 мм. Раствор сравнения – вода. E – 207. Содержание цианокобаламина пересчитывают на сухое вещество. Содержание
– 207. Содержание цианокобаламина пересчитывают на сухое вещество. Содержание
41
влаги в нем 12%, оптическая плотность – 0,341, точная масса препарата – 0,1000 г.
34. Рассчитайте концентрацию гексаметилентетрамина, если коэффициент преломления равен 1,3668. Коэффициент преломления воды 1,3330. Фактор показателей преломления растворов гексаметилентетрамина приведен в таблице.
Концентрация, |
F |
% |
|
1 |
0,00167 |
5 |
0,00168 |
10 |
0,00168 |
15 |
0,00169 |
20 |
0,00170 |
25 |
0,00170 |
30 |
0,00171 |
40 |
0,00172 |
35. Рассчитайте концентрацию анальгина, если коэффициент преломления равен 1,3716. Коэффициент преломления воды 1,3330. Фактор показателей преломления растворов анальгина приведен в таблице.
Концентрация, |
F |
% |
|
1 |
0,00194 |
5 |
0,00194 |
10 |
0,00193 |
15 |
0,00193 |
20 |
0,00192 |
30 |
0,00191 |
40 |
0,00190 |
36. Рассчитайте концентрацию натрия салицилата при 20°С, если ее показатель преломления измеренный при 25°С равен 1,3490. Коэффициент преломления воды 1,3330.
Фактор показателей преломления растворов натрия салицилата приведен в таблице.
Концентрация, |
F |
% |
|
1 |
0,00201 |
42
5 |
0,00201 |
10 |
0,00200 |
15 |
0,00199 |
20 |
0,00198 |
37.Рассчитайте концентрацию натрия бензоата при 20°С, если
еепоказатель преломления измеренный при 12°С равен 1,3490. Коэффициент преломления воды 1,3330.
Фактор показателей преломления растворов натрия бензоата приведен в таблице.
Концентрация, |
F |
% |
|
1 |
0,00217 |
5 |
0,00216 |
10 |
0,00214 |
15 |
0,00213 |
20 |
0,00211 |
38.Потенциометрическое титрование в анализе лекарственных веществ. Сущность метода.
39.Осадительное титрование: аргентометрия, меркуриметрия. Основы методов. Условия проведения. Химизм. Титранты. Индикаторы. Привести примеры.
40.Кислотно-основное титрование: ацидиметрия в водной среде. Основа метода. Условия проведения. Химизм. Титрант. Индикаторы. Привести примеры.
41.Кислотно-основное титрование: алкалиметрия в водной среде. Основа метода. Условия проведения. Химизм. Титрант. Индикаторы. Привести примеры.
42.Кислотно-основное титрование: косвенная (заместительная нейтрализация). Основа метода. Условия проведения. Химизм. Титрант. Индикаторы. Привести примеры.
43.Кислотно-основное титрование: оксимный метод. Основа метода. Условия проведения. Химизм. Титрант. Индикаторы. Привести примеры.
44.Титрование в среде неводных растворителей: ацидиметрия. Растворители, индикаторы, титрант. Привести примеры.
45.Титрование в среде неводных растворителей: алкалиметрия. Растворители, индикаторы, титрант. Привести примеры.
43
46. Окислительно-восстановительное титрование: йодиметрия. Основа метода. Условия проведения. Химизм. Титрант.
Индикаторы. Привести примеры. |
|
|
47. |
Окислительно-восстановительное |
титрование: |
йодхлорометрия. Основа метода. Условия проведения. Химизм.
Титрант. Индикаторы. Привести примеры. |
|
|
48. |
Окислительно-восстановительное |
титрование: |
броматометрия. Основа метода. Условия проведения. Химизм. Титрант. Индикаторы. Привести примеры.
49.Комплексонометрия. Условия проведения. Химизм. Титрант. Индикаторы. Привести примеры.
50.Нитритометрия. Условия проведения. Химизм. Титрант. Индикаторы. Методы установления точки эквивалентности. Привести примеры.
КОНТРОЛЬНАЯ РАБОТА III
Тема: Количественный анализ лекарственных веществ титриметрическими, физико-химическими методами анализа
1.Количественное определение препарата «Kalii bromidum» по фармакопейной статье проводят следующим образом: около 0,2 г
препарата (точная масса), предварительно высушенного при 1100С в течение 4 часов, растворяют в 20 мл воды и титруют 0,1 моль/л раствором серебра нитрата до оранжево - желтого окрашивания (индикатор – калия хромат). Калия бромида в высушенном препарате должно быть не менее 99,0 % и не более 100,6 %. Дайте обоснование данному методу количественного определения. Напишите уравнения реакций. Рассчитайте молярную массу эквивалента, титр и массовую долю препарата в процентах (навеска анализируемого порошка 0,2178 г, потеря в массе при высушивании – 0,76%, молекулярная масса калия бромида 119,01; объем раствора серебра нитрата, пошедший на титрование 18,3 мл. На основе полученных данных сделайте заключение о соответствии исследуемого образца требованиям ФС.
2.Рассчитайте объем титранта, расходуемый при
количественного |
определение |
цинка |
оксида |
(М.м. |
81,37) |
трилонометрическим методом, если точная масса вещества |
0,6971 |
||||
г. Цинка оксида |
в препарате |
должно |
быть не |
менее |
99,0%. |
|
|
44 |
|
|
|
Титрант − 0,05 моль/л раствор трилона Б. Дайте обоснование данному методу количественного определения. Напишите уравнения реакций. Укажите условия проведения титрования. Рассчитайте молярную массу эквивалента, титр и напишите формулу расчета массовой доли препарата в процентах.
3. Количественное определение препарата «Argenti nitras» по фармакопейной статье проводят следующим образом: около 0,3 г
препарата (точная масса) растворяют в |
50 мл воды, прибавляют |
5 мл разведенной азотной кислоты |
и титруют 0,1 моль/л |
раствором аммония роданида (индикатор − железоаммониевые квасцы). Серебра нитрата в препарате должно быть не менее 99,75 %. Дайте обоснование методу количественного определения. Напишите уравнения реакций. Рассчитайте молярную массу эквивалента, титр и массовую долю препарата в процентах (навеска анализируемого порошка 0,3026 г, молярная масса серебра нитрата 169,87, объем раствора аммония роданида (К = 0,99), пошедшего на титрование – 18,0 мл). На основе полученных данных сделайте заключение о соответствии исследуемого образца требованиям ГФ.
4. Кислота аскорбиновая. Объяснить кислотные и восстановительные свойства (привести реакции). Рассчитайте объем 0,1 моль/л раствора калия иодата, расходуемого при количественном определении кислоты аскорбиновой йодатометрическим методом, если точная масса вещества равна 0,5302. Кислоты аскорбиновой в препарате должно быть не менее 99,0%. Молярная масса кислоты аскорбиновой равна 176,13. Приведите уравнения химических реакций. Напишите уравнения химических реакций, укажите фактор эквивалентности, молярную массу эквивалента, титр.
5. Количественное определение препарата «Natrii chloridum» согласно ФС 42-2572-95 проводят следующим образом: около 1 г препарата (точная масса) растворяют в воде в мерной колбе емкостью 50 мл и доводят объем раствора водой до метки. 10 мл полученного раствора разбавляют водой до 40 мл и титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого окрашивания (индикатор – калия хромат).
Натрия хлорида в пересчете на сухое вещество должно быть в препарате не менее 99,5%.
45
Дайте обоснование данному методу количественного определения. Напишите уравнения реакций. Рассчитайте молярную массу эквивалента, титр и массовую долю препарата в процентах (навеска анализируемого порошка 1,0178 г, потеря в массе при высушивании – 0,46%, молярная масса натрия хлорида 58,44, объем раствора серебра нитрата, пошедший на титрование 8,7 мл). На основе полученных данных сделайте заключение о соответствии исследуемого образца требованиям ФС.
6.Рассчитайте и оцените результаты количественного определения фталазола алкалиметрическим методом в среде диметилформамида, если на титрование его навески массой 0,2200 г (точная масса) было затрачено 10,6 мл 0,1 моль/л раствора натрия гидроксида. Молекулярная масса фталазола равна 403,4. Норсульфазол в препарате отсутствует. Потеря в массе при высушивании составляет 1%. Содержание фталазола в пересчете на сухое вещество должно быть не менее 99,0%. Напишите химизм.
7.Напишите структурные формулы и приведите латинские и химические названия бензокаина (анестезина), прокаина гидрохлорида (новокаина), тетракаина гидрохлорида (дикаина), прокаинамида гидрохлорида (новокаинамида), тримекаина гидрохлорида, лидокаина гидрохлорида; бупивакаина гидрохлорида; натрия п-аминосалицилата, бепаска, буметанида (буфенокса), мефенаминовой кислоты и ее натриевой соли, диклофенака (ортофена, вольтарена), ибупрофена (бруфена), напроксена, кетопрофена. Сгруппируйте вещества по растворимости в воде, отношению к кислотам и щелочам.
8.Рассчитайте объем 0,1 моль/л раствора калия иодата, расходуемого при количественном определении кислоты аскорбиновой йодатометрическим методом, если точная масса вещества равна 0,5302. Кислоты аскорбиновой в препарате должно быть не менее 99,0%. Молярная масса кислоты аскорбиновой равна 176,13. Приведите уравнения химических реакций.
9.Количественное определение фенилсалицилата проведено по следующей методике: Около 1 г препарата (точная масса)
помещают в коническую колбу вместимостью |
100 мл. |
Прибавляют 25 мл 0,5 моль/л раствора натрия |
гидроксида, |
соединяют колбу с обратным холодильником и, погрузив колбу в
46
кипящую водяную баню, нагревают до исчезновения маслянистых капель (1 – 1,5 г). Раствор охлаждают и титруют 0,5 моль/л раствором хлороводородной кислоты до устойчивой желтой окраски (индикатор – бромкрезоловый пурпуровый). Параллельно проводят контрольный опыт. После гидролиза препарата, избыток натрия гидроксида и образующиеся феноляты оттитровываются 0,5 моль/л раствором хлороводородной кислоты. 1 мл 0,5 моль/л раствора натрия гидроксида соответствует 0,1071 г фенилсалицилата, которого в препарате должно быть не менее 99,0%. Дайте обоснование метода, приведите уравнения реакций, фактор эквивалентности, молярную массу эквивалента, титр и расчетную формулу определения массовой доли вещества (в %) в препарате.
10.Рассчитайте и оцените результаты количественного определения фталазола алкалиметрически в среде диметилформамида, если на титрование его навески массой 0,2200 г (точная масса) было затрачено 10,6 мл 0,1 моль/л раствора натрия гидроксида. Молекулярная масса фталазола равна 403,4. Норсульфазол в препарате отсутствует. Потеря в массе при высушивании составляет 1%. Содержание фталазола в пересчете на сухое вещество должно быть не менее 99,0%.
11.Рассчитайте объем титранта, расходуемый при
количественном определении цинка сульфата |
(М.м. |
287,54) |
трилонометрическим методом, если точная масса вещества |
0,6971 |
|
г. Цинка сульфата в препарате должно быть 99,5%. Титрант – 0,05 М раствор трилона Б. Дайте обоснование данному методу количественного определения. Напишите уравнения реакций. Укажите условия проведения титрования. Рассчитайте молярную массу эквивалента, титр и напишите формулу расчета массовой доли препарата в процентах.
12. Количественное определение препарата «Calcii chloridum» согласно ФС 42-2567-00 проводят следующим образом: около 0,8 г препарата (точная масса), отвешенные в закрытом бюксе, растворяют в воде, переносят в мерную колбу емкостью 100 мл, доводят объем раствора водой до метки и тщательно
перемешивают. |
|
|
|
К 25 мл полученного раствора прибавляют |
5 мл аммиачного |
||
буферного раствора, |
0,1 г |
индикаторной смеси или 7 капель |
|
раствора кислотного |
хром |
темно-синего |
и титруют при |
|
|
47 |
|
энергичном перемешивании 0,05 моль/л раствором трилона Б до синего-фиолетового окрашивания. Кальция хлорида в препарате должно быть не менее 98,0%.
Дайте обоснование данному методу количественного определения. Напишите уравнения реакций. Рассчитайте молярную массу эквивалента, титр и массовую долю препарата в процентах (навеска анализируемого порошка 0,7949 г, молярная масса кальция хлорида 219,08, объем раствора трилона Б, пошедшего на титрование, 18,1 мл). На основе полученных данных сделайте заключение о соответствии исследуемого образца требованиям ФС.
13. Количественное определение тимола проведено по следующей методике: около 0,5 г препарата (точная масса) растворяют в 5 мл раствора натрия гидроксида в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. Отмеренные 10 мл полученного раствора переносят в колбу, прибавляют 0,5 г бромида калия, 40 мл разведенной хлороводородной кислоты, 3 капли раствора метилового оранжевого и при сильном взбалтывании титруют 0,1 моль/л раствором бромата калия до исчезновения розового окрашивания.
1 мл 0,1 моль/л раствора бромата калия соответствует 0,003755 г тимола, которого в препарате должно быть не менее
99,0%.
Дайте обоснование метода, приведите уравнения реакций, фактор эквивалентности, молярную массу эквивалента, титр и расчетную формулу определения массовой доли вещества (в %) в препарате.
14. Количественное определение препарата «Calcii chloridum» согласно ФС 42-2567-00 проводят следующим образом: около 0,8 г препарата (точная масса), отвешенные в закрытом бюксе, растворяют в воде, переносят в мерную колбу емкостью 100 мл, доводят объем раствора водой до метки и тщательно перемешивают. К 25 мл полученного раствора прибавляют 5 мл аммиачного буферного раствора, 0,1 г индикаторной смеси или 7 капель раствора кислотного хром темно-синего и титруют при энергичном перемешивании 0,05 моль/л раствором трилона Б до синего-фиолетового окрашивания. Кальция хлорида в препарате должно быть не менее 98,0%. Дайте обоснование данному методу количественного определения. Напишите уравнения реакций.
48
Рассчитайте молярную массу эквивалента, титр и массовую долю препарата в процентах (навеска анализируемого порошка 0,7949 г, молярная масса кальция хлорида 219,08, объем раствора трилона Б, пошедшего на титрование, 18,1 мл). На основе полученных данных сделайте заключение о соответствии исследуемого образца
требованиям ФС. |
|
|
|
|
15. Рассчитайте |
объем |
0,1 моль/л |
раствора кислоты |
|
хлороводородной, |
при |
количественном |
определении |
|
гексаметилентетрамина методом нейтрализации, если точная масса вещества в препарате равна 0,2309 г. Гексаметилентетрамина в
препарате должно быть не |
менее 99,0%. Молярная |
масса |
гексаметилентетрамина равна |
140,19. Приведите уравнения |
|
химических реакций. |
|
|
16. При количественном определении парацетамола |
(М.м. |
|
151,17) методом нитритометрии израсходовано 11,5 мл 0,1 моль/л раствора натрия нитрита. Рассчитайте массу взятой навески, если содержание натрия бензоата в препарате должно быть не менее
99,0%.
17.Количественное определение кислоты салициловой по фармакопейной статье проводят следующим образом: Около 0,25
гпрепарата (точная масса) растворяют в 15 мл нейтрализованного по фенолфталеину этанола и титруют с тем же индикатором 0,1 моль/л раствором едкого натра до розового окрашивания. 1 мл 0,1 моль/л раствора едкого натра соответствует 0,01381 г кислоты салициловой, которой в препарате должно быть не менее 99,5%. Дайте обоснование метода, приведите уравнение реакции, фактор эквивалентности, молярную массу эквивалента, титр и расчетную формулу определения массовой доли вещества (в %) в препарате.
18.Количественное определение стрептоцида было проведено броматометрическим методом. Какую массу нужно взять, чтобы на титрование стрептоцида потребовалось 20 мл 0,1 моль/л калия бромата (индикатор – метиловый оранжевый). Молярная масса стрептоцида равна 172,21.
19.Обоснуйте кислотно-основные свойства калия ацетата. Напишите уравнения реакций, лежащих в основе методов количественного определения. Укажите растворитель, индикатор. Приведите фактор эквивалентности, молярную массу эквивалента,
49
титр, расчетную формулу для определения массовой доли вещества (в %) в препарате.
20.При количественном определении парацетамола (М.м. 151,17) методом нитритометрии израсходовано 11,5 мл 0,1 моль/л раствора натрия нитрита. Рассчитайте массу взятой навески, если содержание натрия бензоата в препарате должно быть не менее
99,0%.
21.Обоснуйте возможность количественного определения стрептоцида йодхлорметрическим методом анализа. Сущность метода. Титрант, индикаторы, условия проведения. Приведите уравнение реакции, фактор эквивалентности, молярную массу эквивалента, титр и расчетную формулу определения массовой доли вещества (в %) в препарате.
22.Рассчитайте количественное содержание и оцените качество парацетамола по количественному содержанию, если на титрование 0,2456 г навески израсходовано 16, 28 мл 0,1 моль/л раствора натрия нитрита с К=1,0123. 1 мл 0,1 моль/л раствора натрия нитрита соответствует 0,01512 г парацетамола, которого в препарате д.б. не менее 98,5%.
23. Обоснуйте возможность количественного определения парацетамола нитритометрическим методом. Приведите уравнение реакции, фактор эквивалентности, молярную массу эквивалента, титр и расчетную формулу определения массовой доли вещества (в %) в препарате.
24.Какие из перечисленных ниже препаратов мешают определению калия йодида аргентометрическим методом по Фаянсу (индикатор – эозинат натрия)?
а) Кислота никотиновая; б) Теофиллин; в) Эуфиллин; г) Левомицетин; д) Глюкоза. Ответ обоснуйте уравнениями химических реакций.
25.Обоснуйте кислотно-основное титрование в неводных средах. Сущность метода. Классификация растворителей, применяемых в неводном титровании. Индикаторы. Преимущества
инедостатки. Приведите примеры применения метода в фармацевтическом анализе с соответствующими уравнениями химических реакций, расчетами факторов эквивалентности, молярных масс эквивалентов, массовых долей определяемых веществ в %.
50
