
- •2. Термодинамика идеального газа
- •Первое начало в форме конечной разности.
- •Адиабатический процесс
- •Работа при адиабатическом и изотермическом процессах.
- •I. Для бесконечно малого количества теплоты , переданного системе обратимым образом, существует интегрирующий множитель, такой, чтоесть дифференциалнекоторой функции состояния системы (энтропии).
- •Заключительная часть
МЧС России
Санкт-Петербургский университет государственной противопожарной службы
Утверждаю
Начальник кафедры физики и теплотехники, полковник вн.сл. Иванов А.Н.
(должность, звание, ФИО)
«13» октября 2008 года
ЛЕКЦИЯ
по учебной дисциплине «Физика»
Специальность 280104.65 - Пожарная безопасность
Заочное отделение, 6 лет
Тема № 7 «Основы молекулярной физики и термодинамики»
Обсуждена на заседании кафедры
Протокол № 2/10 от
«13» октября 2008 года
Санкт- Петербург
2008
I. Цели занятия
1. Образовательная – изучение понятий и законов раздела основы молекулярной физики и термодинамики
2. воспитательные
- применение рассмотренных явлений в пожарной безопасности
- повышение квалификации сотрудников ГПС
II. Расчёт учебного времени
|
Содержание и порядок проведения занятия |
Время, мин. |
|
ВВОДНАЯ ЧАСТЬ ОСНОВНАЯ ЧАСТЬ Учебные вопросы 1. Основное уравнение молекулярно-кинетической теории идеального газа. 2. Термодинамика идеального газа ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
5 170
80
90 5 |
III. Литература
Основная:
1. Трофимова Т.И. Курс физики. - М.: Высшая школа, 2003, с.81-118.
Дополнительная:
Савельев И.В. Курс общей физики. - М.: Наука, 1989, Т.1.
Трубилко А.И., Звонов В.С., Поляков А.С., Дятченко А.А. Электричество. Пособие для самостоятельной работы - СПб.: СПбИПБ МВД России, 1998.
IV. Учебно-материальное обеспечение
Технические средства обучения: мультимедийный проектор, интерактивная доска.
V. Текст лекции
Вводная часть. Ставятся цели занятия.
Учебные вопросы
1. Основное уравнение молекулярно-кинетической теории идеального газа.
Различают три агрегатных состояния вещества твердое, жидкое и газообразное. Газообразное состояние является наиболее простым, т. к. в этом случае силы, действующие между молекулами, очень малы, и при определенных условиях ими можно пренебречь. В настоящем курсе молекулярной физики в основном рассматриваются свойства газов. При этом сначала мы будем полагать, что межмолекулярные силы в них не только малы, но и полностью отсутствуют. Пренебрежем также размерами молекул, т. е. будем считать их материальными точками. При таких допущениях молекулы газа должны считаться совершенно свободными. Это означает, что, как и тела, не подверженные действию каких-либо сил, они движутся прямолинейно и равномерно. Следовательно, каждая молекула ведет себя так, как будто других молекул в сосуде нет. Газ, обладающий такими же свойствами, как и совокупность невзаимодействующих материальных точек, называется идеальным газом. Более строго: под идеальным газом понимается система, в которой можно пренебречь энергией взаимодействия частиц (атомов или молекул) по сравнению с их кинетической энергией. В такой системе частицы в основном движутся прямолинейно и равномерно, испытывая кратковременные столкновения друг с другом и со стенками сосуда, в котором газ заключен.
Уравнение,
связывающее три величины
давление
![]() ,
объем
,
объем![]() и температуру
и температуру![]() газа, для данной его массы называетсяуравнением
состояния.
В общем виде оно может быть записано
следующим образом:
газа, для данной его массы называетсяуравнением
состояния.
В общем виде оно может быть записано
следующим образом:
![]() .
Это значит, что состояние газа определяется
только двумя независимыми параметрами
(например, давлением и объемом), третий
параметр однозначно определяется двумя
другими.
.
Это значит, что состояние газа определяется
только двумя независимыми параметрами
(например, давлением и объемом), третий
параметр однозначно определяется двумя
другими.
Всякий газ, если он достаточно разрежен, подчиняется закону Клапейрона
![]() . (1)
. (1)
Здесь
![]()
масса газа,
масса газа,
![]()
молекулярный вес,
молекулярный вес,
![]()
универсальная газовая постоянная.
Величина
универсальная газовая постоянная.
Величина
![]() (2)
(2)
представляет
собой число киломолей в данной массе
газа. Если ввести понятие молярного
объема
![]() .
т. е. объема, приходящегося на один
киломоль газа
.
т. е. объема, приходящегося на один
киломоль газа
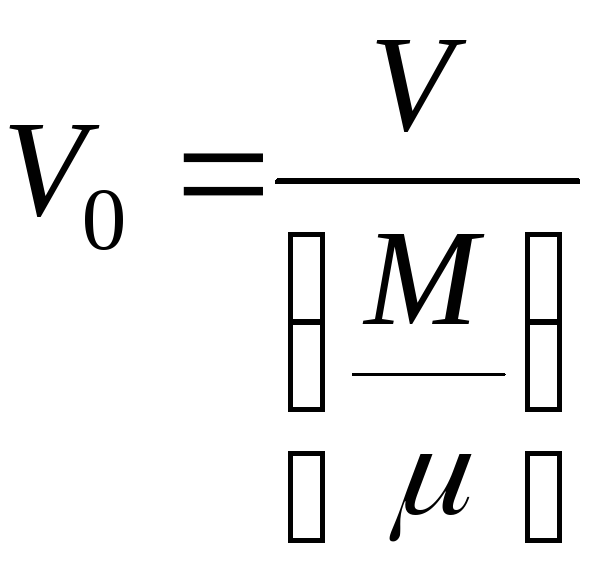 , (3)
, (3)
то уравнение (1.1) примет вид
![]() , (4)
, (4)
универсальный для всех сортов газов. Уравнение (1) (или (4)) представляет собой уравнение состояния идеального газа.
Единицы измерения:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Отсюда
вытекает размерность газовой постоянной:
![]() и численное значение в системе единиц
СИ:
и численное значение в системе единиц
СИ:
![]() . (5)
. (5)
Из (1.4) легко получить как частный случай известные законы идеальных газов.
1) Закон Бойля Мариотта
При
![]() .
.
![]() . (6)
. (6)
Это – изотермы При малых объемах газ в действительности перестает быть идеальным.
2) Закон Гей-Люссака Шарля
При
![]() .
.
![]() (7)
(7)
Это – изобары. График изобары имеет вид прямой, исходящей из начала координат
3) Закон Гей-Люссака
При
![]() .
.
![]() (8)
(8)
Процесс, происходящий при постоянном объеме, называется изохорическим. График изохоры, как и график изобары, представляет собой прямую, исходящую из начала координат
2. Термодинамика идеального газа
Изменение состояния и работа.Возьмем какое-либо физическое тело. Будем называть его системой. С точки зрения физики система характеризуется своим состоянием. Состояние характеризуется совокупностьюпараметров (внешних и внутренних).
Всякая система, поставленная в определенные внешние условия, рано или поздно приходит в состояние термодинамического (статистического) равновесия.Это утверждение можно рассматривать как один из основных постулатов статистической физики.
В понятие определенных внешних условий
входит, во-первых, задание положений
(координат) внешних по отношению к
системе тел, определяющих силы, действующие
на частицы системы. Эти координаты
(положения) внешних тел называются
внешними параметрами.В случае
однородной изотропной системы вместо
задания координат стенок сосуда, внутри
которого заключена система, в качестве
внешнего параметра можно ввести просто
объем системы![]() .
В тех случаях, когда внешние тела создают
в системе протяженные полямагнитные, электрические, гравитационные,в качестве внешних
параметров выбираются напряженности
самих полей.
.
В тех случаях, когда внешние тела создают
в системе протяженные полямагнитные, электрические, гравитационные,в качестве внешних
параметров выбираются напряженности
самих полей.
Наряду с внешними параметрами будем различать внутренние параметрывеличины, характеризующие свойства самой системы. Например, к их числу относится давление, которое для однородной и изотропной системы при отсутствии внешних полей зависит от объема и температуры (или энергии) системы. К числу внутренних же параметров принадлежит степень диссоциации молекулярного газа, зависящая от его плотности (объема) и температуры. Вообще говоря, внутренние параметры зависят от внешних параметров и температуры (или энергии) системы.
В состоянии термодинамического равновесия системы ее внутренние параметры имеют, при заданных внешних параметрах и температуре (энергии),определенные численные значения(с точностью до малых флуктуаций, обусловленных молекулярной структурой системы).
Рассмотрим простейшую систему идеальный газ. Если считать массу газа
заранее заданной, например,![]() ,
то параметрами, характеризующими
состояние этой системы, будут давление
,
то параметрами, характеризующими
состояние этой системы, будут давление![]() ,
объем
,
объем![]() и температура
и температура![]() .
Они связаны уравнением состояния
идеального газа (1.4):
.
Они связаны уравнением состояния
идеального газа (1.4):
![]() .
Таким образом, независимыми будут любые
два из них. Варьируя параметры можно
приводить систему в разные состояния.
.
Таким образом, независимыми будут любые
два из них. Варьируя параметры можно
приводить систему в разные состояния.
1.Опыты Джоуля показали, что при переходе механической работы в тепло 1) одинаковое количество работывсегдадает одинаковое количество тепла; 2) тепло пропорционально работе.
4,184 дж1калория, (9)
где
1 калорияколичество тепла, нагревающего 1гводы в интервале температур от![]() до
до![]() .
.
Замечание:количество тепла измеряется
при этом исходя из формулы:![]() .
.
2.Если мы будем переводить систему
(газ) из состояния 1 в 2 и учитывать при
этом не только работу (зависящую от пути
перехода), но и переданное тепло (тоже
зависящее от пути перехода), то в сумме
совершенная над газом работа и сообщенное
ему тепло не зависят от пути перехода.
Значит, их сумма является функцией,
зависящей только от состояний 1 и 2.Этаоднозначнаяфункция состояниявнутренняя энергия
системы![]()
Отсюда мы приходим к первому началу термодинамики, которое является обобщением закона сохранения механической энергии: при любых возможных способах перехода из состояния 1 в 2 сумма механических эквивалентов всех внешних воздействий остается неизменной.
В дифференциальной форме:
![]() , (10)
, (10)
здесь
![]() работа,
совершаемая внешними силами над газом
работа,
совершаемая внешними силами над газом![]() ,
а
,
а![]() - теплота, сообщаемая газу.
- теплота, сообщаемая газу.
Таким образом, при феноменологическом
развитии термодинамики 1-ое начало
постулируетдля системы существование
некоторой функции состояния![]() ,
называемой внутренней энергией, которая
может меняться как за счет работы
,
называемой внутренней энергией, которая
может меняться как за счет работы![]() ,
совершаемой над системой, так и за счет
теплоты
,
совершаемой над системой, так и за счет
теплоты![]() ,
ей передаваемой .
,
ей передаваемой .
