
lanina_himiya_vody_i_mikrobiologiya_2012
.pdfМИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Ухтинский государственный технический университет» (УГТУ)
Химия воды и микробиология
Методические указания для выполнения лабораторных работ
Ухта 2012
УДК [628.1+543.3](076,5) ББК 38.761.1
Л 22
Ланина, Т. Д.
Химия воды и микробиология: метод. указания для выполнения лабораторных работ / Т. Д. Ланина, Е. С. Селиванова. – Ухта : УГТУ, 2012. – 47 с.
Методические указания предназначены для выполнения лабораторных работ по химии воды и микробиологии для студентов по направлению «Строительство» специальности «Водоснабжение и водоотведение».
Методические указания охватывают основные разделы по очистке природных и сточных вод.
Содержание заданий соответствует рабочей программе.
Методические указания рассмотрены и одобрены заседанием кафедры водоснабжения и водоотведения от 16.04.2012 г., пр. №8.
Рецензент: В. И. Крупенский, заведующий кафедрой химии, профессор Ухтинского государственного технического университета, доктор химических наук.
Редактор: Г. В. Николаева, доцент кафедры ВВ Ухтинского государственного технического университета.
В контрольных заданиях учтены предложения рецензента и редактора.
План 2012 г., позиция 175.
Подписано в печать 29.06.2012 г. Компьютерный набор. Объем 47 с. Тираж 100 экз. Заказ №265.
© Ухтинский государственный технический университет, 2012 169300, Республика Коми, г. Ухта, ул. Первомайская, д. 13.
Типография УГТУ.
169300, Республика Коми, г. Ухта, ул. Октябрьская, д. 13.
15. Константинов, А. С. Общая гидробиология: учеб. для вузов / А. С. Константинов. – М. : Высш. школа, 1986.
16.Корш, Л. Е. Ускоренные методы санитарно-бактериологического исследования воды: учеб. для вузов / Л. Е. Корш, Т. З. Артемова. – М. : Медицина, 1978.
17.Синельников, В. Е. Механизм самоочищения водоемов: учеб. для вузов / В. Е. Синельников. – М. : Стройиздат, 1980.
18.Ласуков, Р. Ю. Обитатели водоемов: учеб. для вузов / Р. Ю. Ласуков. –
М. : «Рольф», 1999.
47
|
Библиографический список |
СОДЕРЖАНИЕ |
|
1. |
СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к ка- |
Введение.................................................................................................................. |
4 |
честву воды централизованных систем питьевого водоснабжения. Контроль ка- |
Лабораторная работа №1 Микробиологический состав природных вод ...... |
5 |
|
чества: – Введ. 2001-26-09. – М. : Минздрав России, 2001. – 57 с. |
Лабораторная работа №2 Определение органолептических |
|
|
2. |
ГОСТ Р 52769-2007. Вода. Методы определения цветности. – Введ. |
показателей воды................................................................................................... |
12 |
2009-01-01. – М. : Минздрав России, 2001. |
Лабораторная работа №3 Определение концентрации |
|
|
3. |
ГОСТ Р 3351-74. Вода питьевая. Методы определения вкуса, запаха и |
карбонатов и гидрокарбонатов ........................................................................... |
20 |
мутности. – Введ. 1975-01-07. – М. : Издательство стандартов, 1975. |
Лабораторная работа №4 Определение концентрации хлоридов |
|
|
4. |
ГОСТ Р 52963-2008. Вода. Методы определения щелочности и массо- |
аргентометрическим методом.............................................................................. |
25 |
вой концентрации карбонатов и гидрокарбонатов. – Введ. 2008-29-08. – М. : |
Лабораторная работа №5 Определение концентрации общей |
|
|
Стандартинформ, 2009. |
жесткости, кальция и магния .............................................................................. |
29 |
|
5. |
ГОСТ Р 52407-2005. Вода питьевая. Методы определения жесткости. – |
Лабораторная работа №6 Определение концентрации общего |
|
Введ. 2007-01-01. – М. : Стандартинформ, 2007. |
железа в воде.......................................................................................................... |
35 |
|
6. |
ПНД Ф 14.1:2.159-2000. Методика выполнения измерений массовой |
Лабораторная работа №7 Определение сульфатов турбидиметрическим |
|
концентрации сульфат-ионов в пробах природных и сточных вод турбидимет- |
методом................................................................................................................... |
38 |
|
рическим методом. – Введ. 2005-20-01. – М. : ФГУ «ФЦАО», 2005. – 12 с. |
Лабораторная работа № 8 Определение перманганатной |
|
|
7. |
ПНД Ф 14.1:2.96-97 Методика выполнения измерений массовой кон- |
окисляемости природных вод.............................................................................. |
41 |
центрации хлоридов в пробах природных и очищенных сточных вод аргенто- |
Библиографический список.................................................................................. |
46 |
|
метрическим методом. – Введ. 1997-21-03. – М. : ООО НПП «АКВАТЕСТ», |
|
|
|
2005. – 18 с. |
|
|
|
8. |
ПНД Ф 14.1:2.50-96. Методика выполнения измерений массовой кон- |
|
|
центрации общего железа в природных и сточных водах фотометрическим ме- |
|
|
|
тодом с сульфосалициловой кислотой. – Введ. 1996-20-03. – М. : НТС ФГУ |
|
|
|
«ФЦАМ» , 2004. – 10 с. |
|
|
|
9. |
Возная, Н. Ф. Химия воды и микробиология: учеб. пособие / |
|
|
Н. Ф. Возная. – М. : Высшая школа, 1979. |
|
|
|
10.Голубовская, Э. К. Биологические основы очистки воды: учеб. пособие / Э. К. Голубовская. – М. : Высшая школа, 1978.
11.Таубе, П. Р. Химия воды и микробиология: учеб. пособие / П. Р. Таубе, А. Г. Баранова. – М. : Высшая школа, 1983.
12.Карюхина, Т. А. Химия воды и микробиология: учеб. пособие / Т. А. Карюхина, И. Н. Чурбанова. – М. : Стройиздат, 1983.
13.Глинка, Н. Л. Общая химия: учеб. пособие / Н. Л. Глинка; ред. В. А. Рабиновича. – 24-е изд. – Л. : Высш. шк., 1986.
14.Чурбанова, И. Н. Микробиология: учеб. для вузов / И. Н. Чурбанова. – М. : Высшая школа, 1987.
46 |
3 |
Лабораторный практикум по химии воды и микробиологии |
7. Напишите уравнения реакций, происходящих при определении перман- |
|
гантной окисляемости? Назовите, какому типу они относятся? |
Введение |
8. Объясните, почему определение окисляемости ведут к кислой среде? |
Предлагаемый практикум по химии воды и микробиологии предназна- |
9. Расставить коэффициенты и определить окислитель и восстановитель в |
чен для студентов, обучающихся по направлению «Строительство» специаль- |
уравнениях: |
ности «Водоснабжение и водоотведение». Он содержит описание методик |
МnО2+НСl → МnСl2+Сl+Н2О |
исследования показателей качества природных, питьевых и сточных вод, пере- |
К2S+КМnO4+Н2SО → S+МnSО4+К2SО4+Н2О |
чень приборов и оборудования, необходимых для выполнения этих работ. |
SnSО4+КМnO4+Н2SО4 → Sn(SО4)2+МnSО4+К2SО4+Н2О |
С целью более полного восприятия студентами материала дисциплины |
NаI+КМnO4+КОН → I2+К2МnО4+ NаОН |
описанию практических задач предшествуют краткие теоретические разделы, |
|
которые вводят обучающихся в круг изучаемых вопросов и помогают в подго- |
|
товке к выполнению лабораторных работ и экзамену. |
|
Отличительной чертой предлагаемого практикума является стремление |
|
к развитию у студентов навыков самостоятельного научного поиска, углублен- |
|
ного изучения теоретического материала, сопоставления полученных результа- |
|
тов исследований с практикой. |
|
4 |
45 |

Обработка результатов
Расчет величины перманганатной окисляемости выполняется в соответствии с законом эквивалентов: объемы двух растворов разных веществ реагируют между собой в количествах, обратно пропорциональных их нормальным концентрациям.
VC2H2O4 = NKMnO4
VKMnO4 NC2H2O4
Поэтому нормальность перманганата калия можно рассчитать по уравнению:
NKMnO4 = VVC2 H 2 O4 NC2 H 2 O4 KMnO4
Перманганатная окисляемость воды рассчитывается по формуле:
|
|
ПО = |
(V1 −V2 ) N 8 1000 |
|
|
|
|
V3 |
, |
где V1 |
– общий объем 0,01 н раствора КМnО4, добавленного в пробу, мл; |
|||
V2 |
– объем КМnO4, пошедший на титрование Н2С2О4; |
|||
N – нормальность раствора КМпО4; |
|
|||
8 – миллиграмм-эквивалент кислорода; |
|
|||
V3 |
– объем исследуемой воды, мл. |
|
||
Результаты определения окисляемости записать в таблицу: |
||||
|
|
|
|
|
Объем иссле- |
Общий объем |
Объем KMnO4 на |
|
|
дуемой воды, |
KMnO4, |
нейтрализацию |
ПО, мг О2/л |
|
V3 |
V1 |
H2C2O4, V2 |
|
|
|
|
|
|
|
|
|
|
|
|
Вопросы
1.Что называется окисляемостью?
2.В каких единицах измеряется окисляемость?
3.От каких факторов зависит окисляемость?
4.Какие соединения влияют на окисляемость воды?
5.Какие виды окисляемости различают?
6.Напишите уравнения реакций, происходящих при определении перманганатной окисляемости? Назовите, к какому типу они относятся?
44
Лабораторная работа № 1 Микробиологический состав природных вод
Микробиология изучает микроскопические организмы – микробы, их строение, жизнедеятельность и изменения, вызываемые ими в окружающей природе. Микробиология природных вод рассматривает микробное население водоемов и его роль в процессах самоочищения водоемов, роль микроорганизмов в процессах искусственной и естественной биологической очистки сточных вод, микробиологические методы анализа воды.
Название микроорганизмы относится к различным микроскопическим представителям растительного и животного мира, в эту группу входят организмы с разной степенью сложности строения : ультрамикробы (не обладают клеточной структурой); бактерии (одноклеточные микроорганизмы); микроскопические растения и животные (многоклеточные структуры).
Бактерии
Это обширная группа одноклеточных микроорганизмов, относящихся к прокаритам. Характеризуется отсутствием окруженного оболочкой клеточного ядра. Вместе с тем генетический материал бактерии (ДНК) занимает в клетке вполне определенное место, называемое нуклеоидом. Организмы с таким строением клеток называются прокариотами («доядерными») и отличаются от всех остальных клеток – эукариот («истинно ядерных») отсутствием ядерной оболочки (рисунок 1).
Формы и строение бактерий
Бактерии имеют разнообразные формы клетки.
Бактерии значительно мельче клеток растений и животных. Их толщина чаще 0,5-2,0 мкм, а длина – 1,0-8,0 мкм, что едва позволяет разглядеть при использовании стандартных световых микроскопов. На поверхности, соответствующей поставленной карандашом точке, уместится четверть миллиона средних по величине представителей этого царства.
5
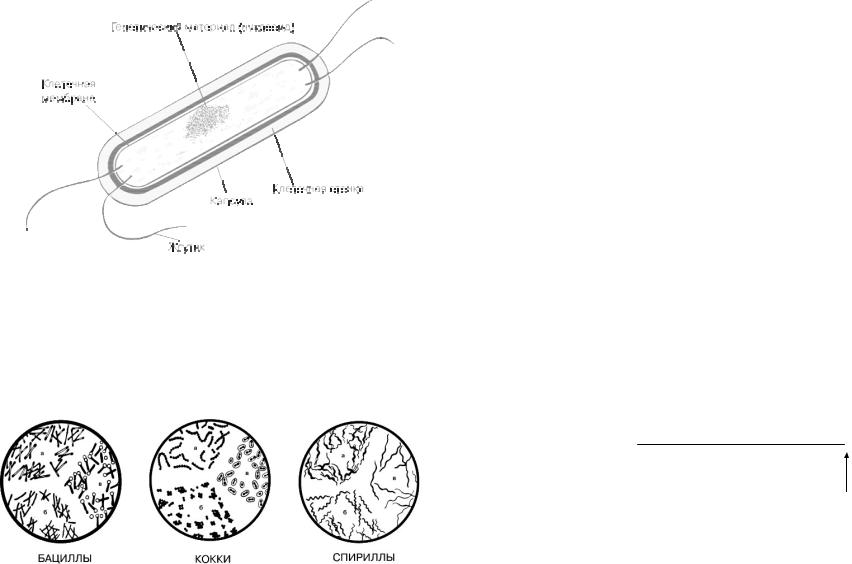
Рисунок 1 – Строение бактерии
По особенностям морфологии выделяют следующие группы бактерий: кокки (более или менее сферические), бациллы (палочки или цилиндры с закругленными концами), спириллы (жесткие спирали) и спирохеты (тонкие и гибкие волосовидные формы).
Рисунок 2 – Группы бактерий
На рисунке 3 представлены основные подгруппы бактерий.
6
10 мин. с момента появления первого пузырька. Время кипячения установлено ГОСТом и должно соблюдаться точно, так как продолжительность нагрева воды с перманганатом калия сильно сказывается на его окисляющем действии.
Часть прибавленного перманганата калия расходуется при кипячении на окисление органических примесей воды. Цвет раствора становится более светлым. Затем снимают колбу с электрической плитки, вносят в нее пипеткой 10 мл 0,01 н раствора щавелевой кислоты и хорошо перемешивают. Раствор обесцвечивается за счет того, что щавелевая кислота вступает в реакцию с избытком перманганата, оставшимся после окисления примесей воды. Обесцвеченный горячий раствор титруют 0,01 н раствором перманганата калия до появления светло-розовой окраски.
Таким образом, перманганат калия прибавляют к исследуемой воде 2 раза (в начале опыта вводится 10 мл раствора и в конце опыта – при титровании). Это общее количество перманганата калия расходуется на окисление примесей воды и на окисление 10 мл раствора щавелевой кислоты (рисунок 9). Отдельным титрованием необходимо уточнить нормальность раствора перманганата калия. Для этого нагревают до кипения 100 мл дистиллированной воды, подкисленной 5 мл серной кислоты (1 : 3), снимают колбу с нагревательного прибора, добавляют 10 мл 0,01 н раствора щавелевой кислоты и титруют до светлорозовой окраски раствором перманганата калия.
KMnO4 |
H2C2O4 |
KMnO4 |
|
|||||||
Осталось в |
|
|
|
|
Оттитровали |
|
|
|
|
|
|
|
|
|
KMnO4 |
|
|
|
|
|
|
растворе |
|
|
|
|
|
|
|
|
|
|
Израсходовано |
|
|
|
|
Осталось в |
|
титрование |
|
Появилась розовая окраска |
|
|
|
|
|
|
|
Раствор бесцветный, |
||||
|
|
|
|
|
|
|
|
|
||
на окисле |
|
|
|
|
растворе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
идет нейтрализация |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Рисунок 1 – Схема химического взаимодействия растворов KMnO4 с H2C2O4 в ходе опыта
Необходимость такой проверки при каждом определении окисляемости объясняется тем, что 0,01 н раствор перманганата калия не стойкий и концентрация его изменяется во времени.
43

Сущность метода заключается в использовании перманганата калия в качестве сильного окислителя для разложения органических загрязнителей в исследуемой воде. Проба воды кипятится с заданным, заведомо избыточным, объемом KMnO4, после чего избыток KMnO4 нейтрализуется щавелевой кислотой.
Реакция окисления примесей перманганатом калия (КМnО4) проводится в кислой среде по реакции:
МnО4- + 8Н+ + 5е- → Мn2+ + 4Н2О
В щелочной или нейтральной среде ион Мn7+ переходит в Мn4+, образуя окись марганца – бурый осадок:
МnО4- + 2Н2О +3е- → МnО2↓ + 4ОН-
Избыток перманганата калия реагирует с вводимой в раствор щавелевой кислотой (Н2С2О4):
КМnО4 + Н2С2О4 + H2SO4 → MnSO4 + K2SO4 + СО2 ↑+ Н2О
В ионной форме: |
|
|
МnО4- + 8Н+ + 5е → Мn2+ +4Н2О |
|
2 |
|
||
С2О22- → 2CO2↑ + 2e- |
|
5 |
2МnО4- + 16Н+ + 5С2О22- → 2Мn2+ + 8Н2О + 10CO2↑ |
|
|
В молекулярной форме: |
|
|
2КМnО4 + 5Н2С2О4 + 3H2SO4 → 2MnSO4 + K2SO4 + 10СО2↑ + 8Н2О
Цель работы
Определить перманганатную окисляемость природной и сточной воды.
Химическая посуда, приборы и реактивы:
1. |
Электрическая плита |
|
2. |
Термостойкие конические колбы |
250 мл |
3. |
Пипетки |
5, 10, 100 мл |
4.Дистиллированная вода
5.Раствор перманганата калия КМnО4 0,01 н
6.Раствор щавелевой кислоты H2C2O4 0,01 н
7.Раствор серной кислоты H2SO4 (1 : 3)
Ход работы
100мл исследуемой жидкости (после 2-х часового отстаивания), отме-
ренные пипеткой, переносят в термостойкую коническую колбу емкостью 250 мл, добавляют 5 мл раствора серной кислоты (1:3), приливают, отмеренные пипеткой, 10 мл 0,01 н раствора перманганата калия, и, накрыв колбу часовым стеклом или воронкой, нагревают жидкость до кипения, кипятят в течение
42
Рисунок 3 – Подгруппы бактерий: 1 – кокк; 2 – диплококк; 3 – сардина; 4 – стрептококк; 5 – колония сферической формы; 6 – палочковидные бактерии (одиночная клетка и цепочка клеток); 7 – спириллы; 8 – вибрион; 9 – бактерии, имеющие форму замкнутого или незамкнутого кольца; 10 – бактерии, образующие выросты; 11 – бактерия червеобразной формы; 12 – бактериальная клетка в форме шестиугольной звезды; 13 – представитель актиномицетов; 14 – плодовое тело миксобактерии; 15 – нитчатая бактерия рода Caryophanon с латерально расположенными жгутиками; 16 – нитчатая цианобактерия; 17, 18 – бактерии с разными типами жгугикования; 19 – бактерия, образующая капсулу; 20 – нитчатые бактерии группы Sphaerotilus, заключенные в чехол, инкрустированный гидратом окиси железа; 21 – бактерия, образующая шипы; 22 – Gallionella sp., свободноживущие микоплазмы – клетки, имеющие бобовидную форму и которые на вогнутой стороне выделяют гидроокись железа в коллоидной форме
7

На рисунке 4 представлена микробная система, в составе которой видны: Oscillatoria, Spirulina, Microcoleus, Synechococcus, Phormidium и кокковые сине-
зеленые водоросли. Такие экосистемы характерны для местообитаний с высоким содержанием органического вещества, как, например, на сооружениях очистки сточных вод.
Рисунок 4 – Микробная система (полоска 6 мкм)
Питание
Бактерии бывают автотрофами и гетеротрофами. Автотрофы («сами себя питающие») не нуждаются в веществах, произведенных другими организмами. В качестве главного или единственного источника углерода они используют его диоксид (CO2). Включая CO2 и другие неорганические вещества, в частности аммиак (NH3), нитраты (NO–3) и различные соединения серы, в сложные химические реакции, они синтезируют все необходимые им биохимические продукты.
Гетеротрофы («питающиеся другим») используют в качестве основного источника углерода (некоторым видам необходим доксид углерода CO2) органические (углеродсодержащие) вещества, синтезированные другими организмами, в частности сахара. Окисляясь, эти соединения поставляют энергию и молекулы, необходимые для роста и жизнедеятельности клеток. В этом смысле гетеротрофные бактерии, к которым относится подавляющее большинство прокариот, сходны с человеком.
Главные источники энергии
Если для образования (синтеза) клеточных компонентов используется в основном световая энергия (фотоны), то процесс называется фотосинтезом, а способные к нему виды – фототрофами. Фототрофные бактерии делятся на
8
Лабораторная работа №8 Определение перманганатной окисляемости воды
Окисляемость воды – это условная величина, характеризующая загрязнение воды различными легко окисляющимися веществами, главным образом органического происхождения, а также легко окисляющимися некоторыми неорганическими примесями (Н2S, Fe2+, сульфитов, нитритов и др.).
Для вычисления окисляемости, относящейся только к органическим примесям воды, вводят поправку на окисление неорганических легко окисляющихся веществ. Отдельно определяют содержание железа (Fe2+, сульфидов, нитритов). Затем, зная, что на окисление 1 мг Fe2+ расходуется 0,14 мг кислорода, 1 мг Н2S – 0,47 мг кислорода, а 1 мг NO2 – 0,35 мг кислорода, делают соответствующие пересчеты, вычитая из величины общей окисляемости количество кислорода, окисляющее неорганические примеси.
Перманганатная окисляемость показывает, какое количество кислорода необходимо для окисления легко окисляемых органических и неорганических соединений, присутствующих в воде. При определении перманганатной окисляемости окислителем является перманганат калия КМnО4. Степень окисления перманганатом калия зависит от химической природы окисляемых веществ и может колебаться в широких пределах.
При загрязнении вод промышленными стоками перманганатная окисляемость не отражает полного содержания органических загрязнений в воде. В этом случае определяют бихроматную окисляемость – содержание всех органических и неорганических веществ в воде, в том числе и трудно окисляемых. Бихроматная окисляемость называется также химическим потреблением кислорода (ХПК) и характеризует количество кислорода, необходимое для окисления всех видов загрязнений, присутствующих в исследуемой воде.
Биохимическая окисляемость или биохимическое потребление кислорода (БПК) – это количество кислорода, расходуемое икроорганизмами при разложении органических веществ, находящихся в воде.
Окисляемость выражается в миллиграммах кислорода, необходимого для окисления примесей, содержащихся в 1 л воды. В чистых родниковых и артезианских водах окисляемость обычно составляет 1,0-2,0 мг О2/л.
Окисляемость речной воды колеблется в широких пределах. Для определения величины перманганатной окисляемости применяется титриметрический метод.
41

Х= (V1 +V2 −V3 ) N Э 1000 , мг/л,
V4
где N – нормальность раствора трилона Б;
Э – миллиграмм – эквивалент иона SО42- (48); V4 – объем исследуемой воды.
Результаты анализа записывают в виде таблицы:
№ опыта |
Объем раствора трилона Б, мл |
Содержание сульфат-ионов |
||||
V1 |
V2 |
V3 |
мг/л |
мг-экв/л |
||
|
||||||
Контрольные вопросы и задания
1.В составе каких соединений встречаются сульфаты в природных водах?
2.Каким образом попадают сульфатные ионы в воду?
3.Каким образом влияет повышенное содержание сульфат-ионов на качество воды?
4.Назовите требования ГОСТа 2874-73 по содержанию сульфатов в питьевой воде.
5.В чем заключается сущность комплексонометрического метода определения сульфатных ионов?
6.Назовите реактивы, применяемые при анализе воды, и объясните их назначение.
7.С какой целью кипятят анализируемый образец воды?
8.Объясните необходимость многоразового титрования образцов с трилоном Б.
9.Что называется нормальностью раствора?
10.Какую массу медного купороса СuSO4·5Н2О и воды надо взять для приготовления раствора сульфатов меди (II) массой 40г с массовой долей СuSO4 2%?
11.В воде массой 40 г с массовой долей FеSO4·7Н2О массой 3,5 г. Определить массовую долю сульфата железа (II) в полученном растворе.
12.Какой объем раствора серной кислоты плотностью 1,8 г/мл с массовой долей Н2SO4 88% надо взять для приготовления раствора кислоты объемом 300мл и плотностью 1,3 г/мл с массовой долей Н2SO4 40%
40
фотогетеротрофов и фотоавтотрофов в зависимости от того, какие соединения – органические или неорганические – служат для них главным источником углерода.
Фотоавтотрофные цианобактерии (сине-зеленые водоросли), как и зеленые растения, за счет световой энергии расщепляют молекулы воды (H2O). При этом выделяется свободный кислород и образуется водород, который, можно сказать, превращает диоксид углерода (CO2) в углеводы. У зеленых и пурпурных серных бактерий световая энергия используется для расщепления не воды, а других неорганических молекул, например сероводорода (H2S). В результате также образуется водород, восстанавливающий диоксид углерода, но кислород не выделяется. Такой фотосинтез называется аноксигенным.
Если основной источник энергии в клетке – окисление химических ве-
ществ, бактерии называются хемогетеротрофами или хемоавтотрофами в за-
висимости от того, какие молекулы служат главным источником углерода – органические или неорганические. У первых органика дает как энергию, так и углерод. Хемоавтотрофы получают энергию при окислении неорганических веществ, например водорода:
2H4 + O2 → 2H2O,
железа:
Fe2+ - é → Fe3+
серы:
2S + 3O2 + 2H2O → 2SO4 2– + 4H+,
углерода:
СO2+ 4Н. → С + 2H2O
Эти организмы называют также хемолитотрофами, подчеркивая тем самым, что они «питаются» горными породами.
Дыхание
Клеточное дыхание – процесс высвобождения химической энергии, запасенной в «пищевых» молекулах, для ее дальнейшего использования в жизненно необходимых реакциях. Дыхание может быть аэробным и анаэробным. Для аэробных бактерий необходим кислород. Он нужен для работы так называемой электронотранспортной системы: электроны переходят от одной молекулы к другой (при этом выделяется энергия) и в конечном итоге присоединяются к кислороду вместе с ионами водорода – образуется вода.
Анаэробным организмам кислород не нужен, а для некоторых видов он даже ядовит. Высвобождающиеся в ходе дыхания электроны присоединяются к другим неорганическим акцепторам, например нитрату, сульфату или карбонату, или (при одной из форм такого дыхания – брожении) к определенной органической молекуле, в частности к глюкозе.
9
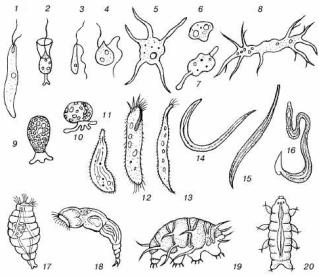
Простейшие
Это группа микроскопических одноклеточных, но иногда объединенных в многоклеточные колонии организмов. Все простейшие – эукариоты, т.е. их генетический материал (ДНК), находится внутри окруженного оболочкой клеточного ядра, что отличает их от прокариотных бактерий, у которых оформленное ядро отсутствует.
Основные группы
Форма и строение клеток простейших весьма разнообразны; для некоторых групп характерны поверхностные чешуйки, раковины и даже сложно устроенные твердые скелеты. Однако по способу передвижения свободноживущих (не паразитических организмов) их можно разделить на три главные группы (рисунок 5):
-жгутиковые, передвигающиеся с помощью немногих, но длинных нитевидных придатков (жгутиков);
-ресничные (инфузории), использующие для этой цели обычно многочисленные, но короткие волосовидные структуры (реснички);
-амебоидные (корненожки), «перетекающие» по твердому субстрату благодаря изменениям формы клетки.
Рисунок 5 – Микрофауна: 1-4 – жгутиковые; 5-8 – голые амебы; 9-10 – раковинные амебы; 11-13 – инфузории; 14-16 – круглые черви; 17-18 – коловратки; 19-20 – тихоходки
10
Поскольку в исследуемой воде присутствуют ионы Са2+ и Mg2+, также взаимодействующие с трилоном Б, то необходимо ввести соответствующие поправки на эти ионы.
Реактивы:
1.Соляная кислота 0,1 н раствор
2.Метиловый красный
3.Раствор хлористого бария
4.Раствор хлористого магния
5.Трилон Б 0,01 н раствор
6.Едкий натр 0,1 н раствор
7.Аммиачный буферный раствор
8.Эрихром черный Т (Эх4-Т)
9. |
Колбы конические |
250 см3 |
10. |
Пипетки мерные |
1 см3, 2 см3, 100 см3 |
11. |
Бюретка |
25см3 |
12. |
Плитка электрическая |
|
Ход определения
В коническую колбу емкостью 250 см3 вносят с помощью пипетки 50 см3 исследуемой воды, прибавляют 2-3 капли раствора индикатора метилового красного и подкисляют раствором соляной кислоты до розовой окраски индикатора.
Затем полученный раствор кипятят в течение 3-5 мин., для удаления углекислоты. К кипящему раствору прибавляют пипеткой 1 мл раствора хлористого бария, содержащего ионы магния (10г ВаСl·2Н2О и 4г МgСl2·6Н2О в 1 л) и снова кипятят в течении 10-15 с. Присутствие в растворе ионов Mg2+ необходимо для более четкого определения конца титрования трилоном Б.
Часть ионов Ва2+ расходуется на связывание ионов SО42- в сульфат бария, а часть остается. Через 10-15 мин. исследуемую воду нейтрализуют 0,1н раствором едкого натра, прибавляя его осторожно по каплям (до перехода красной окраски индикатора в желтую). Затем вводят 5мл аммиачного буферного раствора, несколько капель индикатора эрихрома черного Т и титруют 0,5 н раствором трилона Б (V3). В отдельной пробе определяют объем раствора трилона Б (V1), необходимый для титрования 1 мл раствора хлористого бария, содержащего ионы Mg2+. В другой отдельной колбе исследуемой воды в объеме 50 мл определяют объем раствора трилона Б(V2), необходимый для титрования ионов
Са2+ и Mg2+.
Содержание ионов SО42- вычисляют по формуле:
39
