
- •Пәннің оқу-әдістемелік кешені
- •Мазмұны
- •1 Глоссарий
- •Мен табиғаты»
- •2. Коллоидты жүйелердің молекулалы-кинетикалық қасиеттері
- •4.Коллоидты ерітінділердің тұрақтылығы
- •Тақырыбы «Коллоидты жүйелердің электрлік қасиеттері» Жоспар
- •2 Микромодуль «Беттік құбылыстар. Дисперсті жүйелердің тұрақтылығы»
- •Және тазалау әдістері»
2. Коллоидты жүйелердің молекулалы-кинетикалық қасиеттері
Броундық қозғалыс. 1827 жылы ағылшын ботанигі Р. Броун гүл тозаңдарының сулы суспензиясын микроскопта көре отырып, олардың үздіксіз ретсіз қозғалыста болатындығын және ол қозғалыстың уақыт өте келе тоқтамайтындығын және сыртқы энергия көздеріне тәуелді емес екендігін бақылаған. Коллоидты және микрогетерогенді жүйелердегі бөлшектердің жылулық қозғалысы броундық қозғалыс деп аталды. Броун анықтай алмаған бұл құбылыстың табиғатын көптеген зерттеушілер кейіннен тозаңның тіршілік әрекетімен, жүйеде конвекциялық ағындардың болуымен, электрлік құбылыстармен, ортаның бөлшектердің бетін әр түрлі шылауымен түсіндіруге тырысты. Бірақ мұның бәрі дұрыс болмады. Тек 1888 жылы Гуи және 1900 жылы Экснер броундық қозғалыстың молекулярлы – кинетикалық табиғаты бар екендігі, яғни жылулық қозғалыс салдарынан болатындығы туралы ұйғарым жасады. Бұл ұйғарымның дұрыстығы Энштейн мен Смолуховскийдің теориялық есептеулерімен, Перрен, Сведбергтің эксперименттік жұмыстарымен дәлелденді. Қазіргі кезде коллоидты бөлшектердің бұл қозғалысы жылулық қозғалыста болатын орта молекулаларының коллоидты бөлшектерді ретсіз соққылауы салдарынан туындайтыны анықталды.
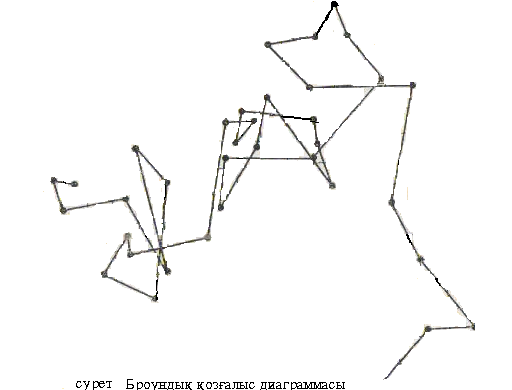
1-сурет. Броундық қозғалыс диаграммасы
Егер бөлшек өлшемі айтарлықтай кішкентай болса, оған жан-жағынан келетін соққылар саны бірдей емес болып, бөлшек өте кұрделі траектория бойынша әр түрлі бағытта қозғалады. Бөлшек өлшемі мен массасы артқан сайын, соққылардың компенсациялану ықтималдығы да артып, бөлшек инерциясы да үлкен болады. Осылайша, өлшемі 5 мкм шамасындағы үлкен бөлшектер белгілі-бір орталық маңайында толқындық (колебательные) қозғалыстарға ие болады. Ал бөлшек диаметрі 5 мкм жоғары болса, броундық қозғалыс тоқтайды.
Орта
молекулаларының өте көп соққылауы
салдарынан коллоидты бөлшектер өз
бағыты мен жылдамдығын өте жиі өзгертеді.
1секундта коллоидты бөлшек өз бағытын
1020
–нен артық өзгертуі мүмкін. Мұндай
жағдайларда коллоидты бөлшектің шын
мәніндегі жүрген жолын анықтау мүмкін
емес, бірақ оның уақыт бірлігінде жүріп
өткен орташа қашықтығын анықтау оңай.
Әдетте бөлшектің белгілі бір бағыттағы
қозғалысын білу қызығушылық тудыратындықтан
(мысалы: диффузия жүретін бағытта), онда
сандық есептеулер үшін ығысудың
(смещение) өзін емес, таңдап алынған
бағытқа параллель х осіне бөлшектің
ығысу проекциясының орташа квадраттық
мәнін алады. Бөлшектің ығысу проекциясының
орташа арифметикалық мәнін қолдану
мүмкін емес, себебі бөлшектің барлық
бағыт бойынша қозғалу ықтималдылығы
тең болғандықтан, ол нөлге тең. Ығысу
проекциясының орташа квадраттық мәні
мынадай теңдеу арқылы табылады:
![]() МұндағыΔ1,
Δ
2
, Δ
3
– т.с.с. х осі бойынша бөлшектер ығысуының
жеке проекциялары; n – есептеуге алынған
осындай проекциялар саны.
1888
жылы Гуи, 1900 жылы Экснер броундық
қозғалыстың табиғаты молекулалық-кинетикалық
теорияға, яғни жылу әсерінен пайда
болатын қозғалысқа негізделуі мүмкін
деген пікір айтты. Бұл пікір Эйнштейн
және Смолуховский есептеулері арқылы
дәлелденіп, Перрен және Сведберг
зерттеулеріндегі асқан дәлдікпен
жүргізілген тәжірибелер кезінде нақтылы
деректермен толықтырылды. Көптеген
тәжірибелер броундық қозғалыс зат
табиғатына тәуелсіз, ал бөлшектің
өлшеміне, ол орналасқан ортаның
температурасы мен тұтқырлығына тәуелді
екенін көрсетті. Еріткіш молекулаларының
тынымсыз соққылауы салдарынан да
дисперсті фазаның бөлшектері ретсіз
қозғалысқа түседі. Әрбір бөлшектің
қозғалысы немесе белгілі мерзімдегі
орын ауысып жылжуы қақтығысудың орташа
мәні ретінде қабылданды. Мысалы, бір
бөлшек бір секундта шамамен 1020
қақтығысуға душар болады екен. Бөлшек
өте кішкене болса, оның жан-жағынан
немесе әр тұсынан тиетін соққы саны
бірдей бола бермейді және кеңістіктегі
мұндай бөлшек өте күрделі ізбен
(траекториямен) жылжиды. Егер дисперсті
фазадағы бөлшектің өлшемі мен массасы
белгілі бір шектен асып кететін болса,
онда қақтығысулардың бірін-бірі жою
мүмкіндігі арта түседі. Сондықтан да
өлшем 4-5 ммк болатын бөлшектер өте жай
тербелмелі қозғалыста болады. Ал бөлшек
мұнан ірі болса, броундық қозғалыс
байқалмайды.
МұндағыΔ1,
Δ
2
, Δ
3
– т.с.с. х осі бойынша бөлшектер ығысуының
жеке проекциялары; n – есептеуге алынған
осындай проекциялар саны.
1888
жылы Гуи, 1900 жылы Экснер броундық
қозғалыстың табиғаты молекулалық-кинетикалық
теорияға, яғни жылу әсерінен пайда
болатын қозғалысқа негізделуі мүмкін
деген пікір айтты. Бұл пікір Эйнштейн
және Смолуховский есептеулері арқылы
дәлелденіп, Перрен және Сведберг
зерттеулеріндегі асқан дәлдікпен
жүргізілген тәжірибелер кезінде нақтылы
деректермен толықтырылды. Көптеген
тәжірибелер броундық қозғалыс зат
табиғатына тәуелсіз, ал бөлшектің
өлшеміне, ол орналасқан ортаның
температурасы мен тұтқырлығына тәуелді
екенін көрсетті. Еріткіш молекулаларының
тынымсыз соққылауы салдарынан да
дисперсті фазаның бөлшектері ретсіз
қозғалысқа түседі. Әрбір бөлшектің
қозғалысы немесе белгілі мерзімдегі
орын ауысып жылжуы қақтығысудың орташа
мәні ретінде қабылданды. Мысалы, бір
бөлшек бір секундта шамамен 1020
қақтығысуға душар болады екен. Бөлшек
өте кішкене болса, оның жан-жағынан
немесе әр тұсынан тиетін соққы саны
бірдей бола бермейді және кеңістіктегі
мұндай бөлшек өте күрделі ізбен
(траекториямен) жылжиды. Егер дисперсті
фазадағы бөлшектің өлшемі мен массасы
белгілі бір шектен асып кететін болса,
онда қақтығысулардың бірін-бірі жою
мүмкіндігі арта түседі. Сондықтан да
өлшем 4-5 ммк болатын бөлшектер өте жай
тербелмелі қозғалыста болады. Ал бөлшек
мұнан ірі болса, броундық қозғалыс
байқалмайды.
Коллоидты системаны микроскоп арқылы бақылағанда, ондағы белгілі бір бөлшекті х деп белгілеп, оның траекториясын анықтасақ, ол көрсетілгендей болады да белгілі мерзімдегі орташа жылжуы ∆х-ке теңеледі. Бұл түрлі бағыттағы көптеген қозғалыстың статистикалық нәтижесі немесе көлеңке іспеттес проекциясы. Ал броундық қозғалыстағы бөлшектің шын мәніндегі траекториясын молекулалардікіндей дәл көріп бақылау мүмкін емес, өйткені олар өте көп. Ондағы әрбір бөлшек тек бір секундтың өзінде есепсіз соқтығысып, өз бағытын есепсіз өзгертеді. Ал адам өте үлкейтілген бөлшектің бір секундтағы тек 10 шақты қозғалысын көре алады екен. Сондықтан броундық қозғалыс теориясына газ молекуласына қолданылып келген орташа квадраттық жылжу деген ұғым енгізілді. Ол көрсетілгендегідей бөлшектің t уақытта А мен В жағдайға өзгеруі. Кейде оны орташа проекция деп те атайды. Бөлшектің орташа жылжуының (∆х) уақыт пен диффузия коэффициентіне тәуелділігі Эйнштейн теңдеуімен өрнектеледі:
∆х2
=
2Dt; ∆x =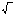 2Dt
(34)
2Dt
(34)
мұндағы ∆x – орташа жылжуы; ∆х2 – орташа квадраттық жылжу; t – жылжуға кеткен уақыт; D- диффузия коэффициенті. Дисперсті ортадағы молекуладан үлкен өлшемде болатын дисперсті шар тәрізді бөлшектің диффузия коэффициентінің мәні былай анықталады:
D = RT / NA•1 / 6πηr (35) Соңғы екі теңдеудің коллоидты химиядағы мәні ерекше. Онда диффузия коэффициентін анықтау арқылы шар тәрізді коллоидты бөлшектің радиусын есептеуге және сол сияқты жоғарғы молекулалық қосылыстардың шамасын өлшеуге болады. Ал бөлшек күрделі пішінді болса, соңғы теңдеудің оң жақтағы соңғы мүшесі (6πηr) біршама күрделенеді. Ол үшін (2) теңдеудегі диффузия коэффициентінің мәнін оның алдыңдағы (1) теңдеуге қойып, бөлшектің орташа жылжуын есептейді:
∆x= 2RT/
NA
•1 / 6πηr • t =
2RT/
NA
•1 / 6πηr • t =
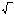 RT/
NA•
t / 3πηr (36)
RT/
NA•
t / 3πηr (36)
Броундық қозғалысты жан-жақты зерттеген Перрен өз тәжірибесінде алған мәліметтерге сүйеніп және математик Ланжевенің көмегімен Авогадро санының (NA) мәнін дәл анықтайды. Броундық қозғалыс тек коллоидты химияны, табиғаттану ілімдерін дамытып қана қоймастан, жалпы диалектикалық, материалистік көзқарастың дұрыстығын, ғылымилығын дәлелдеді.
Диффузия
дегеніміз жүйедегі молекулар, иондар
немесе коллоидты бөлшектердің хаосты
жылулық қозғалысының әсерінен олардың
концентрациясының өздігінен теңесу
процесі. Яғни диффузия молекулалардың
жылулық қозғалысының макроскопиялық
көрінісі, сол себепті температура
жоғарылаған сайын, диффузия да тез
жүреді. Диффузия қайтымсыз процесс, ол
концентрацияның толық толық теңесуіне
дейін жүреді, себебі бөлшектердің хаосты
таралуы жүйенің максималды энтропиясына
сәйкес келеді. 1885
жылдан бастап Нэрнст диффузияның пайда
болу себебін осмостық қысыммен
түсіндірген?
Диффизия
нәтижесінде массаның тасымалдануы жылу
мен электрдің тасымалдану заңдылықтарына
ұқсас. Осы ұқсастықты пайдалана отырып,
1855 жылы Фик диффузияның бірінші заңын
ұсынды:
![]() (1)
Мұндағы:
m – диффузияланған зат мөлшері;
D –
диффузияланатын бөлшектер және орта
қасиеттеріне тәуелді диффузия
коэффициенті;
dc/ dx – концентрация
градиенті;
(1)
Мұндағы:
m – диффузияланған зат мөлшері;
D –
диффузияланатын бөлшектер және орта
қасиеттеріне тәуелді диффузия
коэффициенті;
dc/ dx – концентрация
градиенті;
s – диффузия өтетін аудан;
τ – диффузия ұзақтығы;
Теңдеудің оң бөлігіндегі минус таңбасы dc/ dx туындысы теріс мәнге ие болатындықтан қойылып отыр, себебі х-тің мәні жоғарылаған сайын, концентрация c шамасы төмендейді. (1) – ші теңдеуден төмендегідей түрде де беруге болады.
![]() (2)
і
д
–диффузияның меншікті ағымы деп аталатын
шама. Ол аудан бірлігіне тең көлденең
қима арқылы уақыт бірлігінде диффузия
нәтижесінде тасымалданатын зат мөлшерін
сипаттайды.
(2)
і
д
–диффузияның меншікті ағымы деп аталатын
шама. Ол аудан бірлігіне тең көлденең
қима арқылы уақыт бірлігінде диффузия
нәтижесінде тасымалданатын зат мөлшерін
сипаттайды.
Егер концентрация градиенті тұрақты болса, диффузиялық ағын уақыт өте келе өзгермей, жүйеде стационарлық диффузия процесі орнығады. Бұл жағдай үшін мына теңдеуді жазуға болады.
![]() dc/dx=-1,
s=1 және τ=1
деп алсақ,
dc/dx=-1,
s=1 және τ=1
деп алсақ,
m=D,
яғни, концентрация градиенті 1-ге тең
болған жағдайда диффузия коэффициенті
уақыт бірлігінде аудан бірлігі арқылы
диффузияланған зат мөлшеріне тең, және
ол см2/сек-пен
өлшенеді. Алайда диффузия өте баяу
жүретіндіктен уақыт бірлігі ретінде
секунд емес тәулік алынады.
1908 жылы
Эйнштейн D диффузия коэффицентін Т
жүйенің абсолютті температурасымен, η
дисперсиялық орта тұтқырлығымен және
r дисперсті фаза бөлшегінің радиусымен
байланыстыратын теңдеуді қорытып
шығарды.
![]() Эйнштейн
теңдеуі
Эйнштейн
теңдеуі
K= R / NA – пропорционалдық коэффиценті
Формасы
сфера тәріздіге ұқсас бөлшектер үшін
В = 6πηr
тең болғандықтан:
![]() Мұндағы
В- бөлшек және орта арасындағы үйкеліс
коэффициенті.R
– универсал газ тұрақтысы;
Мұндағы
В- бөлшек және орта арасындағы үйкеліс
коэффициенті.R
– универсал газ тұрақтысы;
Т – абсолюттік температура;
NA – Авагадро саны;
η – ортаның динамикалық тұтқырлығы;
r – бөлшек радиусы;
π – осмостық қысым;
Теңдеуден көріп отырғанымыздай диффузия коэфициенті абсолютті температураға тура пропорционал, ал орта тұтқырлығы мен бөлшек радиусына кері пропорционал. Коллоидтық бөлшектер өлшемі қарапайым молекулар өлшемімен салыстырғанда өте үлкен болғандықтан, коллоидты жүйедегі диффузия коэффициенті төмен болады. Эйнштейн теңдеуін пайдалана отырып, егер D, Т, η белгілі болса, 1 моль заттың массасын анықтай аламыз. Ол үшін алдымен бөлшек радиусын есептеу керек.
r = kT / 6πηD
1 моль зат үшін оның массасы келесі теңдеумен анықталады
М = 4/3 π r3ρ NA
ρ – әдетте белгілі дисперсті фаза тығыздығы.
Яғни
диффузия коэфициентін өлшеу арқылы
(сан жағынан 1 моль зат массасына) тең
заттың молекулалық массасын анықтауға
болады.
Шынайы ерітіндідегі диффузияның
өту себебі молекуланың жылулық
қозғалысымен байланысты. Ал коллоидты
жүйелердегі дисперсті фаза диффузиясының
пайда болу себебі де, бөлшектердің
броундық қозғалысымен тікелей байланысты.
Броундық қозғалыс пен диффузия арасында
байланыс болғандықтан, ығысу проекциясының
орташа квадраттық мәні
![]() және
диффузия коэффициенті D арасында да
байланыс болу керек. Бұл байланысты бір
– бірінен тәуелсіз түрде 1905 жылы
Эйнштейн, ал 1906 жылы Смолуховский
анықтады.
және
диффузия коэффициенті D арасында да
байланыс болу керек. Бұл байланысты бір
– бірінен тәуелсіз түрде 1905 жылы
Эйнштейн, ал 1906 жылы Смолуховский
анықтады.
![]()
Эйнштейн – Смолуховский негізін қалаған коллоидты жүйелердегі броундық қозғалыс теориясы дисперсті жүйе табиғатын, осы жүйелердің молекулярлы – кинетикалық қасиетінің ортақтығын түсіндіретін бірінші сандық теория болып табылады. Броундық қозғалысты зерттеу флуктуация теориясының пайда болуына және статистикалық физиканың дамуына әсерін тигізді. Флуктуация дегеніміз жүйенің айтарлықтай кіші көлемінде қандай да бір параметрдің тепе-тең орташа мәннен өте жоғары дәрежеде өздігінен (спонтанно) ауытқуы. Флуктуацияларға физикалық шамалар (тығыздық, концентрация, т.б.), биологиялық шамалар (өсімі, тіршілік ұзақтығы, т.б.), әлеуметтік–экономикалық шамалар (берілген жердегі халық тығыздығы, тауар бағасы) ұшырауы мүмкін. Флуктуацияның жалпы теориясының негізін 1902 жылы американ ғалымы Гиббс қалады.
Дисперсті фазаның бөлшектері молекулалық-кинетикалық қозғалыс салдарынан кездейсоқ қозғалыстарға да душар болады. Алайда берілген көлемдегі бөлшектер концентрациясы әр түрлі болса, мәселен, ыдыстың түбіндегі бөлшектер концентрациясы оның бетіндегіден артық болса, онда осы бөлшектердің төменнен жоғарыға қарай қозғалуынан гөрі керісінше жоғарыдан төменге қарай ауысуы артық болатыны анық. Әрине, мұндай қозғалысты ауысулар берілген көлемдегі концентрация мәні теңелгенше жүреді, ал басқа қозғалыстар тоқтаусыз жалғасады.
Иондардың, молекулалардың немесе коллоидты бөлшектердің ретсіз жылулық қозғалыс ( коллоидты системалар үшін броундық қозғалыс) кезіндегі концентрацияны теңестіру бағытында өздігінен жүретін процесін диффузия деп атайды. Демек, диффузия өздігінен жүретін процесс ретінде барлық дисперсті системалар үшін, газдарға арналған Фик заңына бағынады. Фиктің бірінші заңына байланысты диффузия жылдамдығы өзі диффузияланатын аудан мен концентрациялық градиентке тура пропорционалды:
dm/dt = −DS dC/dx
Мұндағы dm – диффузияланған зат массасы; dt – шексіз аз уақыт; S - берілген зат диффузияланған аудан; dC/dx − концентрация градиенті немесе концентрация кемуі; dC − концентрция; dx − концентрациясы кеміген бөлік; D − диффуізия коэффициенті, ол әрбір дисперсті системаның диффузиялану қабілетін сипаттайды. Бұл коэффициент концентрация градиенті 1-ге тең болғанда бір шаршы сантиметр ауданнан 1 сек-та диффузияланып өткен масса мөлшерін көрсетеді. Егер диффузия процесі кезінде диффузия коэффициенті өзгеретін болса, онда оған орай концентрция градиенті де өзгереді. Олай болса уақытқа байланысты концентрация өзгерісінің жылдамдығын, яғни dC/dt туындысын анықтау керек. Ол Фиктің екінші заңын өрнектейтін теңдеумен анықталады:
dC/dt = Dd2C /dx2
Фиктің екі заңын қолдану кезіндегі негізгі қиындық көп уақытқа дейін диффузия коэффициентінің мәнін табу болып келеді. Алайда бұл коэффициентті анықтау қиындығы Эйнштейн броундық қозғалысты зерттегенде оны (1) теңдеудегі орташа жылжумен байланыстырғалы жеңілденді. Эйнштейн сұйыққа арналған Стокс заңын пайдаланып, диффузия коэффициентінің дисперсті ортаның тұтқырлығы мен бөлшек радиусына тәуелділігін анықтады. Қазір коллоидты ерітіндідегі бөлшектің өлшемін анықтаудағы диффузиялық әдіс бірден-бір нақтылы нәтиже беруде.
Коллоидты системадағы броундық қозғалыс пен диффузияны зерттеу дисперсті системаның табиғатын тереңірек түсінуге көмектесіп, осы система мен молекулалық дисперсті системалар арасындағы молекулалық-кинетикалық орта қасиеттерін анықтайды. Сөйтіп, бұлар молекулалардың бар екенін оның материялығын айқындаумен қатар, табиғаттану ілімін материалистік тұрғыдан түсінуге өз септігін тигізеді.
Броундық қозғалысты онан әрі зерттеу флуктуация теориясы деп аталатын жаңа бағыттың пайда болуына әкеледі. Флуктуация деп тығыздықтың, концентрацияның немесе системадағы микрокөлемнің орташа мәнінен оның параметрлерінің өздігінен ауытқуын айтады. Мысалы, Сведберг флуктуация құбылысын байқау кезінде, алтын золіндегі 1000 ммк3-де орналасқан коллоидты бөлшекті (алтынды) санайды. Ондағы бөлшектің орташа саны өзгеріп отырған. Диффузия да, флуктуация да жылулық қозғалыстың нәтижесінен болғанымен, олар біріне-бірі кері құбылыс екен. Егер диффузия термодинамиканың екінші заңына орай кез келген өздігінен жүретін процесс кезінде қайтымсыз болса, онда бұған кері жүретін флуктуация құбылысы термодинамика екінші заңының статистикалық сипатын көрсетеді, яғни оны жекелеген бөлшектерге немесе олардың аз санына қолдануға болмайды.
Осмостық қысым
Шынайы ерітінділердің осмостық қысымын Нолле ашты. Бір жағы жабық, екінші жағында шала өткізгіші бар, шыны түтікті қант ерітіндісімен толтырып, түтікті суға батырғанда ондағы ерітіндінің көлемінің жоғарылайтындығын байқаған. Себебі, шала өткізгіш арқылы су түтік ішіне өтеді. Мұндай құбылысты осмос, ал осмосты тудыратын күштерді осмостық қысым деп атайды.
Айтарлықтай сұйытылған коллоидты ерітіндінің осмостық қысымын төмендегі теңдеу арқылы табуға болады
![]() Мұндағы:
mжалпы
– еріген
зат массасы
Мұндағы:
mжалпы
– еріген
зат массасы
m – бөлшек массасы
V – жүйе көлемі
NA – Авагадро саны
Т – абсолюттік температура
ν - сандық концентрация
Бұл теңдеу шынайы ерітінділердің осмостық қысымын табуға арналған Вант – Гофф теңдеуімен ұқсас:
![]()
Мұндағы: М – 1 моль еріген заттың массасы
с - салмақтық концентрация
Екі теңдеудегі айырмашылық тек 1моль еріген зат массасы мен бөлшек массасында. Шынайы ерітінділермен салыстырғанда лиозольдердің осмостық қысым мәні төмен және тұрақсыз болады. Бірдей температуралық жағдайлардағы осмостық қысымдары π1 және π 2 екі жүйе үшін былай жазуға болады: π1 =ν1 (RT/ NA)
π 2 = ν2 (RT/ NA)
Теңдеулерді бір – біріне бөлсек, π1 / π 2 =ν1 / ν2
Дисперсті
фаза табиғаты және салмақтық концентрациясы
бірдей, бірақ бөлшек өлшемінде айырмашылық
бар екі коллоидты жүйе үшін:
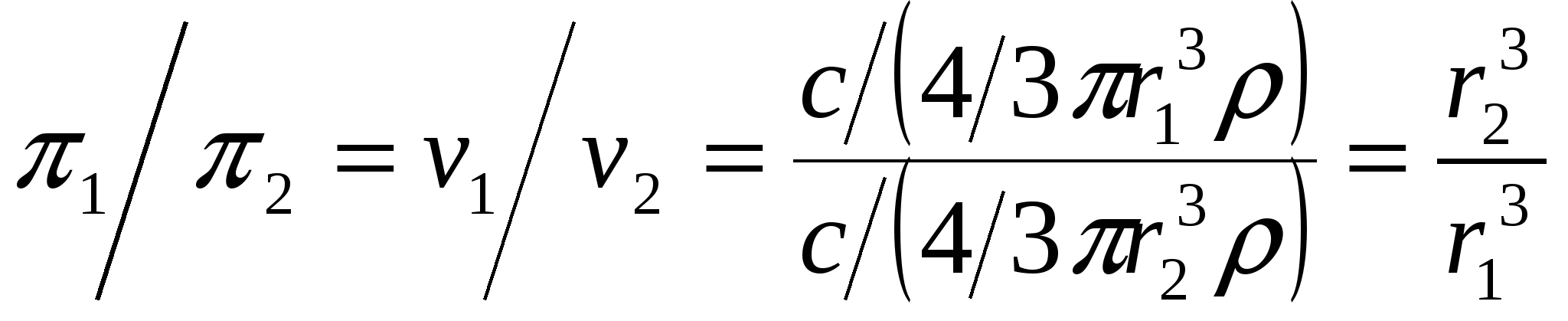 Мұндағы:
r1
және
r2
-
1 – ші және 2-ші жүйелердегі бөлшектер
радиусы, ρ-дисперсті
фаза тығыздығы.
Мұндағы:
r1
және
r2
-
1 – ші және 2-ші жүйелердегі бөлшектер
радиусы, ρ-дисперсті
фаза тығыздығы.
Агрегация және дезагрегация процестері коллоидты жүйелерде тіпті әлсіз сыртқы әсердің өзінен жылдам жүретіндіктен лиозольдердегі осмостық қысымның тұрақсыздығы осымен түсіндіріледі. Лиозольдердегі осмостық қысым мәні төмен және тұрақсыз болғандықтан, коллоидты бөлшектер өлшемін немесе сандық концентрациясын анықтауда осмометрия, эбулиоскопия, криоскопия әдістері қолданылмайды.
Коллоидты ерітінділерге нағыз ерітіндідегідей осмостық қысым тән. Ол да газ қысымы секілді ерітіндінің коллигативті (біріккен, орташа) қасиеті екен, яғни ол тек еркін қозғалатын коллоидты бөлшектерге ғана тәуелді. Егер коллоидты бөлшектірдің көлемі мен массасының нағыз ерітінділердегі молекула көлемі мен массасынан үлкен екенін ескерсе, онда бірдей көлемдік концентрациядағы коллоидты және нағыз ерітінділерді алып, белгілі бір көлеміндегі коллоидты бөлшекті және молекуланы салыстырғанда, коллоидты бөлшектер аз болады. Мінекей, сондықтан да бірдей концентрациядағы коллоидты ерітіндінің осмостық қысымы нағыз ерітіндімен салыстырғанда аз болады. Мысалы, массалық концентрациясы 10 г/л болатын алтын золінің осмостық қысымы 45 Па, осындай концентрациядағы сахароза ерітіндісінің осмостық қысымы 7250 Па. Сондай-ақ , гидрофобты коллоидты ерітіндідегі өлшенетін осмостық қысымының бір бөлігі қосымша электролиттердің кездесуімен байланысты болады.
Коллоидты ерітінділер нағыз ерітінділерге өте ұқсас болғандықтан, оған Вант-Гофф формуласын қолдануға болады:
ПV = nRT немесе П = nRT/V
мұндағы П – зольдің осмостық қысымы; n- колоидты бөлшектердің мольдік өлшемі; V- зольдің көлемі. Коллоидты бөлшектің мольдік өлшемі деп Авогадро саны қабылданады.
Егер берілген зольде ν коллоидты бөлшек болса, онда 1 мольде NA бөлшек бар. n=ν/ NA ескерсек, (39) теңдеу:
ПV = (ν / NA)RT, П = ν / V· RT/ NA
болады.
Коллоидты ерітінділердің бәрі дерлік өте төменгі бу серпімділікпен сипатталып, қайнау температурасы мен қату (кристалдану) температуралары төменгі мәнге, кейде мүлдем өлшеуге келе бермейтін шамаға ғана өзгереді. Мысалы, бөлшек өлшемі 4нм, концентрациясы 0,001% алтын золінің қату температурасы 0,000 0040 – қа ғана төмендейді екен.
Осмостық қысым (П) берілген бірлік көлемдегі бөлшек саны (п) мен коллоидты бөлшектердің орташа радиусы (r) арасындағы белгілі бір байланысты табуға септеседі. Ұсақталған заттың бірлік көлемдегі массасы:
m = 4/3 πr3dn,
мұндағы d- ерітінді тығыздығы. Осы теңдеуге негіздей, бірдей температура мен дисперстік ортадағы екі дисперсті системаға арнап, келесі өрнекті жазуға болады:
4 /3 πr31dn1= 4 /3 πr32dn2 немесе r31n1 = r32n2
П1 / П2 = n1 /n2 = r3 2 / r3 1 = D3 1 / D3 2
мұндағы D1 және D2 – бірінші және екінші зольдің дисперстік дәрежелері.
Демек, коллоидты ерітінділердің осмостық қысымы, олардағы бөлшек радиусының кубына кері пропорционалды да, дисперстік дәрежесінің кубына тура пропорционалды екен.
Седиментация
Диффузияны қарастырған кезде біз жүйеге гравитациялық өрістің (тартылыс күші) әсерін есепке алған жоқпыз. Массасы айтарлықтай үлкен бөлшектерге гравитациялық өріс әсер ететіндіктен олар тұнбаға түседі, тұнады немесе седиментацияланады. Микрогетерогенді жүйелер-эмульсиялар, суспензиялар, газ эмульсиялары, аэрозольдерде броундық қозғалыс болмайтындықтан, седиментация немесе оған қарама қарсы процесс - қалқып шығу жүреді. Осының нәтижесінде жүйеде бөлшектер биіктік бойынша белгілі-бір тепе-теңдік таралады немесе, бөлшектер ауыр болса, олар тұнбаға түседі. Дисперсті жүйенің көлем ішінде бөлшектердің біркелкі таралуын қамтамасыз ету қабілеті жүйенің седиментациялық немесе кинетикалық тұрақтылығы деп аталады. Яғни седиментациялық тұрақтылық немесе тұрақсыздық туралы айту тек босдисперсті жүйелерді қарастырғанда ғана орынды болады, себебі, әр бөлшек еркін және жылулық қозғалыста болады.
Ірі дисперсті жүйелер (шаң, тозаң, немесе судағы құм суспензиясы) седиментациялық тұрақсыз және тұнбаға түседі, себебі олардың бөлшектері ауыр болғандықтан оларға жылулық, яғни броундық қозғалыс тән емес. Жоғары дисперсті жүйелер (газдар, шынайы ерітінділер) жоғары кинетикалық тұрақтылыққа ие, себебі оларға жылулық қозғалыс және диффузияға қабілеттілік тән. Коллоидты жүйелер (аэрозольдер, лиозольдер) тұрақтылығы бойынша екеуінің арасынан орын алады.
Диффузияның немесе седиментацияның дисперсті жүйенің кинетикалық тұрақтылығына қалай әсер ететінін қарастыру үшін диффузия ағыны және оған қарсы бағытталған седиментация ағын салыстыруға болады iD →ic. Меншікті диффузиялық ағын мына теңдеумен анықталады.
![]() (1)
(1)
Тұрақты жылдамдықпен тұнатын бір бөлшек үшін үйкеліс күші Вu ауырлық күшіне (қозғалтқыш күшке) mg тең tекенін ескерсек, онда меншікті седиментациялық ағын төмендегі теңдеумен өрнектеледі.
![]() (2)
(2)
![]()
u–седиментацияжылдамдығы; с–концентрация m–бөлшектің тиімді массасы
B – коллоидты бөлшек пен диспесті орта аралығындағы үйкеліс коэффициенті g–еркін құлау үдеуі
Екі
теңдеуді бір-біріне бөлсек, және
![]() екендігін
ескерсек,
екендігін
ескерсек,![]() (3)
(3)
υ– бөлшек көлемі;
ρ, ρ – дисперсті фаза мен дисперсті орта тығыздықтары
iС / iД›› 1 болса, тек седиментация процесін есепке аламыз (өтеді деп есептейміз);
iС / iД ‹‹ 1 болса, тек диффузия процесін есепке аламыз;
iС / iД ≈ 1, яғни iС ≈ iД болса, екі процесті де есепке алу қажет. Бұл жағдайда дисперсті фаза бөлшектері жүйеде биіктік бойынша белгілі-бір тәртіппен таралады.
(3) –ші теңдеуден мынадай қорытынды шығаруға болады, алдын-ала араластыру нәтижесінде дисперсті фазасы көлемде біркелкі таралған жүйенің тұрақтылығын қарастыратын болсақ, алғашқы уақытта әрқашан седиментация басым болады, себебі, алғашында dc/dx=0. Алайда уақыт өткен сайын заттың жүйеде біркелкі таралуы бұзылып, dc/dx туындысының мәні арта береді. Массатасымалы iС / iД ≈ 1, яғни iС ≈ iД болғанша және жүйеде тепе-теңдік орнағанша жалғасады. Концентрация градиенті биіктік бойынша өзгеретінін ескерсек, х- ті h-қа өзгертіп, (3) –ші теңдеуді былайша жазуға болады
![]() (4)
(4)
Осы
теңдеуді былайша да жазуға болады.
![]() (5)
(5)
с0-ден сh- қа дейін, сәйкесінше 0-ден h-қа дейін интегралдап мына теңдеуді аламыз.
![]() (6)
немесе
(6)
немесе
![]() (7)
(7)
Егер (6) –шы теңдеудегі с орнына р қойсақ, белгілі барометрлік формуланы аламыз.
![]() (8)
(8)
Биіктік бойынша газ молекулаларының таралуы осы гипсометриялық заңға(8) бағынады.
Дисперсті фаза концентрациясы с сандық концентрацияға ν пропорционал болғандықтан, бұл теңдеуді былай етіп те көрсетуге болады.
![]() (9)
Бұдан
(9)
Бұдан
![]() (10)
(10)
Бұл теңдеу арқылы кез-келген босдисперсті жүйе үшін h мәнін есептеп табуға болады. h дегеніміз сандық концентрация (немесе салмақтық концентрация) ν0 ден νh-қа дейін немесе ν0 / νh есе төмендейтіндей биіктік. Мысалы концентрация қандай биіктікте екі есе азаятынын білгіміз келсе, ν0 / νh=2 деп алып h мәнін есептеуге болады.
Жүйеде бөлшектердің тепе-тең таралуына мынадай факторлар кедергі келтіруі мүмкін: болмашы соққы, шайқау, зольдің әр учаскесінде температураның біркелкі болмауы. Мысалы жоғарыдисперсті золь температурасы 1 сағат ішінде 0,0010С-ге ауытқуының өзі, алтынның жоғарыдисперсті золінде мүлдем седиментацияны болдырмай тастайды.
Қалай дегенмен, жүйеде бөлшектер таралуының тепе-тең күйі орнағаннан кейін лиозольдер үшін гипсометриялық заң дәл сақталады. Мұны гуммигут суспензиясымен тәжірибе жасаған Перрен және алтын золімен тәжірибе жасаған Вестгрен NA мәнін анықтай отырып, дәлелдеді.
Ауырлық
күшінің әсерінен бөлшектердің тұнбаға
түсу процесін седиментация
деп
атайды. Тұнбаға түсу жылдамдығы
бөлшектердің көлеміне, тығыздығына,
ортаға, сұйықтыққа және ауырлық күшінің
уақытына тәуелді. Стокс заңы бойынша
қозғалу кезінде бөлшектер сфералық
тұтқыр ортада қарсылық күшін сезеді,
ол тең
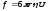
мұндағы,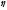 - орта тұтқырлығы,
- орта тұтқырлығы,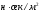 ,
r – бөлшек радиусы, м.
,
r – бөлшек радиусы, м.
U – тұнба түсу жылдамдығы, м/сек, Басқа жақтан бөлшекке күш әсер етеді.
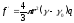
мұндағы,
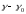 - дисперсті ортадағы бөлшектер тығыздығының
айырымы, кг/м3
- дисперсті ортадағы бөлшектер тығыздығының
айырымы, кг/м3
q – ауырлық күшінің жылдамдығы, м/сек2
 тең
болғанда және тұрақты температурада
тұнбаға тұрақты түсу жылдамдығына
жетеді
тең
болғанда және тұрақты температурада
тұнбаға тұрақты түсу жылдамдығына
жетеді
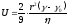
Бөлшектердің тұнбаға түсу жылдамдығын бөліп алып, оның радиусын есептейміз.
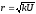
мұндағы,
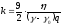 берілген суспензияға тұрақты шама.
берілген суспензияға тұрақты шама.
Тұнбаға
түсу жылдамдығы бөлшек радиусына
тәуелді. Мысалы, саз бөлшегінің 1∙10-5
м радиусты 1см-ге 43сек.уақыт өтеді, ал
2∙10-6
м радиуста 17 минут, 1∙10-8м
радиуста – 500 күн кетеді. Егер бөлшек
 тығыздықта
қозғалатын болса, онда оның қозғалысы
төменнен жоғарыға, ал зат бөлшегінің
тығыздығы
тығыздықта
қозғалатын болса, онда оның қозғалысы
төменнен жоғарыға, ал зат бөлшегінің
тығыздығы немесе орта тығыздығына
немесе орта тығыздығына тәуелді болады.
тәуелді болады.
Суспензияда
 және бөлшектер тұнбаға түседі, эмульсияда
және бөлшектер тұнбаға түседі, эмульсияда сондықтан бөлшектер қалқып шығады.
Мысалы, судағы саздың тұнуы, сүттегі
қаймақтың түзілуі жатады.
сондықтан бөлшектер қалқып шығады.
Мысалы, судағы саздың тұнуы, сүттегі
қаймақтың түзілуі жатады.
Бөлшектердің толық түсуі ауырлық күшінің әсерінен болмайды, өйткені оған қарсы броундық қозғалыс әрекет етеді, яғни ол бөлшектерді ерітіндінің барлық көлеміне тең бөлуге тырысады. Броун қозғалысының әсері көп әсер етеді, егер бөлшектің көлемі кішкентай болған жағдайда.
Егер бөлшектердің негізгі бөлігі қысқа мерзімде тұнса, онда ондай жүйені кинетикалық тұрақсыз деп атайды, ал егер бөлшектер ұзақ мерзім ішінде тепе-тең бөлінсе, оны кинетикалық тұрақты жүйе деп атайды.
Суспензия мен эмульсиялар – бұлар кинетикалық тұрақсыз жүйе, ал коллоидты жүйе мен ерітін ділер жоғарғы молекулярлы – кинетикалық тұрақты.
Седиментация процесі кинетикалық тұрақсыз жүйе – суспензияға тән.
Кинетикалық тұрақты тұнуды қарапайым жағдайда түзуге болады, егер жердің ауырлық күшінің центрге тартқыш күші жоғары болса. Центрифуга арқылы центрге тартқыш күшті алуға болады, 105 есе артық ауырлық күші бар және бөлшектің тұну жылдамдығын сонша есе жылдамдатуға болады. Центрифугат қолдану арқылы коллоид пен жоғарғы молекулярлы ерітінділерге седиментация жүргізуге болады.
Седиментациялық анализ тұнған бөлшектердің жылдамдығын өлшеуге негізделген. Тәжірибеде кездесетін суспензия қарапайым полидисперсті, онда әртүрлі көлемдегі бөлшектер болады. Седиментация процесі өндірісте қолданылады. Тұну жылдамдығын бақылау бөлшектердің салмақтық, сандық анықтауға әртүрлі көлемдегі полидисперсті жүйедегі мүмкіндік береді. Бұл принципке сүт сепараторының жұмысы негізделген, яғни сүттен қаймақты айыру процесі. Сепарация процесі (айыру) центрлік тартқыш күш арқылы тез өтеді, сүттің сол қалпында тұрғанына қарағанда.
Седиментацияны қолдану центрге тартқыш өріс арқылы жоғарғы молекулярлы ерітінділердегі бөлшектердің көлемін анықтайды.
Сұйық не газды ортадағы ұнтақталған заттың бөлшектері қарама-қарсы бағытталған екі күштің әсерінде болады. Олардың біріншісі бөлшекті төмен тартып, тұнбаға немесе шөгіндіге түсіруге бағытталған ауырлық күш, ал келесі бөлшектерді берілген көлемде біркелкі таратуға ұмтылған, яғни бөлшек концентрациясы мол жақтан, аз жаққа қарай ауысуына әсер ететін өздігінен жүретін диффузиялық күш. Дисперстік системаға әсер ететін ауырлық және диффузиялық күштің қайсысының басым болуына байланысты оның күші анықталады: ауырлық күші артық болса, ондайда дисперсті системаның бөлшектері көбірек шөгеді, ал диффузиялық күш басым болса, онда дисперстік системадағы бөлшектер тұнбаға түспей жүзгін түрінде болады. Осы айтылғандарға орай, дисперсті фазаның система көлемінде біркелкі таралып, тұрақты күйде болуын седиментациялық немесе кинетикалық тұрақтылық деп атайды, ал ауырлық күші әсерінен бөлшектердің тұнбаға түсу процесі седиментация деп аталады. Системадағы бөлшектердің тұнбаға түсу жылдамдығы осы бөлшектердің өлшеміне, дисперстік ортаның тұтқырлығына және бөлшек тығыздықтарына тәуелді:
υ= 2/3 · r2 (d-d) g / η
мұндағы υ- бөлшектердің тұнбаға түсу жылдамдығы; r- бөлшек радиусы; d және d0- дисперсті бөлшек пен дисперстік ортаның тығыздықтары; η- дисперстік ортаның тұтқырлығы; g- еркін түсу үдеуі.
Дисперсті фаза өте ұсақ болса диффузия жылдамдығы үлкен болады. Ал олар іріленген сайын диффузия жылдамдығы баяулайды. Бөлшектің радиусы 2 нм-ден үлкен болса, броундық қозғалыс байқалмайды, демек олардың диффузиялық қабілеті нөлге тең. Мұнда ауырлық күші диффузиялық күштен басым.
Егер дисперсті системадағы ауырлық күші мен диффузия күші өзара тең болса, онда седиментация мен диффузия жылдамдықтарының тепе-теңдігімен сипатталатын седиментациялық тепе-теңдік деп аталатын күй орнайды. Мұндайда берілген дисперсті системаның бірлік өлшемі арқылы ауырлық күшінің әсерінен төменқарай қанша бөлшек өтсе, диффузиялық күш ықпалынан жоғарыға қарай сонша бөлшек өтеді. Осындай седиментациялық тепе-теңдік коллоидты системаға ғана емес, молекулалық-дисперстік системалар үшін де тән құбылыс. Сондай-ақ бұл тепе-теңдік системадағы бөлшек концентрацияларының уақыт өткен сайын баяу болса да төменнен жоғарыға қарай кеми беретіндігімен де сипатталады. Сұйық бағанасындағы бөлшектер өзінің өлшеміне сәйкес әртүрлі биіктікте, айталық ірілері төмен, ал ұсақтары жоғары орналасады екен. Бұл құбылысты сипаттау үшін Лапластың гипсометриялық немесе барометрлік заңын коллоидты системаға пайдалануға болады: золь бағанасының биіктігін арифметикалық прогрессияда көбейткенде, бөлшек концентрациясы геометриялық прогрессияда кемиді. Бұл заңдылықты математикалық тұрғыдан өрнектесек:
h = RT ln C1/С2 / M·g
мұндағы C1 – берілген биіктіктегі дисперсті системаның концентрациясы; С2 – осы системаның h биіктіктегі концентрациясы; h- өлшентін бағ- өлшентін бағана биіктігі; М- заттың салщыстырмалы молекулалық массасы; g- еркін түсу үдеуі. Әуелде Лапластың гипсометриялық заңы газ тәрізді және молекулалық-дисперстік системаларға арналып тұжырымдалған болатын. Бертін келе Перрен оны коллоидтық-дисперстік, тіпті ірі дисперстік системаларға қолданды. Осы мақсатпен Перрен радиустері әртүрлі көптеген шариктер әзірлеп, оларды өлшеміне орай сұрыптап, дисперстік ортаны да белгілі сипатта даярлап, көптеген тәжірибелер жүргізді. Олардың нәтижесі Лаплас заңына қайшы келмеді. Сонымен, ол әртүрлі биіктіктегі бөлшектердің санын анықтай келіп, Авогадро санының мәнін асқан дәлдікпен табуға болатынын көрсетті.
Перрен өз тәжірибелерінің нәтижесінде басқа да әдістер мен теңдеулер көмегімен анықталған Авогадро санының мәнінен алшақ емес, қанағаттанарлықтай дерек алды. Олай болса Перрен еңбектеріндегі зерттеулер тек молекулалық-кинетикалық теорияның дұрыстығын дәлелдеп қана қоймай, оны коллоидтық-дисперстік системаларға да қолдануға болатынын бұлжытпай, ешбір шүбәсіз дәлелдеп берді.
Коллоидты системалардың реологиялық қасиетіне системадағы дисперстік фазаның концентрациясымен қатар, дисперстік орта мен дисперстік фаза табиғаты секілді факторлар күшті әсер етеді. Олай болса, коллоидты системалардың реологиялық қасиеттері осы жоғарыда айтылған себептерге байланысты туындайтындықтан, бір жағынан соларға, екіншіден әлгі фактордың өзіне әсер ететін молеклалық әрекеттесуді де қарастырады.
Бағытталған механикалық жүк дисперстік системадағы бөліктердің жылжуын тудырады. Оның екі түрі болуы мүмкін: жүк тұрақты әсер еткенде система нүктелері жылжуын тоқтатады; системаға сыртқы күш әсер етіп тұрған кезде тұрақты система бөлшектері үнемі қозғалыста болады. Бірінші жағдайда бөлшектердің салыстырмалы жылжуы мен сыртқы механикалық күштер арасындағы тәуелділік сипаты анықталады. Екінші жағдайда ағымдылық деп аталатын сыртқы күш әсерінен бөлшектердің салыстырмалы жылжу жылдамдығының тәуелділігі анықталады. Деформация мен тұрақты ағымдылық жылдамдығы арасындағы тепе-теңдік белгілі бір уақыт өткен соң орнайды. Система өзінің соңғы күйіне келетін уақытты зерттеудің теориялық және қолданбалық мәні зор. Коллоидты системаның реологиялық қасиетін зерттей отырып, олардың құрылымының пайда болу сипаты анықталады және мұның практикалық мәні зор. Мысалы, жер қыртысы және оның құнарлығы, кірпіш өңдірісіндегі балшық қасиеті, цемент ерітіндісі, түрлі бояулар, лактар, пасталар, қамыр, май сияқтылардың бәрі де реологиялық және құрылымдық-механикалық қасиетпен сипатталады.
Реологиялық қисықтар және құрылымдау. Сұйық заттардың тұтқырлығын өлшейтін аспап вискозиметр деп аталатыны физикадан белгілі. Коллоидты системалардың вискозиметрлік зерттеуін график арқылы көрсетуге болады. Әдетте, мұндай графиктің екі түрі бар: олардың біреуі ығысу кернеуі τ (немесе оған пропорционал шама) мен жылдамдық градиенті Е (немесе оған пропорционал шамалар), ал келесісі тұтқырлық – ығысу кернеуі координатында тұрғызылады. Әдетте, ығысу кернеуіне тура пропорционал шама ретінде капиллярлі вискозиметрдегі қысым теңдеуі, ротационды вискозиметрдегі жіптің бұралу моменті, Хепплер вискозиметріндегі шариктің салмағы және басқалар пайдаланылады. Ал, жылдамдық градиентіне тура пропорционал шама ретінде капиллярлі вискозиметрдегі цилиндрдің бұрыштық жылдамдығы, Хепплер вискозиметріндегі шарик жылдамдығы алынады.
Жоғарыда айтылған координатқа орай болатын реологилық қисықтар көруге болады. Олар су және бейорганикалық тұздардың, қышқылдардың, негіздердің, глюкозаның, сахарозаның судағы ерітінділері және бензин, бензол, спирт сияқты сұйықтарға тән. Олардың тұтқырлығы түзу сызықтың котангенсті көлбеулік бұрышына тура пропорционал. Олардың тұтқырлығы тұрақты болғандықтан, ол абцисса осіне паралелль түзу сызық арқылы сипатталады. Және ондағы түзу реті ерітінділердегі, сұйықтағы тұтқырлықтың артуына сәйкес орналасқан.
Мұндай сұйықтарды ньютондық немесе идеал тұтқыр деп атайды. Демек, тұтқырлығы ығысу кернеуіне немесе жылдамдық градиентіне тәуелді системалардағы сұйықтарды ньютондық дейді екен. Оған жоғары молекулалық қосылыстар ерітінділері және анизодиаметрлік бөлшектері бар дисперсті системалар жатады.
Тұтқыр сұйықтар вискозиметр арқылы өткенде жылу бөлінеді. Мұндай механикалық энергияның жылулыққа түрленуін вискозиметрлік өлшеу кезінде ескерген жөн. Сұйықтар аққандағы энергетикалық шығындарды талдай білу дисперстік фазаның сұйық тұтқырлығына ықпалын анықтауға көмектеседі. Шар тәрізді қатты бөлшектерден құралған дисперстік фазасы бар коллоидты система аққан кезде әлгі бөлшектердің ағу жылдамдығы бұрыштық жылдамдықтың жартысындай шамаға тең болады. Мұндай жағдайда энергия ілгерілмелі және айналмалы қозғалысқа жұмсалады. Ендеше, дисперстік фазаның көлемі артқан сайын системаның тұтқырлығы да артуы керек. Бұл қатынастың сандық сипатын анықтайтын теңдеуді 1906 жылы А. Эйнштейн ұсынды:
η = η0 (1 + 2,5 φ) (60)
мұндағы η – дисперстік система тұтқырлығы; η0 – дисперстік ортаның тұтқырлығы; φ – дисперстік фазаның көлемі.
Жоғарыдағы теңдеуді Эйнштейн теңдеуі дейді және ол анизодиаметрлік бөлшектері бар дисперстік фазаларға қолдана бермейді. Мұндай бөлшектер ығысу жылдамдығы төмендегенде сұйықта ресіз (броундық қозғалыс) айналады. Ондағы бөлшектердің біразы ағу жолында көлденең тұрып қалуы мүмкін және мұның салдарынан дисперстік ортаның тұтқырлығы артады. Жылдамдық жоғарылағанда, бөлшектер ағыс бағытына сәйкес орналасады да системаның тұтқырлығы азаяды. Тұтқырлықтың жылдамдық градиентіне мұндай тәуелділігі ньютондық емес сұйықтарға тән.
Дисперстік системаның тұтқырлығына диспрстік фазадағы бөлшектердің өзара әрекеттесуі де ықпалын тигізеді. Бұл, әсіресе ұзын не созылған бөлшектері бар системалар үшін жоғары дәрежелікпен сипатталады. Мұндай бөлшектердің беткі қабатының кейбір жерінде адсорбциялық немесе сольваттық қабаттар жоқ; молекулааралық әрекеттесу салдарынан бөлшектер осы бос жерлер арқылы түйісіп, жабысады. Олар толық жанасайын десе, оған беткі қабаттың қалған бөліктерінде орналасқан қорғаушы қабаттар кедергі болады. Осылайша, өзінде қозғалмайтын (иммобилденген) сұйығы бар агрегаттар пайда бола бастайды.
Система баяу жылдамдықпен аққанда, бөлшектер арасындағы ажырап қалған іліністер қайтадан жалғасып, система тұтқырлығы артады. Ал, керісінше, ағымның жоғары жылдамдықта болуы қайтадан ілінісуге кедергі жасайды және ондағы құрылымдар бұзылады да, бұл тұрақтанған сұйық көлемін және тұтқырлығын кемітеді. Мұндай системалар үшін реологиялық қисықтарда тұтқырлықтың тұрақты екібөлігі болады. Оның біріншісі әлі бұзылмаған, ал екіншісі толық бұзылған құрылымдарға сәйкес. Олардың арасында ауыспалы тұтқырлық бөлігі орналасады және ол түрлі дәрежедегі құрылымның бұзылуына орай келеді.
Системадағы бөлшектер өзара әрекеттескенде сұйық көлемін «көктеп өтетін» ұзын тізбек пайда болады. Ондағы туындайтын құрылым үш өлшемді тор секілді. Бұрын да ескергендей, тіпті кішкентай жылдамдық градиентіне сәйкес болатын шамалы ғана ығысу кернеуінде де бөлшектер бекітілген орнында-ақ бұрылуға бейім, мұны басқаша айтқанда, тор түйініндегі бөлшек бұрылып, система ағымын қамтамассыз етеді.
Құрылымның пайда болуын зерттеу тұрақтылық және дисперстік системаны тұрақтандыру мәселелерімен байланысты. Сонымен дисперстік системаларға жоғары молекулалық қосылысты енгізу арқылы үш өлшемді тор түйінінде дисперстік фаза бөлшегі орналасатын құрылымды тудыруға болады. Бұл тор системадағы агрегаттық тұрақтылықты қамтамассыз етіп, бөлшек қозғалысын шектейді. Олай болса, системадағы құрылымның пайда болуы, оның агрегаттық тұрақтылығын кемітеді.
Бөлшектердің концентрациясы өскен сайын олардың арасындағы байланыстар да артады. 10-суретте дисперстік фазаның концентрациясына байланысты реологиялық қисықтардың тәуелділігі кескінделген. Ал бөлшектер арасындағы байланыстар реологиялық қисықтардың бастапқы кезінде ғана айтарлықтай ықпал етеді. Сол сияқты байланыс саны көбейіп, ығысу кернеуі төмендегенде системаның ағымы әлсірейді. Тек жоғарғы ығысу кернеуі кезінде ғана ағым жылдамдығы көтеріледі. Мұндай система ағымының едәуір жылдамдығы бар сәттегі ең кіші ығысу кернеуін шекті ығысу кернеуі деп атайды. Шектіден аз ығысу кернеуі системада серпімді деформацияны тудырады. Мұндай жағдайда системаның құрылымдануы өзін қатты денеше ұстайды. Сондықтан да П. Ребиндер құрылымдық системаны сұйық тәрізді, ағымдық шегі бар системалар деуді ұсынды.
