
юрин физиология растений
.pdf
Изучение феномена Н -секреции растений потребовало совершенствования методических подходов с учетом особенностей морфологического строения растительных клеток и их функциональной активности в составе органов.
Величина рН внутри растительной клетки зависит не только от вида, но и в пределах одной клетки определяется клеточными компартментами: вакуоль, цитоплазма, органелла и т. д. Величи- на рН вакуолярного сока варьирует в широких пределах, но в большинстве видов равна 4—6 единицам. Более стабилен рН цитоплазмы и находится в пределах от 6,6 до 7,5; вероятнее величи- на не ниже 7,0, так как при более низких значениях рН становятся неустойчивыми НАДН и НАДФН.
Для поддержания стационарного уровня рН в цитоплазме и других компартментах клетки существует несколько механизмов: буферные системы (фосфатный, карбонатный, органические кислоты
èих соли, аминокислоты), биохимический рН-стат (реакции декар-
боксилирования — кислый рН, карбоксилирования — щелочной рН) и биофизический рН-стат (функционирование Н -АТФазной помпы).
АТФаза плазмалеммы отличается по своему строению от АТФ-
синтетазы митохондрий, как и от АТФазы тонопласта.
Выход ионов Н , связанный с работой Н -АТФазы плазмалеммы, — активный процесс. Он может быть как электрогенным, так
èнейтральным.
Схема функционирования электронейтральной помпы представлена на рис. 5.8.
Когда стехиометрия переноса ионов не равна 1 : 1, помпа функционирует в электрогенном режиме.
Сегодня очевидно, что одна из функций Н -АТФазы плазмалеммы — регуляция внутриклеточного рН, другая — использование созданной силы í , движущей протон для вторичного транспорта веществ
|
|
í RT/FlnÑíâ/Ñíâ ì í ì. |
(5.14) |
|
В последнем случае перенос веществ осуществляется в соответствии со схемой, представленной на рис. 5.9.
Н -движущая сила может создаваться либо путем увеличенияÍ (адицифицирующая способность), либо в результате повышения ì (перенос заряда — Н ). На плазматических мембранах растений существуют и другие АТФазы, роль которых связана с переносом минеральных веществ.
282
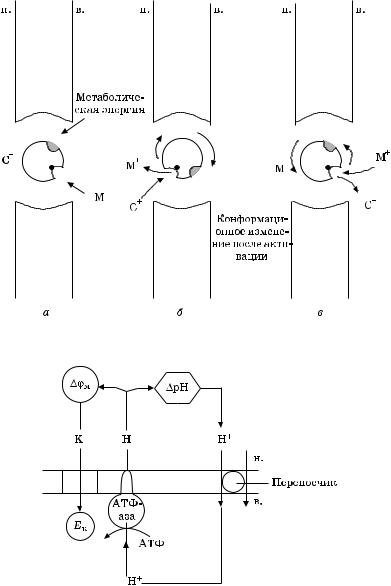
Ðèñ. 5.8. Схема функционирования электронейтральной ионообменной помпы:
à — активация; á — переориентация; â — релаксация
Ðèñ. 5.9. Схематическое изображение вторичного активного транспорта
283
К таким АТФазам можно отнести Са2 -АТФазу. Считают, что Са2 -АТФаза вместе с Н -АТФазой и редокс-цепью плазмалеммы может относиться к числу систем, участвующих в формировании электрогенного компонента потенциала.
Вопрос о Na -/K -АТФазе остается открытым. Сообщения о наличии Na -/K -АТФазы у растений появились в начале 1970-х гг. Они касались как целых органов растений, так и мембранных препаратов. Но в основном эта АТФаза, по мнению многих исследователей, характерна для мембран галофитов, т. е. растений, устойчивых к засолению, которым необходимо противостоять сильному засолению и осуществлять удаление Na из клеток.
Сегодня продолжают существовать крайние взгляды на присутствие Na -/K -АТФазы у высших растений. В соответствии с одной точкой зрения, эта ферментативная система отсутствует, с другой — она имеется во всех растениях, но у многих видов находится в скрытом состоянии и ее функционирование зависит от влияния определенных условий.
Редокс-цепь плазмалеммы и ее роль в переносе ионов
Гипотеза о том, что электрогенный транспорт Н через плазмалемму клеток растений идет при участии редокс-цепи (ЭТЦ), хотя и высказывалась давно, но исследования в этом направлении получили развитие в 80-е гг. ХХ в. В рамках этой гипотезы предусматривается, что начальным звеном редокс-цепи выступают восстановленные пиридиннуклеотиды, а конечным акцептором электронов, как и в случае ЭТЦ митохондрий, является О2. Подтверждением такой гипотезы служат данные о возможности участия восстановленных пиридиннуклеотидов в электрогенезе растительных клеток, а также данные гистохимического анализа локализации компонентов редокс-цепи в плазмалемме и некоторые другие.
Исследования ЭТЦ плазмалеммы проводились по двум путям, которые можно подразделить на структурный и функциональный. Успехом первого направления явились те обстоятельства, что во фракциях плазматических мембран идентифицированы такие составные элементы ЭТЦ, как флавины, цитохромы b è ñ; выделен белковый комплекс, имеющий НАДН-оксидазную активность.
Успехи функционального направления весьма значительны: редокс-реакции выявлены в плазмалемме как фотосинтезирующих, так и гетеротрофных клеток, причем в значительном коли-
284
честве растительных объектов; при этом есть основания считать, что в плазмалемме даже одного и того же объекта может иметь место целый ряд отдельных редокс-активностей с различной специфичностью к пиридиннуклеотидам.
Таким образом, считают, что на плазмалемме растительных клеток функционирует редокс-цепь, которая состоит из флавопротеина и цитохрома b5, субстратом которого является НАДН (у ряда объектов и НАДФН).
Что касается участия ЭТЦ в работе электрогенной Н -помпы плазмалеммы и формирования метаболического компонента мембранного потенциала, то на этот счет у исследователей нет единого мнения.
Существует точка зрения, согласно которой редокс-цепь плазмалеммы является альтернативной Н -АТФазной электрогенной системе, которая осуществляет активный транспорт протона че- рез плазмалемму.
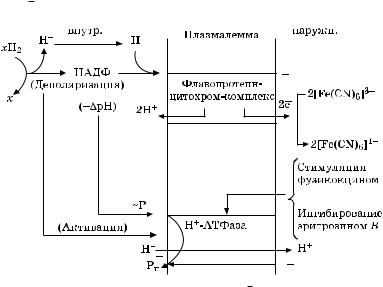
Однако есть и другой взгляд на эту проблему. Считают, что восстановление феррицианида и наблюдаемое при этом подкисление среды обусловлено двумя механизмами: первичным транспортом только е к феррицианиду, который приводит к деполяризации
Ðèñ. 5.10. Упрощенная схема потоков е и Н , связанных с восстановлением феррицианида, и взаимоотношений
между редокс-цепью плазмалеммы и АТФ-зависимым выделением Н
285
мембраны (за счет увеличения концентрации Н в цитоплазме), и последующим выходом Н , осуществляемым Н -помпой. Активация Н -АТФазы происходит за счет внутриклеточного подкисления и деполяризации.
Это подтверждается данными по действию ингибиторов Н - АТФазной активности эритрозином B, который сильно угнетал вызываемое феррицианидом подкисление среды, но мало влиял на процесс восстановления феррицианида (рис. 5.10).
Пиноцитоз
Процесс пиноцитоза впервые открыл У. Льюис в 1931 г. Пиноцитоз подразделяется на экзо- и эндоцитоз.
Экзоцитоз — это выделение содержимого, например пузырьками Гольджи, в наружную среду. Пример — выделение пузырьками Гольджи, отделяющимися от диктиосом, высокополимерных соединений (полисахара, пектины, слизи полисахаридной природы и т. д.) для построения клеточной оболочки растительных клеток. Диктиосомы чаще выявляются в местах интенсивного роста клеточных оболочек, например в кончиках корневых волосков и ризоидов, при образовании новых оболочек в трахеидах.
Эндоцитоз — процесс, противоположный экзоцитозу, хорошо изучен на уровне световой микроскопии у простейших. В этом случае мембрана выпячивается в сторону цитоплазмы и вещества входят внутрь клетки (рис. 5.11).
Дискуссионность процесса эндоцитоза у растений долгое время обусловливалась следующими причинами:
1.ограниченная проницаемость клеточной стенки к большим молекулам и частицам;
2.наличие тургора, особенно для вакуолизированных клеток, что препятствует формированию плазмалеммных инвагинаций;
3.отсутствие потребности в эндоцитозе для жизнедеятельности растений в связи с их автотрофностью.
Вот как разрешились эти проблемы:
1.В клеточных оболочках растений существуют водные поры размером до 10 нм. Таким образом, через клеточную оболочку могут проходить молекулы и частицы значительных размеров. Экспериментально наблюдали, что клетки корней разных растений, в том числе и корневые волоски, могут образовывать в значительных количествах пиноцитозные инвагинации и пузырьки. Корневые волоски, как оказалось, способны поглощать пиноцитозом и органи- ческие молекулы, что было показано на примере гемоглобина.
286
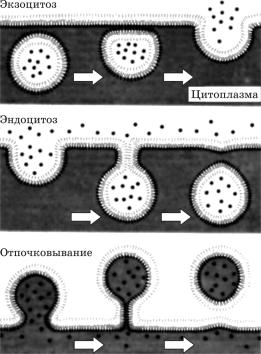
Ðèñ. 5.11. Транспорт макромолекул через плазматическую мембрану
2.Выявлено определенное влияние гидростатического давления на пиноцитозную активность, однако это влияние значительно меньше, чем считали раньше. Последнее подтверждается количеством образованных пузырьков в клетках поглотительной зоны корней при помещении их в слабоосмотические водные растворы солей, а также экспериментально показано наличие инвагинаций мембраны, как уже отмечалось в первом пункте.
3.Растительные клетки, в том числе и корневые, способны поглощать и метаболизировать низкомолекулярные органиче- ские соединения, на долю которых приходится значительная часть органических веществ почвы. Как показано во многих исследованиях, высшие растения имеют способность как к превращению экзогенных органических веществ в формы, доступные для поглощения пиноцитозным путем, так и обладают внутри-
287
клеточной способностью их метаболизации, т. е. органические вещества могут служить источником питания.
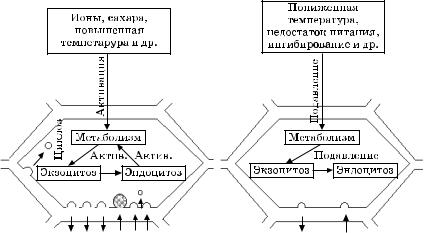
В общих чертах механизм пиноцитоза в растительных клетках может выглядеть следующим образом (рис. 5.12).
Ðèñ. 5.12. Схема зависимого от метаболизма сопряжения экзо- и эндоцитоза в растительной клетке
На первых этапах образование инвагинаций и пиноцитозных пузырьков инициируют сами индукторы пиноцитоза. Как установлено на модельных системах (липосомах), инвагинирование возникает в случае электростатического взаимодействия индуктора с полярными участками мембраны и/или в результате перекисного окисления мембранных липидов.
Все эти взаимодействия приводят к конформационным модификациям липидных молекул. Итак, первый этап — взаимодействие вещества и мембранных структур. Второй — инвагинация (впячивание) мембраны и образование пиноцитозного пузырька, а далее отрыв его от мембраны с затратой энергии АТФ. Третий — миграция пузырька внутрь или наружу. Четвертый — растворение мембраны пузырька (фермент) или просто разрыв мембраны (под действием осмотических сил).
Таким образом, пиноцитоз является преимущественно активным видом транспорта, поскольку необходима энергия, а сам процесс подавляется метаболическими ингибиторами, главным образом ингибиторами дыхания.
288
Есть примеры использования эндоцитоза как способа доставки в протопласты чужеродного генетического материала с целью получения растений с необходимыми полезными свойствами (биотехнологический подход).
5.5. Кинетика поступления минеральных веществ
При исследовании кинетики поступления ионов можно разделить транспорт по клеточным компартментам: клеточная оболоч- ка, плазмалемма и т. д. Экспериментально это можно сделать, перенося клетки или ткани из немеченного раствора в меченный и изучая кинетику поступления веществ. Движение в клеточной оболочке определяется шириной микрофибриллярного и межмицеллярного пространства, характером и концентрацией фиксированных ионных зарядов.
При изучении кинетики поступления (поглощения) резко выявляются две кинетически разные фазы. Первая — очень быстрая, с периодом полунасыщения (t1/2) около нескольких минут. Другая — медленная, которая наблюдается на протяжении нескольких часов с постоянной скоростью. Быструю первую фазу можно выявить и при изучении кинетики вымывания радиоактивных частиц из ткани. Как показано на рис. 5.13, дополнительные характеристики двух фаз можно получить, используя ингибиторы метаболизма или низкую температуру.
Ингибиторы или низкая температура блокируют только медленную фазу, которая, скорее всего, и контролируется живой цитоплазмой.
В первой фазе поступление растворенных веществ, вероятно, происходит очень быстро независимо от мембранного барьера; это свидетельствует о том, что определенная часть клетки или ткани легко доступна для движения частиц растворенных веществ. Поэтому такое поступление было названо поступлением в кажущееся свободное пространство (КСП).
Можно считать, что транспорт в КСП является пассивным процессом, обусловленным исключительно физическими движущими силами. Объем КСП составляет от 8 до 15 % общего объема ткани.
Для заряженных частиц КСП включает две составляющие, поскольку часть ионов, свободно находящихся в растворе, зани-
289
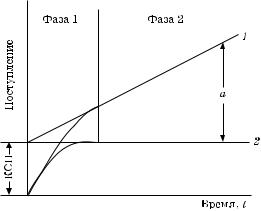
Ðèñ. 5.13. Поступление растворенных веществ |
к тканям растений: |
фаза 1 — проникновение в КСП; фаза 2 — накопле- |
ние в клетке; 1 — в обычных условиях; 2 — â ïðè- |
сутствии ингибиторов или при низких температурах; |
à — количество вещества, накопленное за время t |
мает пространство в клеточных оболочках, а часть связывается фиксированными заряженными местами в клеточной оболочке. В соответствии с этим выделяют водное свободное пространство (ВСП) и доннановское свободное пространство (ДСП):
ÊÑÏ ÂÑÏ ÄÑÏ.
Величина ДСП зависит от природы и плотности фиксированных зарядов в клеточной стенке. Например, в тканях столовой свеклы величина ДСП составляет 2 % от общего объема ткани. КСП ограничено только клеточными оболочками. В последние годы появился термин «апопласт», более подходящий, чем КСП. Апопласт — пространство, находящееся снаружи плазмалеммы, включает пространство клеточных стенок, а для многоклеточного организма и межклеточные пространства.
При изучении действия низких концентраций катионов в наружной среде на скорость поступления было отмечено, что при увеличении концентрации ионов (на примере K ) в среде поступление ионов в ткань растений достигает насыщения или максимальной скорости при концентрации 0,5—1,0 мМ (рис. 5.14).
290
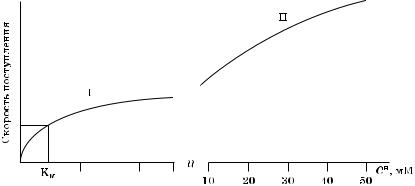
Ðèñ. 5.14. Зависимость поступления ионов в клетки растений от их концентрации в наружной среде
Тип поступления в этой области (до 1 мМ) определяется системой I (низкая константа сродства 0,02—0,03 мМ, т. е. высокое сродство системы к ионам, которые перемещаются через мембрану). Поступление ионов при низких концентрациях в окружающей среде подавляется низкими температурами, динитрофенолом (ДНФ) и другими ингибиторами. Это свидетельствует о том, что поступление в диапазоне концентраций, в которых действует система I, связано с активным транспортом (расходом энергии метаболизма).
Но растительные ткани все же не достигают насыщения в диапазоне концентраций свыше 1 мМ. Если значительно повышать концентрацию, то поток станет увеличиваться и в конце концов может достичь величины, во много раз превышающей максимальные величины системы I.
При этих высоких концентрациях скорость поглощения начи- нает медленно снижаться, наблюдается только тенденция к насыщению, обычно при концентрациях 50 мМ. Из анализа полученных данных сделан вывод, что транспорт ионов в диапазоне концентраций, в которых действует система II, не зависит от метаболизма и, возможно, пассивен.
Считают, что система I переноса ионов находится в плазмалемме. Что касается локализации системы II, то по этому вопросу существуют две точки зрения. Е. Эпстейн считает, что системы I и II локализованы в плазмалемме, а, по мнению К. Тори и Г. Летис, система II локализована на тонопласте.
291
