
- •Тема 1. «Основные понятия и законы химии»
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •Тема 2. «классификация и номенклатура неорганических веществ»
- •2.1.1. Определение и классификация оксидов
- •2.1.2. Номенклатура оксидов
- •2.1.3. Свойства оксидов
- •2.1.4. Получение оксидов
- •2.1.5. Закономерности изменения свойств высших оксидов
- •2.3.1. Определение и классификация кислот
- •2.3.2. Номенклатура кислот. Кислотные остатки
- •2.3.3. Свойства кислот
- •2.3.4. Получение кислот
- •3. Взаимодействие кислотных оксидов с водой.
- •2.4.1. Определение и классификация оснований
- •2.4.2. Номенклатура оснований. Основные остатки
- •2.4.3. Свойства оснований
- •2.4.4. Получение оснований
- •2.5.1. Определение и классификация солей
- •2.5.2. Номенклатура солей
- •2.5.3. Свойства солей
- •2.5.4. Получение солей
- •2.6. Генетическая связь между классами неорганических веществ
- •Задание по теме:
2.4.2. Номенклатура оснований. Основные остатки
Названия оснований состоят из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия, Ba(OH)2 – гидроксид бария, Al(OH)3 – гидроксид алюминия. Если металл образует несколько оснований, то в их названиях римской цифрой в скобках указывается степень окисления атомов этого металла, например: Fe(OH)2 – гидроксид железа(II), Fe(OH)3 – гидроксид железа(III), Sn(OH)2 – гидроксид олова(II), Sn(OH)4 – гидроксид олова(IV).
Основание NH3∙H2O, образующееся при растворении аммиака в воде, называется гидрат аммиака. Ранее его состав выражался формулой NH4OH, однако соединение такого состава в действительности не существует.
П
Рис.
3. Валентность и заряды основных остатков
гидроксида железа(III)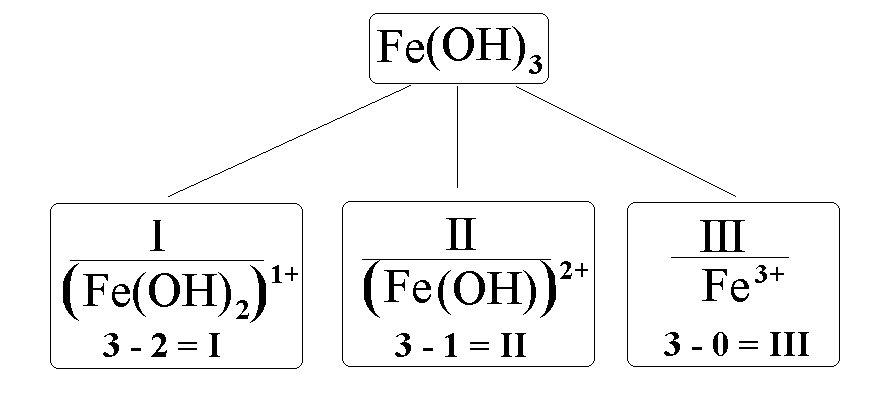 ри
отщеплении гидроксогрупп ОН от формульных
единиц оснований образуютсяосновные
остатки. Общее
число остатков основания равно его
кислотности. Валентность основного
остатка равна разности между числами
групп ОН в формулах основания и данного
остатка. Заряды основных остатков всегда
положительны и численно совпадают с их
валентностью. Например, гидроксиду
железа(III)
соответствуют три основных остатка –
Fe(OH)2,
Fe(OH)2
и Fe,
валентность которых равна, соответственно,
I,
II
и III,
а их заряды составляют 1+, 2+ и 3+ (рис. 3).
ри
отщеплении гидроксогрупп ОН от формульных
единиц оснований образуютсяосновные
остатки. Общее
число остатков основания равно его
кислотности. Валентность основного
остатка равна разности между числами
групп ОН в формулах основания и данного
остатка. Заряды основных остатков всегда
положительны и численно совпадают с их
валентностью. Например, гидроксиду
железа(III)
соответствуют три основных остатка –
Fe(OH)2,
Fe(OH)2
и Fe,
валентность которых равна, соответственно,
I,
II
и III,
а их заряды составляют 1+, 2+ и 3+ (рис. 3).
Формулы, значения валентности и названия остатков важнейших оснований приведены в Приложении 2.
2.4.3. Свойства оснований
Физические свойства. Все основания – белые или окрашенные в различные цвета твёрдые вещества. Щёлочи, за исключением гидроксида кальция, хорошо растворимы в воде. Гидроксиды щелочных металлов гигроскопичны: притягивая из воздуха влагу, они постепенно «расплываются».
Химические свойства.
а) Э л е к т р о л и т и ч е с к а я д и с с о ц и а ц и я и д е й с т в и е н а
и н д и к а т о р ы.
Все щёлочи – сильные электролиты, относящиеся к сильным основаниям. В водных растворах они необратимо и полностью диссоциируют на ионы:
NaOH → Na+ + OH– ; Ba(OH)2 → Ba2+ + 2OH–.
Наличие в растворах щелочей гидроксид-ионов OH– обусловливает их общие свойства. Так, например, растворы всех щелочей скользкие на ощупь, едкие, разрушают кожу и ткани. Они изменяют окраску индикаторов: лакмуса с фиолетовой на синюю, метилоранжа – с оранжевой на жёлтую, фенолфталеина – с бесцветной на малиновую.
Гидрат аммиака NH3 · H2O («гидроксид аммония NH4OH») – слабый электролит, диссоциирующий в растворах обратимо и частично:
NH3 · H2O ↔ NH4+ + OH–.
Вследствие этого в растворах данного основания, в отличие от щелочей, концентрация ионов OH– невелика, однако она достаточна для изменения окраски индикаторов.
б) В з а и м о д е й с т в и е с к и с л о т а м и.
Практически все основания реагируют с кислотами с образованием солей по общей схеме:
|
ОСНОВание |
+ |
кислота |
= |
СОЛЬ |
+ |
ВОДА |
|
В образующейся соли степень окисления металла такая же, как в исходном основании, а заряд кислотного остатка такой же, как в исходной кислоте.
Примеры реакций, протекающих в соответствии с указанной схемой:
![]() +
2
+
2![]() =
=![]() + 2H2O;
+ 2H2O;
гидроксид хлорово- хлорид вода
кальция дородная кальция
кислота
2![]() +
+![]() =
=![]() + 2H2O;
+ 2H2O;
гидроксид серная сульфат вода.
натрия кислота натрия
В результате реакции между щёлочью и кислотой образуется раствор соли, в котором уже нет ни щёлочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык значит «ни тот, ни другой».
Реакция между щёлочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
в) В з а и м о д е й с т в и е с к и с л о т н ы м и о к с и д а м и.
Все щёлочи реагируют с кислотными оксидами по общей схеме:
|
ЩЁЛОЧЬ |
+ |
КИСЛОТНЫЙ ОКСИД |
= |
СОЛЬ |
+ |
ВОДА |
|
В состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. CO3:
![]() +
+
![]() =
=![]() +H2O.
+H2O.
гидроксид оксид карбонат вода
калия углерода(IV) калия
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. PO4 с валентностью, равной III:
3![]() +
+![]() =
=![]() + 3H2O.
+ 3H2O.
гидроксид оксид фосфат вода
кальция фосфора(V) кальция
г) В з а и м о д е й с т в и е с с о л я м и.
Все щёлочи реагируют с солями по общей схеме:
-
ЩЁЛОЧЬ
+
соль
=
НОВОЕ
ОСНОВАНИЕ
+
НОВАЯ СОЛЬ
Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества – щёлочь и соль – обмениваются своими составными частями.
В результате таких реакций обычно выпадает осадок (↓) какого-либо одного нового вещества, например:
2KOH + CuSO4 = Cu(OH)2↓ + K2SO4;
гидроксид сульфат гидроксид сульфат
калия меди(II) меди(II) калия
Ca(OH)2 + K2CO3 = 2KOH + Ca CO3↓.
гидроксид карбонат гидроксид карбонат
кальция калия калия кальция
д) Т е р м и ч е с к о е р а з л о ж е н и е.
Все нерастворимые основания при нагревании разлагаются по общей схеме:
|
нерастворимое основание |
|
ОКСИД металла |
+ |
ВОДА |
|
Примеры реакций:
Сu(OH)2
![]() CuO + H2O;
2Fe(OH)3
CuO + H2O;
2Fe(OH)3
![]() Fe2O3
+ 3H2O
Fe2O3
+ 3H2O
гидроксид оксид гидроксид оксид
меди(II) меди(II) железа(III) железа(III).
Амфотерные основания обладают свойствами как типичных оснований, так и кислот, т. е. они взаимодействуют и с кислотами, и со щелочами. В обоих случаях образуется соль и вода. Например, амфотерный гидроксид цинка взаимодействует с соляной кислотой согласно уравнению:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
При взаимодействии этого гидроксида с расплавленной щелочью образуется цинкат – соль несуществующей «цинковой кислоты» H2ZnO2 (это – формула гидроксида цинка Zn(OH)2, записанная в виде кислоты: Zn(OH)2 = H2ZnO2). Поэтому уравнение данной реакции имеет вид:
Zn(OH)2
+ 2NaOH
(распл)
![]() Na2ZnO2
+ 2H2O.
Na2ZnO2
+ 2H2O.
Если же амфотерный гидроксид реагирует со щёлочью не в расплаве, а в водном растворе, то в результате реакции образуется комплексное соединение:
Zn(OH)2 + 2NaOH = (Na2ZnO2 · 2H2O) = Na2[Zn(OH)4].
Так же взаимодействуют с кислотами и щелочами амфотерные гидроксиды бериллия, олова(II) и свинца(II).
Амфотерный гидроксид алюминия реагирует с азотной кислотой согласно уравнению:
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O.
При взаимодействии этого гидроксида с расплавленной щелочью могут образоваться соли несуществующих «алюминиевых кислот» H3AlO3 и HAlO2 – соответственно ортоалюминаты и метаалюминаты. Поэтому уравнения указанных реакций имеют вид:
Al(OH)3
+ 3NaOH (распл)
![]() Na3AlO3
+ 3H2O;
Na3AlO3
+ 3H2O;
Al(OH)3
+ NaOH (распл)
![]() NaAlO2
+ 2H2O;
NaAlO2
+ 2H2O;
При взаимодействии гидроксида алюминия со щёлочью в водном растворе образуются комплексные соединения:
Al(OH)3 + 3NaOH = (Na3AlO3 · 3H2O) = Na3[Al(OH)6];
Al(OH)3 + NaOH = (NaAlO2 · 2H2O) = Na[Al(OH)4].
Амфотерные гидроксиды взаимодействуют как с кислотными, так и с оснóвными оксидами с образованием солей:
2Al(OH)3
+ 3SO3
= Al2(SO4)3
+
3H2O;
3Zn(OH)2
+ P2O5
![]() Zn3(PO4)2
+
3H2O;
Zn3(PO4)2
+
3H2O;
2Al(OH)3
+ Na2O
![]() 2NaAlO2
+ 3H2O;
Be(OH)2
+ CaO
2NaAlO2
+ 3H2O;
Be(OH)2
+ CaO
![]() CaBeO2
+ H2O.
CaBeO2
+ H2O.
