
- •30.Основні фізичні величини
- •31.Ідеальний газ
- •32.Емпіричні закони
- •33.Рівняння стану ідеального газу
- •34.Основне рівняння мкт ідеального газу
- •35.Висновки з основного рівняння мкт ідеального газу
- •36.Закон розподілу молекул ідеального газу за швидкостями. Розподіл Максвелла
- •37.Барометричні формули
- •39.Кі-сть ступенів вільності молекул
- •47. Оборотні і необоротні процеси.
37.Барометричні формули
До цього казали,щ о на молекули не діють силові поля і вони розподіоені по обєму рівномірно. Але насправді на молекули діють сили тяжіння, тому атмосферне повітря знаходиться біля поверхні землі і його молекули не розлітаються у всесвіт. Тепловий рух молекул завдячує тому, що молекули атмосферного повітря не падають на землю. Отже, сила тяжіння та тепловий рух молекул зумовлюють стаціонарний стан ідеального газу – тобто с підняттям на висоту тиск та концентрація молекул зменшується
(p-dp)-p=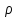 *g*dh;
dp=
*g*dh;
dp=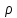 *g*dh(1*);
m=
*g*dh(1*);
m= *V
=>>>
*V
=>>>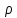 =m/V
=m/V
Р-ня М-К:p*V=(m/M)*R*T =>> m/V=p*M/R*T (2*)
(2*)->(1*)=>>> dp=-(p*M/R*T)*g*dh
dp/p=-(M*g/R*T)*dh
ln(p/p0)=-(M*g/R*T)*h
p=p0*e^(-M*g*h/R*T); h=(R*T/M*g)*ln(p0/p)=>>Барометричні формули
Отже, з підняттям на висоту тиск зменшується за законом експонента. Тим швидше, чим важчий газ, і чим нижча абсолютна тепмература
39.Кі-сть ступенів вільності молекул
Це число незалежних зміних(координат), яке описує положення тіла в просторі.
Іn-кі-сть ступенів вільності молекул при поступальному русі.
Іо-при обертальному русі
Ік-при коливальному русі
При темп. Нижчої за кімнатну вважають, що атоми в молекулі жорстко зв’язані. Тому коливальний рух не враховується.
Одноатомний газ. Ік=3, іо=-,і=3
Двоатомний газ. Ік=3, іо=2,і=5
Трьохатомний або багатоатомний. Ік=3, іо=3,і=6
Ік=3*N-6 – коливальний ступень вільності
Якщо молекула лінійна(атоми розташовані вздовж однієї прямої), то коливальний ступінь вільності Ік=3*N-5
41 Вн́утрішня ене́ргія тіла (позначається як E або U) — повна енергія термодинамічної системи за винятком її кінетичної енергії як цілого і потенціальної енергії тіла в полі зовнішніх сил. Внутрішня енергія складається з кінетичної енергії хаотичного руху молекул, потенціальної енергії взаємодії між ними і внутрішньомолекулярної енергії.
Внутрішня енергія є однозначною функцією рівноважного стану системи. Це означає, що кожний раз, коли система опиняється в даному рівноважному стані, її внутрішня енергія приймає властиве цьому стану значення, незалежно від передісторії системи. Отже, зміна внутрішньої енергії при переході з одного стану в інший буде завжди дорівнювати різниці значень в цих станах, незалежно від шляху, по якому здійснювався перехід. Внутрішню енергію тіла не можна виміряти напряму. Можна визначити тільки зміну внутрішньої енергії:
![]() ,
,
де ![]() —кількість
теплоти,
передана термодинамічній системі,
—кількість
теплоти,
передана термодинамічній системі, ![]() —робота,
виконана над термодинамічною
системою[1] або:
—робота,
виконана над термодинамічною
системою[1] або:
![]() ,
,
де ![]() ,
робота виконана термодинамічною
системою.
,
робота виконана термодинамічною
системою.
42. Перший закон термодинаміки
Зміна внутрішньої енергії закритої системи, яка відбувається в рівноважному процесі переходу системи із стану 1 в стан 2, дорівнює сумі роботи, зробленої над системою зовнішніми силами, і кількості теплоти, наданої системі: ΔU = A' + Q. Робота здійснена системою над зовнішніми тілами в процесі 1->2 (Назвемо її просто А) A=-A', тоді закон приймає вигляд:
![]() .
.
Кількість теплоти, що надається системі, витрачається на зміну внутрішньої енергії системи і на здійснення системою роботи проти зовнішніх сил.
Для елементарної кількості теплоти δQ; елементарної роботи δA і малої зміни dU внутрішньої енергії перший закон термодинаміки має вигляд:
![]()
43. Теплоє́мність — фізична величина, яка визначається кількістю теплоти, яку потрібно надати тілу для зміни його температури на один градус.
Позначається здебільшого великою латинською літерою C. Питома теплоємність — теплоємність одиничної маси тіла, позначається малою латинською літерою c. Часто визначається також молярна теплоємність — теплоємність одного моля газу.
44.
1.
Ізотермічний процес. Під
час ізотермічного процесу (Т =
const) зміна температури ![]() .
Тому внутрішня енергія ідеального газу
не міняється (
.
Тому внутрішня енергія ідеального газу
не міняється (![]() ).
Відповідно до рівняння стану ідеального
газу pV =
const, тобто у разі підведення до газу
деякої кількості теплоти (досить
повільно) змінюються тільки тиск і
об'єм, а внутрішня енергія залишається
незмінною.
).
Відповідно до рівняння стану ідеального
газу pV =
const, тобто у разі підведення до газу
деякої кількості теплоти (досить
повільно) змінюються тільки тиск і
об'єм, а внутрішня енергія залишається
незмінною.
Таким
чином, з виразу ![]() випливає,
що
випливає,
що
![]() .
.
під час ізотермічного процесу вся підведена кількість теплоти витрачається на роботу, здійснену газом проти зовнішнього тиску.
Якщо процес являє собою ізотермічне стискання, то Аг < 0 і Q = - Ar. Або інакше: Ar = - Q.
Негативне значення Q вказує на те, що газ під час стискання віддає тепло, причому в кількості, що дорівнює здійсненій роботі.
45. Адіаба́тний проце́с (грец. αδιαβατος — неперехідний) — в термодинаміці зміна стану тіла без обміну теплом з навколишнім середовищем. Його можна здійснити, проводячи стискання чи розширення тіла (наприклад, газу) дуже швидко.
Так, при поширенні звукових хвиль у повітрі чи іншому тілі, у місцях згущення частинок температура підвищується, а в місцях розрідження — знижується. За дуже малий період коливання не відбувається помітного обміну теплом між місцями згущення і розрідження.
Під час адіабатного стискування тіла внутрішня енергія його збільшується, а при адіабатичному розширенні — зменшується. Виконана робота при цьому дорівнює за величиною і протилежна за знаком зміні внутрішньої енергії системи.
![]()
де P — тиск, V — об'єм, ![]() —показник
адіабати,
—показник
адіабати,
![]()
![]() — молярна
теплоємність за
умов постійного тиску, а
— молярна
теплоємність за
умов постійного тиску, а ![]() —
молярна теплоємність за умов постійного
об'єму.
—
молярна теплоємність за умов постійного
об'єму.
46.
Виразимо
температуру з рівняння Менделєєва–Клапейрона
і підставимо в останню формулу: ![]() ,
, ![]() .
Але, оскільки
.
Але, оскільки ![]() ,
то в остаточному підсумку одержуємо:
,
то в остаточному підсумку одержуємо: ![]() або
або ![]() .
Отримане рівняння називається рівнянням
Пуассона.
.
Отримане рівняння називається рівнянням
Пуассона.
