
Збірник задач
.pdf
Електрохімія
електродів S. Відношення l , що називають константою кондукто-
S
метричної комірки, обчислюють за рівнянням (6.3), вимірявши опір розчину з точно відомим Ν (звичайно розчин КСl):
l |
Ν |
R . |
|
|
(6.4) |
||
|
|||
|
KCl |
KCl |
|
S
Молярна електрична провідність (Ο) дорівнює питомій провідності (Ν), помноженій на об’єм (V), в якому міститься 1 моль електроліту і який називають розведенням:
Ο κ V. |
(6.5) |
Розведення — це величина, обернена молярній концентрації:
1 |
|
|
|
|
||
|
V |
|
. |
(6.6) |
||
|
||||||
|
|
c |
|
|
|
|
Тому |
|
|
|
|||
|
Ο Ν . |
(6.7) |
||||
|
|
c |
|
|
|
|
Розмірність Ο така: |
|
|
|
|||
>Ο |
См м –1 м3 |
|
См м2 |
. |
||
|
|
|||||
|
моль |
|
моль |
|||
Питому і молярну електричну провідності можна обчислити за
рівняннями |
|
|
|
Ν |
(u u– ) F c |
; |
(6.8) |
Ο |
(u u– ) F |
, |
(6.9) |
де u+ i u– — електричні рухливості катіона і аніона (швидкості при одиничному градієнті потенціалу 1 В·м–1); с — молярна концентрація;
— ступінь дисоціації; F — число Фарадея (1 F = 96485 Кл/моль).
Для нескінченного розведення, коли |
= 1, рівняння (6.9) набу- |
||||||||||
ває вигляду |
|
|
|
|
|
|
|
|
|
|
|
Ο |
φ |
φ |
φ |
φ |
F u |
φ |
F |
φ |
Ο |
φ |
|
|
(u |
u– ) F |
u |
– |
Ο |
– . |
(6.10) |
||||
Добуток електричної рухливості іона на число Фарадея ui ·F = Οi називається іонною електричною провідністю.
Отже, молярна електрична провідність електроліту при нескінченному розведенні дорівнює сумі іонних електричних провідностей при нескінченному розведенні (Закон Кольрауша).
81

Збірник задач з фізичної та колоїдної хімії |
|
|
|||||||||
Для сильних електролітів гранична молярна електрична провід- |
|||||||||||
ність Οφ може бути знайдена екстраполяцією залежності Ο — f ( |
с ) |
||||||||||
на значення с = 0 відповідно до рівняння Кольрауша: |
|
|
|||||||||
|
|
|
Ο |
Οφ – в |
с. |
|
|
|
|
(6.11) |
|
Відношення кількості електрики, перенесеної іонами даного |
|||||||||||
виду, Qі, до загальної кількості електрики, що пройшла через |
|||||||||||
електроліт, Q, називають числом переносу іона: |
|
|
|||||||||
|
|
|
|
Q |
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
t |
. |
|
|
|
|
|
(6.12) |
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
Q |
|
|
|
|
|
|
|
Числа переносу іонів можна виразити через їх електричні |
|||||||||||
рухливості: |
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
u |
|
|
|
|
u – |
|
|
|
|
|
|
і |
t – |
|
|
|
. |
(6.13) |
||
|
|
|
u u – |
|
u |
|
u – |
|
|
||
Явно, що |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t t – |
1. |
|
|
|
|
(6.14) |
||
За експериментальними значеннями чисел переносу іонів і |
|||||||||||
граничних молярних провідностей електролітів можна розрахувати |
|||||||||||
іонні електричні провідності при нескінченному розведенні: |
|
|
|||||||||
φ |
Ο |
φ |
t |
|
φ |
Ο |
φ |
t – . |
|
|
|
Ο |
|
і |
Ο– |
|
|
(6.15) |
|||||
За допомогою кондуктометрії, яка грунтується на вимірюванні |
|||||||||||
електричної провідності розчинів, визначають різні фізико-хімічні |
|||||||||||
характеристики електролітів: ступінь і константу дисоціації, добуток |
|||||||||||
розчинності та ін. |
|
|
|
|
|
|
|
|
|
|
|
З рівнянь (6.9) і (6.10) випливає, що |
|
|
|
|
|
|
|
||||
|
|
|
|
Ο |
|
|
|
|
|
|
|
|
|
|
Οφ |
|
|
|
|
|
(6.16) |
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
φ |
φ |
|
|
|
|
|
|
(для розбавлених розчинів u | u і u– |
| u– |
). |
|
|
|
|
|
||||
Підставивши значення |
|
в закон розведення Оствальда, одержуємо |
|||||||||
рівняння для розрахунку константи дисоціації: |
|
|
|
|
|
||||||
|
|
|
2 c |
Ο2 c |
|
|
|
|
|
|
|
K |
|
1 – |
Οφ (Οφ – Ο) . |
|
|
|
(6.17) |
||||
Визначення розчинності основане на тому, що насичений |
|||||||||||
розчин малорозчинного електроліту можна вважати нескінченно |
|||||||||||
розбавленим. Отже, молярну електричну провідність такого розчину |
|||||||||||
можна обчислити за законом Кольрауша (6.10), використавши таб- |
|||||||||||
82 |
|
|
|
|
|
|
|
|
|
|
|

|
Електрохімія |
|
|
||
личні дані. Концентрацію насиченого розчину с (розчинність) роз- |
|||||
раховують за рівнянням |
|
|
|
|
|
|
Ν – Ν |
|
|
|
|
|
|
|
H O |
|
|
|
|
|
2 |
|
|
|
c |
Οφ Οφ . |
|
(6.18) |
|
|
|
|
– |
|
|
(При вимірюванні Ν сильно розбавлених розчинів необхідно |
|||||
враховувати провідність води). |
|
|
|
|
|
При кондуктометричному титруванні точку еквівалентності |
|||||
знаходять за допомогою кондуктограми, побудованої в координа- |
|||||
тах 1 — об’єм титранту. Кондуктограма титрування сильної кис- |
|||||
R |
|
|
|
|
|
лоти лугом наведена на рис. 6.1. |
|
|
|
|
|
Рис. 6.1. Крива кондуктометричного титру- |
|
||||
вання розчину HCl розчином NaOH |
|
||||
6.2. Електродні потенціали та електрорушійні сили |
|||||
6.2.1. Термодинамічний вираз для рівноважного |
|
||||
електродного потенціалу |
|
||||
Якщо на електроді оборотно та ізотермічно проходить реакція |
|||||
Θ1А1 + Θ2А2 + zе |
|
Θ3А3 + Θ4А4, |
(6.19) |
||
то електродний потенціал Μ можна розрахувати за рівнянням |
|
||||
Μ |
Τ |
aΘ |
3 aΘ |
4 |
|
Μ 0 – |
lg 3 |
4 |
, |
(6.20) |
|
|
|
Θ |
ν |
|
|
|
z |
a |
1 a |
2 |
|
|
|
1 |
2 |
|
|
|
|
|
|
|
83 |

|
Збірник задач з фізичної та колоїдної хімії |
|
|
|
||||||||
де а1, а2, а3, а4, — початкові (нерівноважні) активності реагентів; |
||||||||||||
Μ0 — стандартний електродний потенціал, тобто потенціал електрода |
||||||||||||
при початкових активностях, що дорівнюють одиниці; Τ |
2,303 RT |
|||||||||||
|
|
; |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
F |
|
Τ — крутість електродної функції. |
|
|
|
|
|
|
||||||
z |
|
|
|
|
|
|
|
|
|
|
|
|
При Т = 298 К рівняння (6.20) має вигляд |
|
|
|
|
|
|||||||
|
|
Μ |
Μ 0 – |
0,059 |
aΘ 3 |
aΘ |
4 |
|
|
|
|
|
|
|
3 |
4 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
· |
lg |
|
. |
|
|
|
(6.21) |
||
|
|
|
|
z |
|
aΘ1 |
aΘ |
2 |
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
6.2.2. Класифікація електродів |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
z |
Електрод першого роду можна навести у вигляді схеми |
M |
M . |
||||||||||
Рівняння електродної реакції можна записати так: |
|
|
|
|||||||||
|
|
|
Mz ze |
М. |
|
|
|
|
|
|||
Потенціал електрода першого роду розраховують за рівнянням |
||||||||||||
|
|
|
|
Μ |
z |
Μ 0 Τ |
lg |
a |
z . |
|
|
(6.22) |
|
|
|
|
M M |
|
|
M |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
z |
|
|
|
|
|
|
Для розбавлених розчинів воно має вигляд |
|
|
|
|
||||||||
|
Μ |
z |
Μ 0 |
Τ |
lg |
с z (рівняння Нернста). |
(6.23) |
|||||
|
|
M M |
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
z |
|
|
|
|
|
|
|
|
Різновидом електродів першого роду є газові електроди. |
||||||||||||
Найбільш важливим представником газових електродів є водневий |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
електрод. |
Схема |
електрода |
така: |
Н |
Н |
Pt . |
Водневому |
|||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
електроду відповідає реакція |
|
|
|
|
|
|
|
|
||||
|
|
|
2H 2e |
Н2. |
|
|
|
|
|
|||
Водневий електрод, який працює в умовах: |
|
|
|
|
||||||||
|
|
|
a |
1, |
p |
101,3 кПа , |
|
|
|
|
||
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
називають стандартним. Потенціал стандартного водневого |
||||||||||||
електрода прийнятий рівним нулю при всіх температурах. |
|
|
||||||||||
Рівняння для потенціалу водневого електрода можна записати так: |
||||||||||||
|
|
|
Μ |
|
Τ lg a |
– Τ pH . |
|
|
(6.24) |
|||
|
|
|
Н |
2Н |
|
H |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– |
|
|
Електрод другого роду записують у вигляді схеми |
A |
MA, M. |
||||||||||
84 |
|
|
|
|
|
|
|
|
|
|
|
|

Електрохімія
Рівняння електродної реакції має вигляд |
|
||||
МА + ze |
|
|
М + Аz–. |
|
|
|
|
|
|||
|
|
|
|||
Потенціал електрода другого роду виражають рівнянням |
|
||||
Μ |
|
Μ 0 |
Τ |
|
|
z– |
– lg a z– . |
(6.25) |
|||
M, MA |
A |
|
|
A |
|
|
|
z |
|
||
|
|
|
|
|
|
Потенціал цього електрода можна виразити також через активність іонів металу Мz+, використовуючи добуток розчинності важкорозчинної солі ДРМА:
Μ |
|
Μ 0 |
Τ |
lg a |
|
|
|
– lg ДР |
z , |
(6.26) |
|||
|
z– |
|
МА |
|
|
|
М, МА |
А |
z |
|
M |
|
|
|
|
|
|
|
||
|
|
|
Μ 0' |
|
|
|
де Μ 0' — стандартний потенціал відповідного електрода першого
роду.
Таким чином, порівнюючи стандартні потенціали відповідних електродів першого і другого роду, можна визначити добуток розчинності важкорозчинної солі.
До електродів другого роду належать хлоросрібний і каломельний електроди.
Схема хлоросрібного електрода
|
|
|
– |
|
|
|
|
|
|
Cl |
|
AgCl, Ag. |
|
||||
|
|
|
|
|
|
|||
На хлоросрібному електроді проходить реакція |
|
|||||||
|
AgCl + e |
|
|
|
Ag + Cl–. |
|
||
|
|
|
|
|
||||
|
|
|
|
|
||||
Потенціал хлоросрібного електрода визначають за рівнянням |
||||||||
Μ |
|
– |
|
|
0,222 – 0,059 lg a – |
(6.27) |
||
|
|
|
||||||
|
Ag, AgCl |
Cl |
|
|
|
Cl |
|
|
при 298 К. |
|
|
|
|
|
|
|
|
Схема каломельного електрода |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
– |
|
|
|
|
|
|
|
Cl |
|
Hg Cl , Hg . |
|
||||
|
|
|
|
2 |
2 |
|
||
|
|
|
|
|
|
|
|
|
Йому відповідає реакція |
|
|
|
|
||
Hg2Cl2 + 2e |
|
|
2Hg + 2Cl–. |
|
||
|
|
|
||||
|
|
|
||||
Рівняння для електродного потенціалу можна записати так: |
||||||
Μ |
|
|
|
|
Μ 0 – Τ lg a . |
(6.28) |
Hg, Hg |
Cl |
|
Cl– |
Cl– |
|
|
|
|
|
||||
2 |
2 |
|
|
|
|
|
Найчастіше використовують каломельні електроди, які містять 0,1 М; 1,0 М і насичений розчин хлориду калію. Їх потенціали при 298 К дорівнюють відповідно 0,334; 0,281; 0,242 В.
85

|
Збірник задач з фізичної та колоїдної хімії |
|
||||||||||||
|
Окислювально-відновний електрод записують у вигляді |
|||||||||||||
схеми |
Ox, Red |
Pt , |
а |
електродну |
реакцію |
можна |
виразити |
|||||||
загальним рівнянням: |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Ox ze |
|
|
Red. |
|
|
|
||||
Електродний потенціал дорівнює |
|
|
|
|
|
|
|
|||||||
|
|
|
Μ |
Red | Ox |
|
Μ 0 |
– Τ |
lg aRed . |
|
(6.29) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
z |
|
aOx |
|
|
|
До окислювально-відновних електродів належить хінгідронний |
||||||||||||||
електрод: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C H O , C H (OH) , H |
Pt. |
|
|
|||||||||
|
|
6 |
4 |
2 |
|
6 |
4 |
|
2 |
|
|
|
|
|
На електроді проходить реакція |
|
|
|
|
|
|
|
|||||||
|
С6Н4О2 + 2Н+ + 2е |
|
|
С6Н4(ОН)2. |
|
|||||||||
Вираз для потенціалу хінгідронного електрода має вигляд |
||||||||||||||
|
Μ |
(OH) |
| C |
H |
O |
Μ 0 Τ lg a . |
(6.30) |
|||||||
|
|
C H |
|
|
|
|
|
H |
|
|||||
|
|
6 |
4 |
2 |
6 |
4 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Стандартний потенціал хінгідронного електрода дорівнює 0,699 В |
||||||||||||||
при 298 К. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Потенціал іонселективного електрода (ІСЕ) визначається проце- |
||||||||||||||
сом розподілу іонів між мембраною і розчином. |
|
|
||||||||||||
Найбільш розповсюдженими ІСЕ є скляні електроди. Схема |
||||||||||||||
скляного електрода з водневою функцією така: |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
скляна мембрана |
HCl AgCl, Ag. |
|
||||||||||
Рівняння для потенціалу має вигляд |
|
|
|
|
|
|||||||||
|
|
|
|
Μ |
|
|
const – Τ pH. |
|
|
(6.31) |
||||
|
|
|
|
|
скл |
|
|
|
|
|
|
|
|
|
Для перевірки водневої функції скляного електрода вимірюють |
||||||||||||||
ЕРС кола, складеного із скляного електрода і електрода порівняння |
||||||||||||||
(хлоросрібного, |
каломельного), будують |
калібрувальний графік |
||||||||||||
Е — рН і визначають крутість електродної функції Τ як кутовий |
||||||||||||||
коефіцієнт калібрувальної прямої. |
|
|
|
|
|
|
|
|||||||
Комбінуючи різні за природою електроди, одержують різні |
||||||||||||||
гальванічні елементи. |
|
|
|
|
|
|
|
|
|
|
|
|||
Якщо в оборотному гальванічному елементі проходить реакція: |
||||||||||||||
|
|
Θ1А1 + Θ2А2 |
|
|
Θ3А3 + Θ4А4, |
|
|
|||||||
то його називають хімічним і його ЕРС дорівнює |
|
|||||||||||||
|
|
|
|
|
0 |
|
Τ |
aΘ |
3 aΘ |
4 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
4 |
|
|
|
|
|
|
|
|
E |
E |
– |
lg |
aΘ1 aΘ |
, |
|
|
(6.32) |
|||
|
|
|
|
|
|
|
z |
2 |
|
|
|
|||
|
|
|
|
|
|
|
|
1 |
|
2 |
|
|
|
|
86 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Електрохімія
де Е 0 — стандартна ЕРС.
ЕРС можна визначити також як різницю електродних потенціалів. При цьому від значення потенціалу позитивного електрода (його звичайно у схемі записують справа) віднімають значення потенціалу негативного електрода (лівого).
У колі без переносу обидва електроди занурені в один розчин, рідинна межі відсутня. Наприклад,
Pt H HCl AgCl, Ag — воднево-хлоросрібний елемент;
2
Ag, AgCl HCl скляна мембрана НCl AgCl, Ag — скляно-
хлоросрібний елемент.
У колі з переносом електроди занурені в різні розчини, що контактують між собою:
Zn ZnSO CuSO Cu;
44
Pt H HCl KCl AgCl, Ag;
2
Ag, AgCl HCl скл. мембрана СН СООН KCl AgCl, Ag .
3
У колах з переносом на межі між розчинами виникає дифузійний (розчини в одному розчиннику) або рідинний (розчини в різних розчинниках) потенціал. Дифузійний (або рідинний) потенціал треба враховувати при обчисленні ЕРС гальванічного елемента. Дифузійний потенціал звичайно важко розрахувати і на практиці його зменшують, вміщуючи між розчинами сольовий місток, тобто концентрований розчин солі з близькими рухливостями катіона і аніона (KCl, NH4NO3, NH4Cl). Наявність сольового містка позначають звичайно двома рисками:
Zn ZnSO CuSO , Cu .
44
Якщо гальванічний елемент складається з двох однакових електродів, занурених в розчини з різними активностями, то його називають концентраційним:
|
AgNO |
AgNO |
|
|
3 |
3 |
|
Ag |
|
|
Ag. |
|
a |
a |
|
|
1 |
2 |
|
|
|
|
|
ЕРС концентраційного кола з переносом:
Е Μ |
– Μ Μ |
, |
2 |
1 |
Д |
де ΜД — дифузійний потенціал. |
|
|
(6.33)
(6.34)
87

Збірник задач з фізичної та колоїдної хімії
Дифузійний потенціал кола типу (6.33) можна обчислити за рівнянням
Μ |
|
u– |
– u |
|
RT |
ln |
a2 |
, |
(6.35) |
|
Д |
|
u |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
|
u |
|
|
F |
|
a |
|
|
|
|
|
– |
|
|
|
1 |
|
|
||
де u — рухливості іонів.
Якщо підставити у (6.34) значення потенціалів електродів і значення дифузійного потенціалу, одержимо
|
2u |
|
|
RT |
a |
(6.36) |
||
E |
|
|
|
ln . |
||||
|
|
– |
|
|
|
2 |
|
|
|
u |
u |
|
|
F |
a |
|
|
|
– |
|
|
|
1 |
|
|
|
За наявності сольового містка ЕРС кола буде дорівнювати
|
RT |
a |
(6.37) |
|
E |
ln . |
|||
|
|
2 |
|
|
|
F |
a |
|
|
|
|
1 |
|
|
6.3. Потенціометрія
Потенціометрія — це фізико-хімічний метод досліджен-
ня, що грунтується на вимірюванні ЕРС.
Потенціометричним методом визначають, наприклад, термодинамічні характеристики реакцій: 'G, 'H, 'S, константу рівноваги.
В оборотному гальванічному елементі здійснюється максимальна корисна робота zFE, яка дорівнює зменшенню енергії Гіббса:
– G zFE . |
(6.38) |
Якщо початкові активності реагентів дорівнюють одиниці, то з (6.38) одержуємо
– 'G 0 zFE 0 , |
(6.39) |
де 'G0 — стандартна зміна енергії Гіббса; Е 0 — стандартна ЕРС. Із стандартної зміни енергії Гіббса обчисляють константу рівноваги реакції:
– 'G0 RT ln K. |
(6.40) |
Вивчаючи температурну залежність ЕРС гальванічного елемента, визначають зміну ентропії:
|
|
0 |
|
|
'S 0 zF w E |
|
. |
(6.41) |
|
|
wT |
|
|
|
|
p |
|
||
Зміну ентальпії розраховують за рівнянням Гіббса-Гельмгольца:
88

Електрохімія
G0 H 0 – T S 0 . |
(6.42) |
При потенціометричному титруванні точку еквівалентності (т. е.) знаходять, будуючи графік залежності ЕРС (рН) від об’є- му доданого титранту. Графік має s-подібну форму і називається інтегральною кривою потенціометричного титрування (рис. 6.2, а). Для знаходження т. е. будують дотичні до нижньої (1) і верхньої (2) гілок кривої, а також до середньої ділянки (3). Т.е. відповідає середина відрізку дотичної (3), який міститься між дотичними (1) і (2).
Більш точне визначення т. е. можна здійснити за допомогою дифе-
E
ренціальної кривої, побудованої в координатах V – V (рис. 6.2, б). Т.е. відповідає пік на диференціальній кривій.
Рис. 6.2. Інтегральна (а) і диференціальна (б) криві потенціометричного титру-
вання
Для розрахунку константи дисоціації за результатами потенціометричного титрування використовують рівняння Гендерсона:
>A |
|
pK = pH – lg >HA , |
(6.43) |
де [A–] і [HA] — концентрації аніонів і молекул кислоти.
У процесі титрування вимірюють значення рН, розраховують [A–] і [HA] і знаходять ряд значень рK, з яких одержують середнє значення.
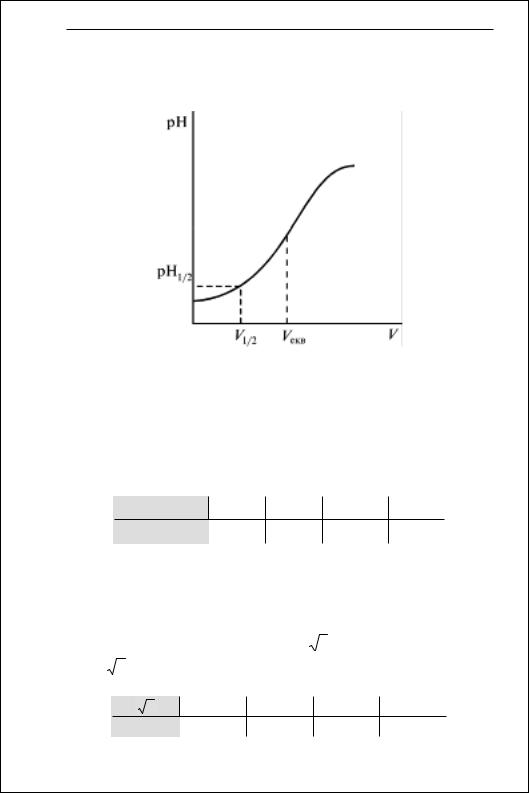
Приблизно значення рK можна знайти за кривою титрування як рН у точці напівнейтралізації. Як видно з рівняння Гендерсона, в цій точці, коли [A–] = [HA], рK = рН.
89
|
Збірник задач з фізичної та колоїдної хімії |
|
|||||
Будують криву титрування в координатах рН — V титранту, |
|||||||
знаходять еквівалентний об’єм, об’єм напівнейтралізації V1/2 і |
|||||||
відповідне йому значення рН1/2 = рK (рис. 6.3). |
|
||||||
|
Рис. 6.3. Визначення константи дисоціації |
|
|||||
|
за кривою титрування |
|
|
|
|||
|
Приклади розв’язання задач |
|
|||||
1. При 18 °С молярна електрична провідність водних розчинів |
|||||||
КCl різної концентрації має такі значення: |
|
|
|||||
|
с, моль/л |
|
0,160 |
0,384 |
|
0,705 |
1,489 |
|
2 |
|
10,25 |
10,01 |
|
9,90 |
9,62 |
|
Ο, См м /кмоль |
|
|||||
|
|
|
|
|
|
||
Знайдіть граничну молярну електричну провідність KCl при |
|||||||
даній температурі, а також питому електричну провідність і ступінь |
|||||||
дисоціації КCl у 0,25 М розчині. |
|
|
|
||||
Р о з в ' я з а н н я . Граничну молярну електричну провідність виз- |
|||||||
начаємо за лінійною залежністю Ο — |
c |
(6.11). Розраховуємо зна- |
|||||
чення |
c : |
|
|
|
|
|
|
|
с |
|
0,40 |
0,62 |
|
0,84 |
1,22 |
|
Ο |
10,25 |
10,01 |
|
9,90 |
9,52 |
|
90 |
|
|
|
|
|
|
|
