
Збірник задач
.pdf
|
|
Фазові рівноваги |
|
|
||||
де m — величина, що не має певного фізичного смислу, але за- |
||||||||
лежить від температури і природи всіх трьох речовин, які утво- |
||||||||
рюють систему. |
|
|
|
|
|
|
|
|
Закон розподілу лежить в основі важливого і поширеного в |
||||||||
лабораторній і заводській практиці процесу екстракції. |
||||||||
|
|
4.4. Екстракція |
|
|||||
Екстракцією називають процес вилучення із розчину од- |
||||||||
нієї або декількох |
розчинених речовин за допомогою дру- |
|||||||
гого розчинника, що не змішується з першим. |
||||||||
Кількість речовини mn, що залишилась у водній фазі після n |
||||||||
вилучень неводним розчинником, можна розрахувати за рів- |
||||||||
нянням |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
m |
m |
|
|
, |
(4.12) |
||
|
n |
0 |
|
|
|
|
|
|
|
|
|
V0 |
KV |
|
|
||
де m0 — маса речовини у вихідному розчині; V0 — об’єм вихід- |
||||||||
ного розчину; V — об’єм екстрагенту; K — коефіцієнт розподі- |
||||||||
лу (4.10). |
|
|
|
|
|
|
|
|
|
Приклади розв’язання задач |
|||||||
1. Розрахуйте число компонентів, фаз і ступенів свободи у |
||||||||
рівноважній системі |
|
|
|
|
|
|
|
|
NH HCO (кр) |
|
NH |
|
(г) CO |
(г) H O(г) |
|||
4 |
3 |
|
|
|
3 |
|
2 |
2 |
при 383 К для суміші NH3, CO2, і Н2О, що взяті у довільних |
||||||||
співвідношеннях, якщо відомо значення константи рівноваги. |
||||||||
Число зовнішніх факторів, що впливають на систему, дорів- |
||||||||
нює 2. |
|
|
|
|
|
|
|
|
Р о з в ’ я з а н н я . Число компонентів дорівнює числу речо- |
||||||||
вин, що складають систему (К), мінус число рівнянь (х), які |
||||||||
зв’язують їх концентрації у рівноважній системі: |
||||||||
|
|
К = к – х. |
|
|
||||
При довільному співвідношенні між NH3, CO2 і Н2О існує |
||||||||
тільки одне рівняння, що зв’язує концентрації цих речовин |
||||||||
(константа рівноваги), тому К = 4 – 1 = 3. |
|
|||||||
Кількість фаз у системі дорівнює двом: тверда (NH4HCO3) та |
||||||||
газоподібна (NH3, CO2 і Н2О). Число ступенів свободи: |
||||||||
|
С = К + 2 – Ф = 3 + 2 – 2 = 3 |
|||||||
(температура, тиск та концентрація одного із газів). |
||||||||
|
|
|
|
|
|
|
|
41 |
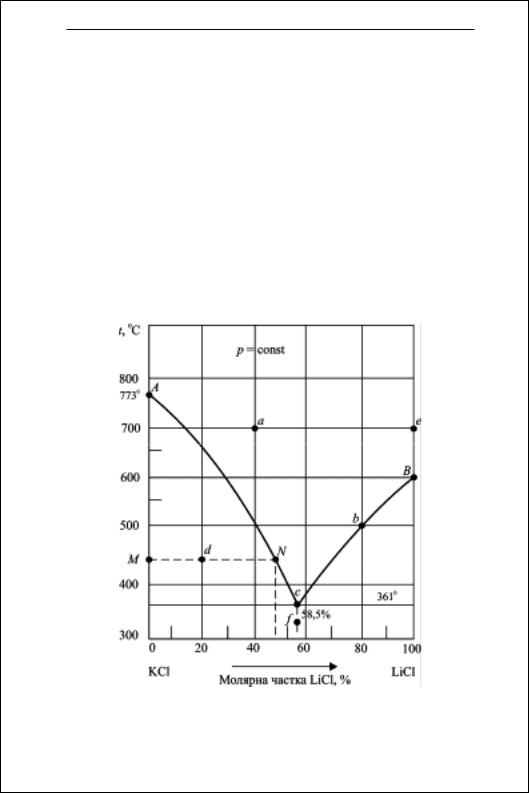
Збірник задач з фізичної та колоїдної хімії
2. За допомогою діаграми плавкості системи КCl—LiCl (рис. 4.1) визначте для станів системи, позначених точками а, в, с, d, е, f, кількість фаз, склад кожної з них та температуру.
Р о з в ’ я з а н н я. Вказані точки позначають такі стани системи:
точка а: розплав (однофазна рідка система), що містить 40 % LiCl та 60 % КСl при 700 °С;
точка в: двофазна система при 500 °С складається з розплаву, який містить 80 % LiCl та 20 % КCl і перебуває у рівновазі з кристалічним LiCl;
точка с: трифазна система, що складається з розплаву, який містить 58,5 % LiCl та 41,5 % КСl і перебуває у рівновазі з кристалами обох солей при 361 °С (евтектична точка);
точка d: двофазна система при 450 °С, що складається з розплаву, який вміщує 45 % LiCl і 55 % KCl, та кристалічного KCl;
точка е: однофазна система — розплавлений LiCl при 700°С; точка f: двофазна система — кристали LiCl та КСl (твер-
да евтектика, що містить 58,5 % LiCl та 41,5 % KCl) при 325 °С.
Рис. 4.1. Діаграма плавкості системи КCl — LiCl
42
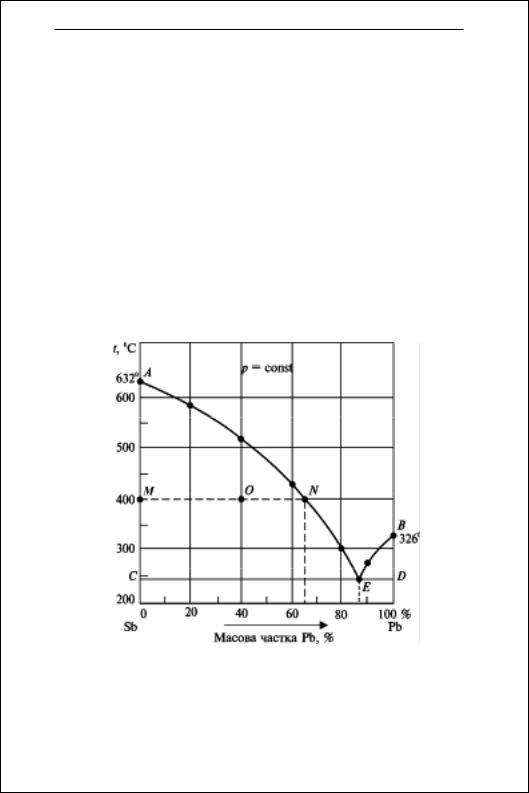
Фазові рівноваги
3. Побудуйте діаграму плавкості системи Sb—Pb, користуючись такими даними:
Склад рідкого сплаву, |
|
|
|
|
|
|
|
ΖPb, % |
0 |
20 |
40 |
60 |
80 |
90 |
100 |
|
|
|
|
|
|
|
|
Температура утворення |
|
|
|
|
|
|
|
|
632 |
580 |
520 |
433 |
300 |
273 |
326 |
перших кристалів, °С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Визначте склад евтектичної суміші. Розрахуйте масу кристалів Sb, що виділяються при охолодженні до 400 °С 5 кг рідкого сплаву, який містить 40 % Pb.
Р о з в ’ я з а н н я . Будуємо діаграму плавкості системи Sb— Pb за наведеними даними. На осі абсцис відкладаємо вміст компонентів (у відсотках), а на осі ординат — температуру утворення перших кристалів (°С). Одержані точки з’єднуємо кривими АЕ та ВЕ (криві ліквідуса), які перетинаються в евтектичній точці Е. Абсциса точки Е вказує склад евтектичної суміші: 13 % Sb i 87 % Pb.
Рис. 4.2. Діаграма плавкості системи Sb — Pb
Якщо систему, що вміщує 40% Pb, охолодити до 400 °С, то на діаграмі її стан буде зображатися точкою О. Частина Sb при охолодженні сплаву викристалізується, і при 400 °С кристали
43

Збірник задач з фізичної та колоїдної хімії
Sb (тверда фаза) перебувають у рівновазі з розплавом (рідка фаза), що містить 65% Pb (точка N). За правилом важеля розраховуємо масу Sb, що викристалізувалась. Позначимо масу кристалів Sb через mкр, тоді маса рідкої фази 5 – mкр. Згідно з правилом важеля відношення мас рівноважних фаз дорівнює
mкр ON
;
5 – m OM
кр
mкр 25
;
5 – m 40
кр
mкр = 1,92 кг.
4. При вивченні розподілу янтарної кислоти між ефіром та водою одержано такі значення рівноважних концентрацій:
У воді с1, |
|
|
|
|
|
|
|
0,024 |
0,0571 |
0,070 |
0,121 |
0,1831 |
0,7493 |
моль/л |
|
|
|
|
|
|
В ефірі с2, |
|
|
|
|
|
|
|
0,0046 |
0,0105 |
0,013 |
0,022 |
0,033 |
0,1377 |
моль/л |
|
|
|
|
|
|
Розрахуйте коефіцієнт розподілу янтарної кислоти між ефіром та водою та запишіть рівняння закону розподілу для даної системи.
Р о з в ’ я з а н н я. Після логарифмування рівняння (4.11) отримуємо лінійну залежність
lg c2 = m lg c1 + lg K.
Параметри лінійної залежності визначаємо методом найменших квадратів, обчисливши попередньо значення lg c1 i lg c2:
lg с1 |
–1,6198 |
–1,2434 |
–1,1549 |
–0,9172 |
–0,7373 |
–0,1253 |
|
lg с2 |
–2,3372 |
–1,9788 |
–1,8861 |
–1,6576 |
–1,4815 |
–0,8611 |
|
|
|
K = 0,18; |
m = 0,99. |
|
|
||
Таким чином, для даної системи закон розподілу має вигляд
c
2 0,18 .
0,99
c
1
Отже, янтарна кислота не утворює асоціатів у ефірі.
5. До 1 л водного розчину, який вміщує 0,3 г І2, додали 100 мл сірковуглецю. Визначте масу йоду, що залишиться у водній фа-
44

Фазові рівноваги
зі після встановлення рівноваги. Скільки разів необхідно повторити екстрагування такими ж порціями сірковуглецю для того, щоб вміст йоду у водному розчині знизився до 1 10-6 г в 1 л? Коефіцієнт розподілу йоду між сірковуглецем і водою
|
c |
|
|
2 |
|
K |
|
590 . |
|
||
|
c |
|
|
1 |
|
Р о з в ’ я з а н н я . Кількість йоду, що залишився у водній |
||
фазі після однократної екстракції, розраховуємо за рівнянням (4.12):
m 0,3 |
|
1 |
|
|
|
|
|
0,005 г . |
|
|
590 |
|
||
1 |
0,1 |
|||
Для розрахунку числа екстракцій (кратності екстракції) n застосовуємо те ж рівняння:
|
|
|
|
|
n |
6 |
|
|
1 |
|
|
1 10 |
0,3 |
|
|
|
. |
|
590 |
0,1 |
|||
|
|
1 |
|
||
|
|
|
|
|
|
Після логарифмування маємо
6 |
|
1 |
|
|
lg1 10 |
lg 0,3 n lg |
|
|
; |
1 590 0,1 |
||||
n = 3.
Задачі
1.Визначте число ступенів свoбоди рівноважної системи, яка складається із водного розчину Na2SO4, кристалів льоду і водяної пари (із зовнішніх факторів на систему впливають тиск
ітемпература). Відповідь поясніть.
2.Обчисліть число ступенів свободи для рівноважної системи
|
t° |
СаСО3 |
СаО + СО2. |
Число зовнішніх факторів n = 1. Відповідь поясніть.
3. Сірка існує у двох кристалічних модифікаціях. Чи можна підібрати такі значення р і Т, щоб у рівноважній системі знаходились сірка ромбічна, моноклінична, рідка і пароподібна? Відповідь поясніть.
45

Збірник задач з фізичної та колоїдної хімії
4.Броміди натрію і калію застосовують при лікуванні захворювань нервової системи як седативні засоби. Визначте кількість рівноважних фаз і число ступенів свободи системи, яка складається з насиченого розчину КВr і NaBr, що перебуває у рівновазі з їх кристалами і водяною парою. Число зовнішніх факторів дорівнює 2.
5.Диметилформамід (ДМФА) застосовується як розчинник у виробництві барбамілу та інших барбітурових препаратів. Для вибору оптимальних умов проведення регенерації були визначені значення тиску насиченої пари ДМФА при різних температурах:
Т, К |
373 |
383 |
393 |
403 |
423 |
425 |
433 |
|
|
|
|
|
|
|
|
р, гПа |
189,1 |
270,5 |
380,1 |
525,1 |
956,9 |
1010,8 |
1265,4 |
|
|
|
|
|
|
|
|
Розрахуйте середнє значення теплоти випаровування ДМФА у вивченому інтервалі температур, а також температуру його кипіння при нормальному атмосферному тиску.
6. Розрахуйте молярну теплоту випаровування діетилового ефіру, що застосовується для інгаляційного наркозу, якщо поблизу температури кипіння (307,9 К) при тиску 101325 Па
dp = 3,53 103 Па/К. Одержане значення порівняйте із довідковим dT
( Нвип = 2,67 104 Дж/моль) і оцініть похибку розрахунку.
7. При збільшенні температури на 1° тиск пари І2 збільшується
на 5,8 102 Па. Обчисліть Нсубл йоду при температурі його плавлення (114°С), якщо тиск пари твердого йоду при цій
температурі дорівнює 1,1849 104 Па.
8.Знайдіть зміну тиску пари води при збільшенні температури на один градус поблизу температури кипіння при нормальному атмосферному тиску. Теплота випаровування води при температурі кипіння при тиску 101,325 кПа дорівнює 2255,1 кДж/кг.
9.Розрахуйте Нвип і температуру кипіння діетилового ефіру при нормальному атмосферному тиску за температурною залежністю тиску насиченої пари:
46

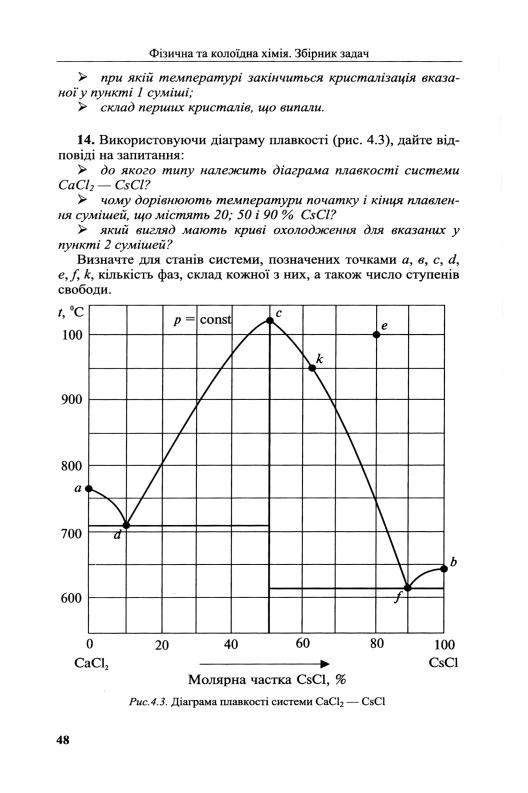

Збірник задач з фізичної та колоїдної хімії
Рис.4.5. Діаграма плавкості системи антипірин — ментол
17. Побудуйте діаграму плавкості для системи камфора — бензойна кислота за такими даними:
Масова частка камфори, % |
0 |
10 |
30 |
60 |
80 |
100 |
|
|
|
|
|
|
|
t початку кристалізації, °С |
121 |
114 |
97 |
60 |
115 |
178 |
|
|
|
|
|
|
|
t кінця кристалізації, °С |
121 |
56,5 |
56,5 |
56,5 |
57 |
178 |
|
|
|
|
|
|
|
За допомогою діаграми плавкості визначте: ізоморфно чи неізоморфно кристалізуються компоненти системи. Відповідь поясніть.
Вкажіть склад суміші, що має найнижчу температуру плавлення. Як називають таку суміш? Температуру? Розрахуйте число ступенів свободи для вказаної суміші. Що буде із сумішшю, яка містить 40% камфори, якщо її різко охолодити до 70°С? Визначте склад рівноважних фаз.
18. Проаналізуйте діаграму плавкості системи парафін — метилстеарат (рис.4.6), зробіть висновок щодо взаємної розчинності компонентів у твердому та рідкому станах і дайте відповіді на такі запитання:
50
