
- •Нет однозначного ответа
- •Нет однозначного ответа
- •Аммиачный буфер
- •Нужны дополнительные сведения
- •Нет однозначного ответа
- •Натрий.
- •Кальций.
- •9 % Раствор глюкозы.
- •Хлорид натрия;
- •Нет ответа
- •Нет ответа
- •Нет ответа
- •Нужны дополнительные сведения
- •Нет ответа
- •Нет ответа;
- •Нужны дополнительные сведения
- •Нет ответа;
-
*Трилон Б;
-
NaOH;
-
Н2С2О4;
-
Аммиачный буфер
-
Перманганат калия
-
Чему равен рН желудочного сока в норме ?
-
*1,5 – 3,0;
-
0,2 – 1,5;
-
3,0 – 4,0;
-
4,0 – 5,0;
-
8,0 – 9,0
-
Какое из приведенных веществ может быть использовано для приготовления стандартного раствора?
-
*H2C2O4 2 H2O;
-
NaOH;
-
KMnO4;
-
H2SO4;
-
H2O2.
-
Буферные системы обладают свойством достаточно стойко сохранять постоянство:
-
*Концентрации ионов водорода.
-
Концентрации ионов натрия.
-
Концентрации молекул углекислого газа.
-
Концентрации кислорода.
-
Концентрации ионов аммония.
-
Какой из приведенных растворов является буферной системой организма:
-
*NаНСО3 + Н2СО3;
-
NаН2РО4 + (NН4)НРО4;
-
Nа2НРО4 + КН2РО4;
-
NН4НSО4 + Nа2НРО4.
-
CH3COOH + CH3COONa.
-
Из приведенных буферных смесей укажите гидрокарбонатный буфер:
-
*H2CO3 + NaHCO3.
-
CH3COOH + CH3COONa.
-
NH4OH + NH4Cl.
-
NaH2PO4 + Na2HPO4.
-
NH4OH + NaHCO3
-
Указать значение рН для случая «пониженной кислотности» желудочного сока:
-
*3,5 – 4,5
-
1,5 – 3,0
-
1,0 – 1,5
-
2,0 – 2,5
-
рН=7
-
Указать формулу соли с кислой реакцией среды:
-
*NH4Cl
-
Na2SO4
-
KCl
-
K2S
-
Na2CO3
-
Какой химический элемент входит в состав всех без исключения органических соединений?
-
*Углерод
-
Кислород
-
Азот
-
Сера
-
Фосфор.
-
Выберите определение, которое характеризует понятие “молярность”:
-
*отношение количества вещества к объему раствора;
-
отношение количества вещества к массе раствора;
-
отношение количества вещества к массе растворителя.
-
отношение количества вещества к объему растворителя .
-
отношение массы вещества к объему раствора;
-
Выберите единицу измерения молярной концентрации эквивалента:
-
*Моль/л;
-
%,
-
Моль/кг;
-
Г/л;
-
Моль/кг растворителя
-
Указать формулу соли с нейтральной реакцией среды:
-
*NaCl
-
Fe (NO3)3
-
ZnSO4
-
K2S
-
NH4Cl
-
Из приведенных буферных смесей укажите ацетатную буферную систему:
-
*CH3COOH + CH3COONa
-
H2CO3 + NaHCO3;
-
NH4OH + NH4Cl;
-
H3BO3 + NaOH
-
KH2PO4 + NaOH;
-
Константа нестойкости комплексних ионов составляет ниже приведенные значения. Укажите какой комплексный ион будет наиболее устойчив?
-
*
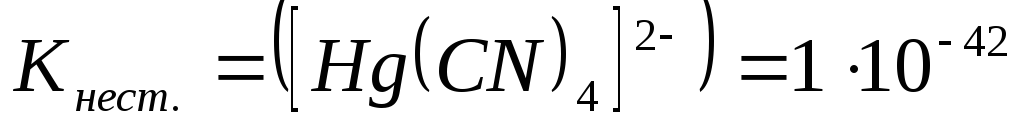
-

-
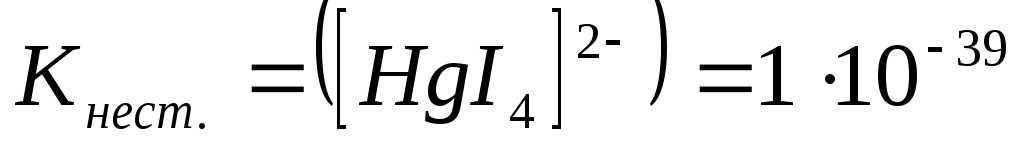
-
Нужны дополнительные сведения
-
Нет однозначного ответа
-
Укажите интервал рН для случая «повышенная кислотность» желудочного сока:
-
*1,0 –1, 5;
-
3 - 6;
-
6 – 6,5;
-
1,5 – 2,0;
-
2 - 4.
-
Чему равно осмотическое давление крови в норме?
-
*700-800 кПа
-
600-700 кПа
-
500-600 кПа
-
800-900 кПа
-
900-950 кПа
-
Указать значение рН для случая «нулевой кислотности» желудочного сока:
-
6,0
-
4,0
-
2,0
-
8,0
-
10,0
-
Какой раствор надо добавить к воде, чтобы увеличить рН?
-
*едкий калий;
-
азотную кислоту;
-
аммоний ацетат;
-
хлорид натрия
-
соляную кислоту
-
Какой способ выражения концентраций используется для расчета осмотического давления?
-
Молярная концентрация
-
Процентная концентрация
-
Моляльная концентрация
-
Мольная доля
-
Молярная концентрация эквивалента
-
Наибольшее значение буферной емкости крови обеспечивает:
-
*Гемоглобиновый + Гидрокарбонатный буферы;
-
Гемоглобиновый буфер;
-
Ацетатный буфер + Гидрокарбонатный буфер
-
Фосфатный буфер;
-
Гидрокарбонатный буфер.
-
Растворимость газов в жидкостях с повышением температуры:
-
уменьшается;
-
увеличивается;
-
не изменяется
-
нет однозначного ответа
-
нужны дополнительные сведения
-
В каких единицах измеряется титр раствора?
-
*г/мл;
-
кг;
-
г;
-
кг\л;
-
кг\дм3.
-
Изоэлектрическая точка белка, содержащего равные количества - NН2 и - СООН групп, соответствует:
-
*рН = 7;
-
рН 7;
-
рН 7;
-
рН = 8;
-
рН = 5.
-
Гемолиз происходит вследствие:
-
*Движения молекул воды из клетки
-
Движения внутриклеточных ионов из клетки
-
Движения воды в клетку
-
Движения внеклеточных ионов в клетку
-
Двустороннего движения молекул воды
-
Как рассчитать рН в растворе соляной кислоты?
-
*рН = -lgCк-ты
-
pH = 14 – lgCк-ты
-
рН = -lgCк-ты
-
рН = lgCк-ты
-
формулы не существует
-
Что происходит с эритроцитом при помещении его в 0,2% раствор NаСl ?
-
*Гемолиз;
-
Ничего не происходит;
-
Плазмолиз;
-
Нельзя дать ответ;
-
Нужны дополнительные сведения
-
Плазмолиз происходит при помещении эритроцита в:
-
*Гипертонический раствор
-
Гипотонический раствор
-
Изотонический раствор
-
5%-ный раствор глюкозы
-
0,9 %-ный раствор хлорида натрия
-
Растворимость газов при повышении давления:
-
*Растет
-
Падает
-
Не изменяется
-
Растет, а затем падает
-
Падает, а затем растет
-
Выберите раствор, изотоничный крови:
-
*0,9%-ный раствор хлорида натрия
-
5%-ный раствор хлорида натрия
-
0,5%-ный раствор хлорида натрия
-
9%-ный раствор хлорида натрия
-
Дистиллированная вода
-
Выберите раствор, гипертоничный относительно крови:
-
*5%-ный раствор хлорида натрия
-
0,5%-ный раствор хлорида натрия
-
0,9%-ный раствор хлорида натрия
-
0,2%-ный раствор хлорида натрия
-
Дистиллированная вода
-
Какую массу гидроксида натрия нужно взять для нейтрализации 36,5 г соляной кислоты?
-
*40г
-
36,5г
-
80г
-
71г
-
4г
-
Если рН крови 7,5, какой препарат нужно ввести больному для коррекции кислотно-основного равновесия крови?
-
*5%-ный раствор аскорбиновой кислоты
-
5%-ный раствор питьевой соды
-
Изотоничный раствор хлорида натрия
-
Изотоничный раствор глюкозы
-
Гипертоничный раствор глюкозы
-
Если рН крови 7,29, какой препарат нужно ввести больному для коррекции кислотно-основного равновесия крови?
-
*4%-ный раствор питьевой соды
-
5%-ный раствор аскорбиновой кислоты
-
Изотоничный раствор хлорида натрия
-
Изотоничный раствор глюкозы
-
Гипертоничный раствор глюкозы
-
Укажите состояние алкалоза:
-
*рН=7,55
-
рН=7,35
-
рН=7.45
-
рН=7,25
-
рН=7,15
-
Укажите состояние ацидоза:
-
*рН=7,25
-
рН=7,55
-
рН=7,35
-
рН=7.45
-
рН=7,65
-
Какие растворы называются гипотоническими по отношению к крови?
-
*Растворы с меньшим осмотическим давлением, чем крови в норме
-
Растворы с большим осмотическим давлением, чем крови в норме
-
Растворы с равными осмотическими давлениями
-
Растворы, содержащие одно и то же растворенное вещество
-
Растворы, имеющие одинаковые процентные концентрации разных растворенных веществ
-
Какие растворы называются гипертоническими по отношению к крови?
-
*Растворы с большим осмотическим давлением, чем крови в норме
-
Растворы с меньшим осмотическим давлением, чем крови в норме
-
Растворы с равными осмотическими давлениями
-
Растворы, содержащие одно и то же растворенное вещество
-
Растворы, имеющие одинаковые процентные концентрации разных растворенных веществ
-
Выберите из приведеных систем фосфатную буферную систему организма:
-
*NaH2PO4 + Na2HPO4.
-
NH4OH + NH4Cl;
-
H3BO3 + NaOH
-
KH2PO4 + NaOH;
-
CH3COOH + CH3COONa
-
В растворе какого вещества рН меньше?
-
*Н2SO4
-
HCl
-
CH3COONa
-
Na2CO3
-
NaOH
-
В состав молекулы гемоглобина в качестве комплексообразователя входит:
-
*Fe2+
-
Fe3+
-
Co2+
-
Co3+
-
Zn2+
-
Если активная кислотность желудочного сока составляет 20-40 титриметрических единиц, какое значение рН может соответствовать этому состоянию?
-
*рН= 1,5 – 3,0;
-
рН= 1,0-1,5
-
рН= 3,0-4,0
-
рН= 4,0-5,0
-
рН= 5,0-6,0
-
Укажите в каком случае при титровании скачок титрования наибольший:
-
*сильная кислоты сильным основанием;
-
сильной кислоты слабым основанием;
-
слабой кислоты сильным основанием;
-
сильного основания слабой кислотой;
-
слабой кислоты слабым основанием
-
Ковалентная неполярная связь имеется в молекуле:
-
*Хлора;
-
Хлороводорода;
-
Воды;
-
Сероводорода.
-
Хлорэтана
-
К сильным электролитам относится:
-
*Сульфат натрия;
-
Муравьиная кислота;
-
Сернистая кислота;
-
Уксусная кислота.
-
Угольная кислота
-
Молярная масса вещества измеряется в:
-
*г/моль;
-
а.е.м.;
-
а.е.м/моль;
-
м3/моль.
-
м2/моль
-
При взаимодействии оснований с кислотами образуется:
-
*Соль и вода;
-
Соль и новая кислота;
-
Две соли;
-
Оксиды и вода.
-
Соль и новое основание
-
Молекулярная масса вещества измеряется в:
-
*А.е.м.;
-
г/моль;
-
а.е.м/моль;
-
м3/моль;
-
м2/моль
-
Укажите основной внутриклеточный ион:
-
*К+
-
Na+
-
Li+
-
Fe2+
-
Ca2+
-
Укажите основной внеклеточный ион:
-
*Na+
-
Li+
-
Fe2+
-
Co2+
-
К+
-
Присутствием каких катионов обусловлена общая жесткость воды?
-
*Ca2+, Mg2+
-
Ca2+, Na+
-
Mg2+,Fe2+
-
Ca2+, К+
-
Mg2+,Co2+
-
Без присутствия какого катиона невозможен процесс свертывания крови?
-
*Ca2+,
-
Mg2+
-
Na+
-
Fe2+
-
К+
-
В каком ряду представлены только элементы-органогены?
-
*H, C, O, N, P, S
-
Na, H, P, S, Cl, Li
-
Fe, C, O, N, P, S
-
Ca, Fe, P, S, N, O
-
Mg, Cl, H, C, N, Ca
-
Выберите ряд, в котором указаны только лиганды:
-
*SO42-, Cl-, H2O
-
H2O, Cl-, Na,
-
SO42-, F-, Fe2+
-
Ni2+, OH-, NH3
-
Br-, NH3, Ag+
-
Выберите ряд, в котором указаны только комплексообразователи:
-
*Fe2+, Fe3+, Cr3+
-
Zn2+, Fe2+, Cl-
-
Cu2+, Fe3+, Na+
-
Co2+, Pt2+, Li+
-
Cr3+, Ag+, Cl-
-
Какой из перечисленных биогенных элементов, являясь макроэлементом, находится в организме в виде ионов?
-
*Хлор;
-
Медь;
-
Фтор;
-
Азот.
-
Углерод;
-
Какой из перечисленных ионов активирует фермент амилазу, секретируемую слюнными железами?
-
*
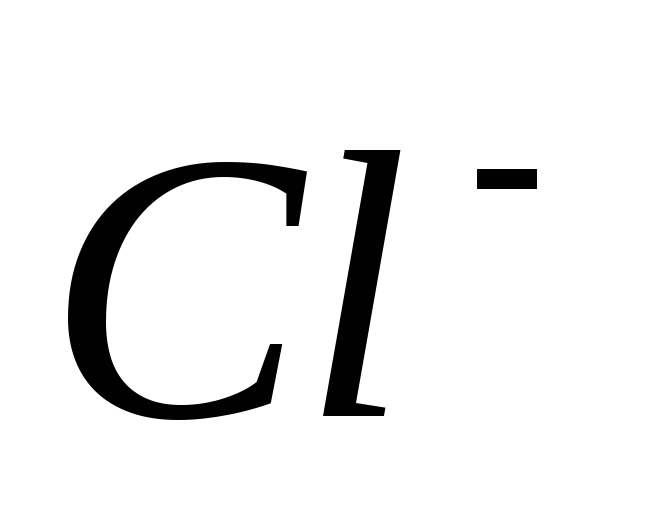
-
 .
.
-
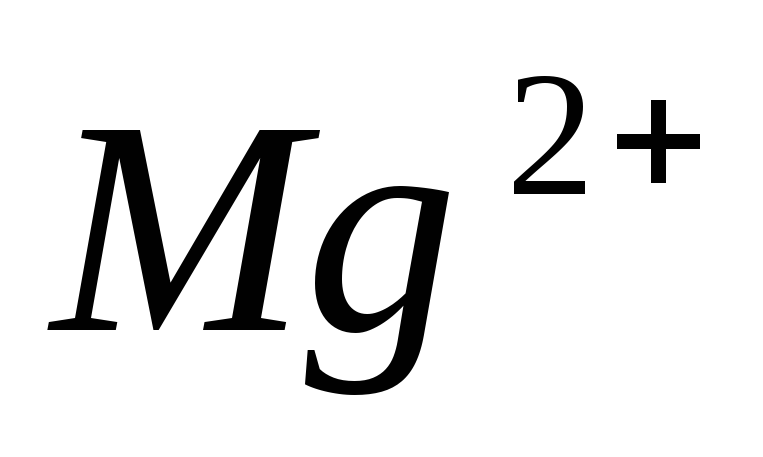 .
.
-
 .
.
-
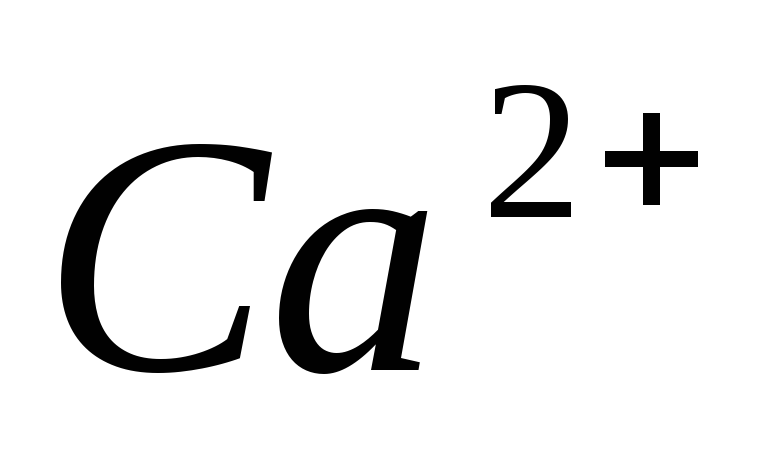 .
.
-
Какой элемент участвует в синтезе гормона поджелудочной железы – инсулина и является его незаменимым структурным компонентом?
-
Цинк
-
Сера.
-
Калий.
-
Кальций.
-
Йод
-
Дентатность лиганда определяется
-
*Количеством -связей, образованных лигандом.
-
Количеством лигандов.
-
Зарядом комплексообразователя.
-
Координационным числом.
-
Количеством -связей, образованных комплексообразователем.
-
Какой из указанных металлов входит в состав ферментов, катализирующих окислительно-восстановительные процессы в организме:
